头颈部黏液表皮样癌CT表现
沈莎莎,常雯,韩丹,刘顼,薛凤麟
1.昆明医科大学研究生学院,云南昆明 650500;2.昆明医科大学第一附属医院影像学科,云南昆明 650032;3.昆明医科大学第一附属医院病理科,云南昆明 650032;
黏液表皮样癌(mucoepidermoid carcinoma,MEC)是一种常见的涎腺恶性肿瘤,占涎腺肿瘤的5%~12%[1-2]。根据癌细胞分化程度及生物学行为,MEC可分为低度恶性和高度恶性[3]。不同病理级别的MEC预后及治疗方式不同。本病临床表现缺乏特异性,术前诊断较为困难。目前国内外关于头颈部MEC的影像学报道较少,关于不同病理级别头颈部 MEC的CT表现报道更少。CT可以确定头颈部MEC的部位、累及范围及其与周围组织解剖的关系,对术前评估及指导手术切除具有重要价值。因此,本研究拟通过回顾性分析经手术病理证实的58例头颈部MEC患者的临床及影像学资料,并与病理分级结果对比,探讨CT对MEC的诊断价值。
1 资料与方法
1.1 研究对象 回顾性分析2009年1月-2017年5月我院经手术及病理证实,并具有完整临床及影像学资料的头颈部MEC患者58例。所有患者在CT检查2周内行手术切除并获得病理结果。其中男22例,女36例;年龄10~75岁,平均(40.8±17.2)岁。
1.2 临床表现 无意发现头颈部肿物51例,其中临床触诊包块质地中等40例(68.97%),固定无活动,无压痛,其中界限清楚32例,界限不清8例,均无其他临床症状;包块质硬或韧11例,固定无活动,界清6例,界不清5例,11例中伴压痛5例,伴鼻塞3例,伴瘘道2例,伴面部麻木1例;其余7例为体检发现。仅2例(3.45%)触及颈部淋巴结肿大。
1.3 仪器与方法 采用Siemens Definition Flash 64排螺旋CT或Siemens Definition AS 64排螺旋CT扫描。本组中4例患者行平扫、54例患者行平扫加双期增强扫描。层厚5 mm,螺距0.8。常规平扫后,经肘前静脉注射对比剂行增强扫描,使用高压注射器,增强扫描采用对比剂碘海醇(300 mgI/ml),剂量1.5 ml/kg,注射流速2.5~3.0 ml/s,延迟30 s行动脉期及60 s静脉期双期增强扫描,层厚1 mm、间隔0.7 mm薄层重建。
1.4 图像评价 由2名从事头颈影像学诊断的高年资主治医师回顾性分析CT表现,包括病变的部位、形态、密度、边缘、囊变坏死、强化程度、临近结构侵犯、颈部淋巴结肿大、远处转移等[4-5]。结论不一致时,再请一位主任医师判断。诊断分类包括以下方面,①病灶部位:依据病灶主体所在部位按解剖器官定位。②病灶形态:分为规则及不规则2类,规则包括圆形、椭圆形、类圆形;不规则为分叶状。③病灶边界:清晰、不清晰。④病灶强化程度:以增强扫描后CT值增加净值为准,增加值<20 HU为轻度强化,20~40 HU为中等强化,>40 HU为明显强化。测量CT值时,避开病灶稍低密度区、钙化及伪影区。⑤病灶与邻近组织的关系:主要观察邻近肌群、邻近骨质、间隙等。若邻近组织密度正常、结构清晰完整、无浸润及破坏,则认为无侵犯;反之认为受侵犯。⑥淋巴结转移:单个淋巴结短径≥10 mm或多个直径≥7 mm,相互融合,或强化方式及程度与病变相同。
1.5 统计学方法 采用SPSS 17.0软件,计量资料以±s表示,两组性别比较采用χ2检验,年龄比较采用t检验。两组CT表现比较计数资料采用χ2检验,当理论频数<1时,采用Fisher确切概率法检验,P<0.05表示差异有统计学意义。
2 结果
2.1 MEC部位 58例 MEC患者中,腮腺 21例(36.21%),腭部14例(24.14%),颌骨及颌区13例(22.41%),鼻咽部及咽旁4例(6.90%),鼻腔3例(5.17%),磨牙后区 1例(1.72%),中耳 1例(1.72%),面颊部1例(1.72%)。
2.2 CT表现 58例 MEC患者中,病灶最大径1.1~7.5 cm,平均(3.10±1.57)cm;单发结节或肿块56例,多结节并融合2例;形态不规则43例;病灶不均匀明显强化40例(图1A、B),其中发生囊变坏死14例,伴多发小囊腔(边界清晰、内壁光滑的多发小片状无强化低密度区)36例(图1B),伴钙化(大小不一、形态不规则)7例;病灶边界不清晰48例,邻近组织受侵犯32例(图2A、B),颈部淋巴结转移16例。本组患者无一例发现远隔器官的转移。
2.3 病理诊断结果 肿瘤体积大小不一,边界清或不清,无明显包膜,质地中等偏硬,切面可见大小不等的囊腔,表面呈结节状,有时可呈囊性。镜下肿瘤由黏液细胞、表皮样细胞和中间细胞组成,数种细胞常混合存在,免疫组化结果示CK(+)、CK8(+)、CK5/5(+)、EMA(+)、S-100部分细胞阳性。58例MEC患者按恶性度可分为低度恶性型29例(图1C)、高度恶性型11例(图2C),其余未分级。
2.4 不同恶性程度患者性别、年龄及 CT表现比较29例低度恶性组患者中,女22例,男7例;11例高度恶性组中,女2例,男9例,两组性别比较,差异有统计学意义(χ2=8.783,P<0.01)。两组CT表现在多发小囊腔(χ2=5.47)及邻近结构侵犯(χ2=5.673)比较,差异均有统计学意义(P<0.05);而在年龄、形态、边缘、钙化、囊变坏死、强化程度、颈部淋巴结转移、远隔转移等比较,差异均无统计学意义(P>0.05)。见表1。
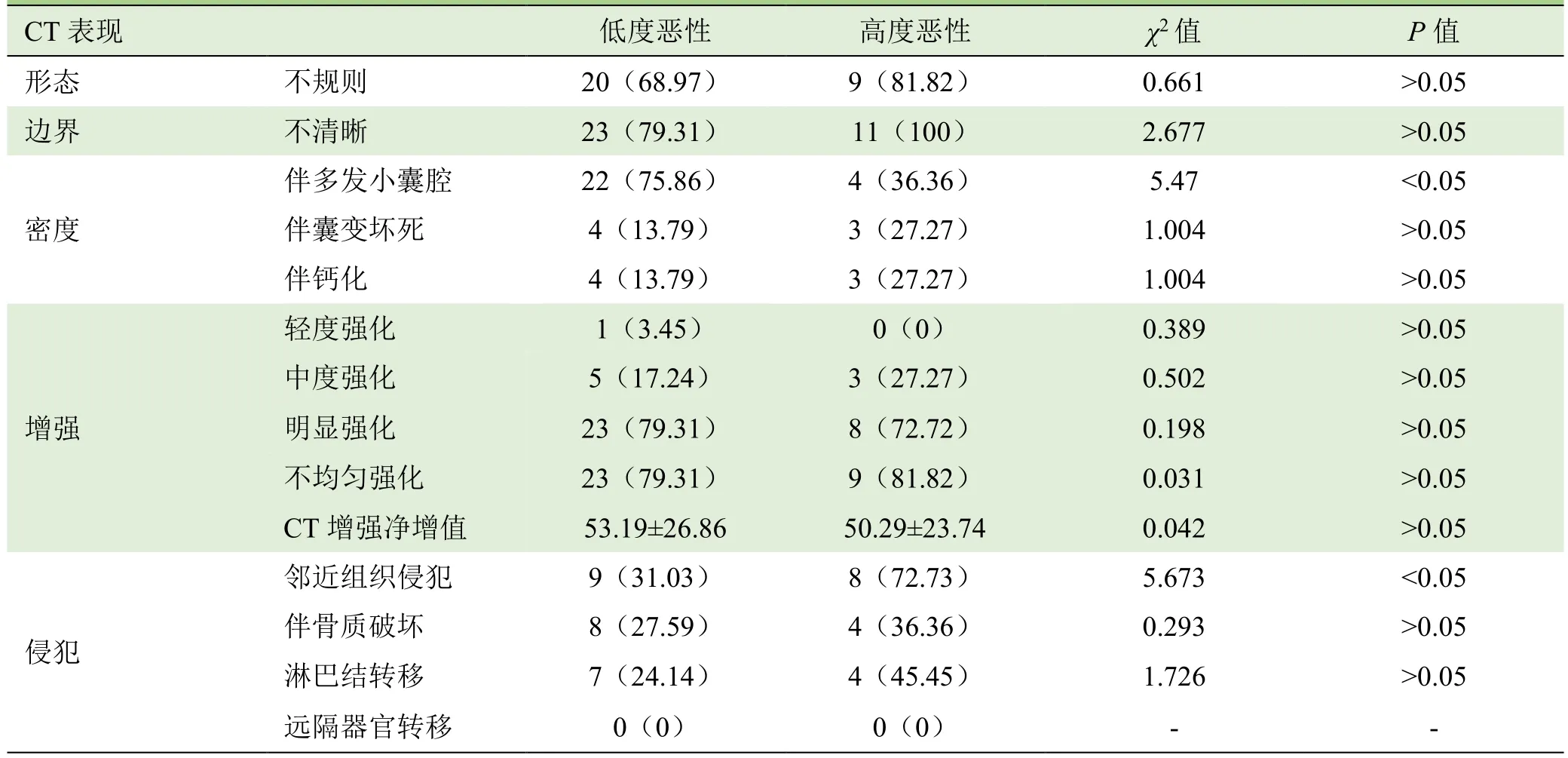
表1 低度恶性组与高度恶性组CT表现比较[例(%)]
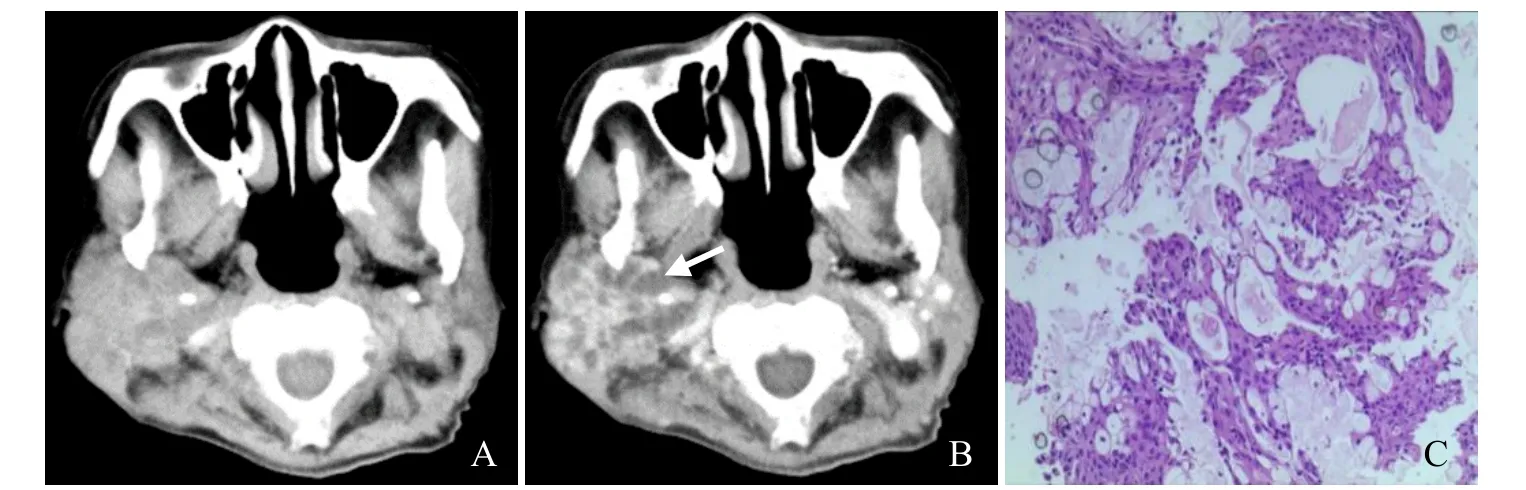
图1 女,46岁,低度恶性MEC。平扫示右侧腮腺占位,CT值约47 HU,咽旁间隙尚清晰(A);动脉期轴位CT值89 HU,多发未强化的小囊腔(箭),呈明显不均匀强化(B);病理镜下见表皮样细胞、中间细胞及较多黏液细胞,低度恶性MEC(HE,×10,C)
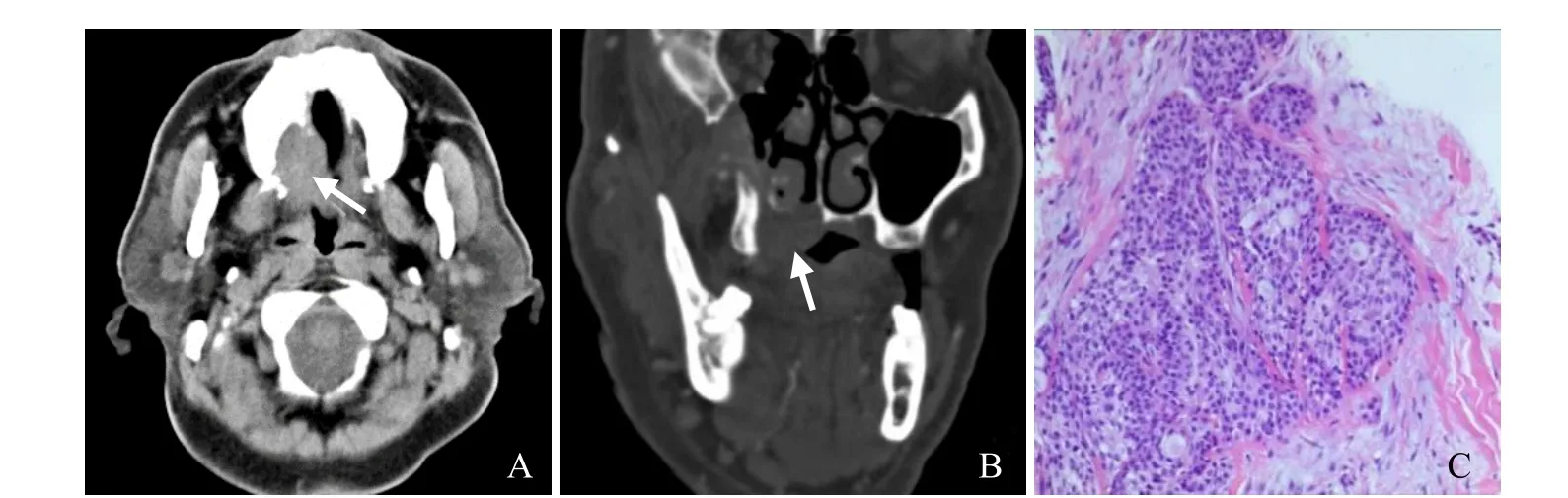
图2 女,44岁,高度恶性MEC。轴位平扫及冠状位骨窗示右上腭部软组织肿块(箭),硬腭局部骨质破坏(A、B);病理镜下见黏液细胞、中间细胞及较多表皮样细胞,高度恶性MEC(HE,×10,C)
3 讨论
MEC由Stewart于1945年命名,来源于腺体及小涎腺腺管的上皮细胞,多发生于腮腺[6]。本组患者中,36.21%位于腮腺,稍低于张慧红等[7]的报道结果。其次腭、唇、磨牙后区、舌根、下颌骨中心部、上颌窦及其他小涎腺也可发生,发生于鼻腔、鼻咽部等部位者少见。女性略多于男性[8]。本组发生于头颈部的MEC患者男女比为1∶1.64,且低度恶性组女性较高度恶性组多见。发病年龄以30~50岁多见,本组平均发病年龄(40.8±17.2)岁。
目前MEC病因未明,临床表现缺乏特异性,主要表现为固定无活动的无痛性肿块[1]。本组无意发现头颈部无痛性肿物 40例(68.97%),文献报道为60.1%[9]。多数为单结节或肿块,少数为多结节,大小不一,与文献报道相符[10]。病灶边界多不清楚,形态欠规则或不规则为肿瘤浸润所致。瘤内常伴发多发小囊腔,增强扫描呈明显强化。肿瘤明显强化与外周小血管向其内部延伸及肿瘤细胞释放多种具有刺激血管增生的细胞因子进而刺激血管生长有关。病灶密度均匀性以强化后表现为标准。本组 74.07%不均匀强化,其可能原因为:①恶性肿瘤生长快,病变中心往往发生液化坏死;②MEC的特点为病灶内可见低密度的含黏液囊腔,病理基础可能是大量瘤细胞可形成大小不等的囊腔,囊壁衬里含黏液样细胞,囊腔内含黏液[11]。本组 62.07%的 MEC伴多发小囊腔改变,24.14%发生囊变坏死。涎腺肿瘤很少出现钙化[12]。本组伴钙化7例(12.07%),多为肿瘤坏死后出现的营养不良性钙化。既往研究显示,MEC是低度恶性肿瘤,侵袭性较弱[13]。本研究中,48.26%发生邻近组织侵犯,但均未发现远隔转移,且淋巴结转移率低[14]。本组淋巴结转移率为 27.59%,与 Spiro等[15]报道的29%发生淋巴结肿大相似,但明显高于刘梦琦等[16]报道的4.3%,原因可能是CT所见的淋巴结肿大多未经病理证实为转移。
病理诊断MEC的可靠依据是肿瘤区域由黏液细胞、表皮样细胞和中间细胞组成。以低度恶性型多见,本组72.5%为低度恶性型。低度恶性的MEC黏液细胞占 50%以上,常见呈灶性聚集的黏液细胞及小囊腔,主要影像表现为边界清晰,常伴有多发小囊腔,CT双期动态增强扫描呈明显不均匀强化,MRI多出现长T1WI、长T2WI影像[17],与大多数良性肿瘤,尤其是混合瘤及腺淋巴瘤鉴别困难。本组 75.86%的低度恶性组及 36.36%的高度恶性组伴多发小囊腔改变,且低度恶性组较高度恶性组易出现;79.31%的低度恶性组边界不清晰,可能与微囊结构融合形成的大囊破裂、囊内物质所诱发的炎症反应及病例数较少有关。高度恶性的MEC黏液细胞少于10%,表皮样细胞分化差呈团块,且随着恶性程度增高,病灶内黏液含量逐渐减少,实性成分增多,核多形性并可见有丝分裂,具有更强的侵袭性以及远处和淋巴结转移倾向,预后也较差。影像学多表现为实性肿块,边界不清晰,易发生坏死、侵犯及转移,MRI常表现为短T1WI、长T2WI[4],其病理基础为表皮样细胞含量较多,增强扫描呈明显不均匀强化,与头颈部其他恶性肿瘤鉴别困难。本组高度恶性组边界均不清晰,且较低度恶性组易侵犯邻近组织。既往研究显示,低级别的MEC强化程度高于高级别MEC,其原因可能是黏液细胞间含有较多的毛细血管聚集,而高级别MEC黏液细胞比例低,血供相对较少[18]。本组低度恶性强化CT净增值平均(53.19±26.86)HU,高度恶性强化 CT净增值(50.29±23.74)HU,与文献报道相符。Wang等[19]报道,低度恶性MEC患者的5年生存率达95%,而高度恶性型仅为50%。目前低度恶性MEC的治疗方式以手术为主,高度恶性MEC辅以术后放化疗。
本研究的局限性为样本量相对较少,部分病理结果未明确恶性程度为低、中或高分化,故未进行细化并分组讨论;本研究为回顾性研究,大部分MEC患者术前未行MRI检查,故未对MEC的MRI表现进行详述,有待今后搜集更多病例进一步研究。
总之,头颈部MEC具有一定的影像学特点,CT主要表现为形态不规则,边界欠清晰,增强扫描呈持续性明显不均匀强化,可伴多发小囊腔、钙化及邻近组织结构侵犯,淋巴结及远隔器官转移少见,确诊依靠病理检查。MEC的CT征象在一定程度上间接反映MEC的病理学特征,掌握其影像特征有助于术前了解病变的大小、部位、形态、数量、瘤体血供,以及与周围血管的关系,从而初步判断瘤体性质并制订合适的治疗方案。
[1] Chan RC, Chan JY. Head and neck mucoepidermoid carcinoma: a curious association with second primary malignancy. Otolaryngol Head Neck Surg, 2014, 151(5):797-801.
[2] Byrd SA, Spector ME, Carey TE, et al. Predictors of recurrence and survival for head and neck mucoepidermoid carcinoma. Otolaryngol Head Neck Surg, 2013, 149(3): 402-408.
[3] 佘笠, 谭浩蕾, 刘勇, 等. 喉部黏液表皮样癌的临床分析.中国耳鼻咽喉颅底外科杂志, 2015, 21(6): 444-446.
[4] 侯学文, 张利中. 腮腺肿瘤的多层螺旋CT表现. 中国医疗设备, 2016, 31(5): 60-63.
[5] 邱焕, 江明祥, 邵国良, 等. 腮腺粘液表皮样癌的 CT表现分析. 医学影像学杂志, 2017, 27(12): 2272-2275.
[6] Stewart FW, Foote FW, Becker WF. Muco-Epidermoid tumors of salivary glands. Ann Surg, 1945, 122(5): 820-844.
[7] 张慧红, 乐洪波, 吴先衡, 等. 涎腺黏液表皮样癌 CT的诊断. 临床放射学杂志, 2015, 34(12): 1890-1894.
[8] Nance MA, Seethala RR, Wang Yun, et al. Treatment and survival outcomes based on histologic grading in patients with head and neck mucoepidermoid carcinoma. Cancer,2008, 113(8): 2082-2089.
[9] Pires FR, de Almeida OP, de Araújo VC, et al. Prognostic factors in head and neck mucoepidermoid carcinoma. Arch Otolaryngol Head Neck Surg, 2004, 130(2): 174-180.
[10] 吴红珍, 江新青, 魏新华, 等. 腮腺粘液表皮样癌的 CT诊断及鉴别诊断(附 3例报告). 中国 CT和 MRI杂志,2015, 13(2): 10-11, 23.
[11] 张惠, 向素芳, 邓立强, 等. 涎腺粘液表皮样癌的超声表现及病理学基础. 四川医学, 2014, 35(9): 1235-1237.
[12] Yoon JH, Ahn SG, Kim SG, et al. Calcifications in a clear cell mucoepidermoid carcinoma of the hard palate. Int J Oral Maxillofac Surg, 2005, 34(8): 927-929.
[13] 袁文欣, 刘立志, 崔春燕, 等. 粘液表皮样癌临床与影像特点的研究. 中国CT和MRI杂志, 2012, 10(5): 27-30.
[14] 李多, 周新华, 吕平欣. 肺粘液表皮样癌的CT影像表现.医学影像学杂志, 2013, 23(4): 539-541.
[15] Spiro RH, Huvosa G, Berk R, et al. Mucoepidermoid carcinoma of salivary gland origin. A clinicopathologic study of 367 cases. Am J Surg, 1978, 136(4): 461-468.
[16] 刘梦琦, 吴南洲, 陈志晔, 等. 唾液腺黏液表皮样癌 CT表现与病理对照研究. 中国医学影像学杂志, 2012, (9):660-663.
[17] Kato H, Kanematsu M, Makita H, et al. CT and MR imaging findings of palatal tumors. Eur J Radiol, 2014, 83(3): 137-146.
[18] Zhang X, Cao J, Luo J, et al. Nasopharyngeal mucoepidermoid carcinoma: a review of 13 cases. Oral Oncol, 2010, 46(8): 618-621.
[19] Wang YQ, Mo YX, Li Sheng, et al. Low-grade and highgrade mucoepidermoid carcinoma of the lung: CT findings and clinical features of 17 cases. Am J Roentgenol, 2015,205(6): 1160-1166.

