水飞蓟宾通过Wnt/β-catenin通路抑制肾癌细胞干细胞特性
范义增,淡炜超,2,白欣姗,2,任加强,2,高 歌,2,栾嘉欣,2,贺大林,曾 津
(西安交通大学:1.第一附属医院泌尿外科;2.医学部,陕西西安 710061)
肾细胞癌简称肾癌(renal cell carcinoma,RCC),是常见的泌尿系恶性肿瘤,其发病率占成人恶性肿瘤的2%~3%,其中肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)占70%~80%[1]。在我国,近年来肾癌的发病率有上升的趋势,严重威胁人民的生命健康安全,与其他的肿瘤相比,肾癌因其原发性耐药及耐放射等特性,传统的治疗方法除外科手术外,化疗、放疗、免疫治疗等并不能起到良好的治疗效果;对于晚期转移性肾癌,即使患者接受了靶向治疗,仍然有相当部分患者出现靶向药物治疗失败。因此,寻找及研究新型、高效的抗肾癌药物仍然是目前泌尿外科研究领域的热点和难点。
水飞蓟宾是从菊科植物水飞蓟的种子和果实中提取得到的黄酮类化合物,是最具生物活性的部分,在临床上多用于保肝及抗氧化药物。随着近年研究的不断深入,水飞蓟宾新的药理效应和临床价值不断被人们所熟知,近年来其抗癌效果越来越受到人们的重视,既往文献以及我们的前期研究报道中发现水飞蓟宾在肝癌、乳腺癌、膀胱癌及前列腺癌等肿瘤中均发挥重要的抗癌作用[2-5]。我们研究团队围绕水飞蓟宾在泌尿系肿瘤中的作用,开展了一系列原创性研究,取得了阶段性成绩。在肾癌中,我们的前期研究发现水飞蓟宾可显著抑制肾癌细胞的增殖、诱导其发生凋亡[6]以及抑制其侵袭转移能力[7]。但其确切分子机制仍未完全清楚。近年来肿瘤干细胞在肿瘤的发生发展过程中的所起到的关键作用逐渐受到肿瘤研究者的大力关注,但是对于水飞蓟宾是否影响肾癌细胞的干细胞特性目前却了解较少。
本实验旨在研究水飞蓟宾对肾癌细胞干细胞特性的影响,从而探究水飞蓟宾抗肾癌的新分子机制,为肾癌的临床治疗方法提供思路。另外,进一步深入了解水飞蓟宾发挥其抗肿瘤功能的分子机制基础,可以对水飞蓟宾在其他肿瘤治疗中的应用也具有一定的指导意义。
1 材料与方法
1.1材料人肾癌细胞株786-O和ACHN购自美国ATCC细胞库。RPMI-1640培养基购自美国Gibco公司;DMEM/F12培养基购自美国Gibco公司;胎牛血清购自杭州四季青公司;表皮细胞生长因子(epidermal growth factor,EGF)和成纤维细胞生长因子(basic fibroblast growthfactor,bFGF)购自美国Sigma公司;B27购自美国Gibco公司;水飞蓟宾购自美国Sigma公司;CD44和P63抗体购自美国abcam公司;β-catenin抗体和GSK3β/p-GSK3β抗体购自美国CST公司;β-ACTIN抗体购自沈阳万类生物科技有限公司。
1.2细胞培养人肾癌细胞株786-O和ACHN细胞均为贴壁细胞,培养于含10%胎牛血清的DMEM培养基中,加入100 μg/mL的青霉素/链霉素,置于5%CO2、37 ℃条件下培养箱培养。每2~3 d细胞换液,细胞贴壁达到80%时使用0.25%胰酶消化离心进行传代。
1.3Westernblot法检测相关蛋白的表达细胞胰蛋白酶消化离心后传代,种于6孔板内,待细胞贴壁后对细胞进行不同处理,取出并弃去上清,用PBS冲洗3次加入RIPA细胞裂解液,冰上静置1 min后刮下裂解物并转移至1.5 mL离心管,震荡混匀30 s,冰上静置10 min,4 ℃、15 000 r/min离心15 min,提取上清总蛋白。 Bradford法检测各组蛋白浓度,30 μg样品蛋白上样经SDS-PAGE凝胶分离,110 V电压2 h转膜至PVDF 膜上,5%脱脂奶粉室温封闭1 h,加入一抗抗体在4 ℃摇床孵育过夜,次日TBST 洗膜10 min×3次,加入相应的二抗室温封闭1 h,TBST 洗膜10 min×3 次,使用ECL显影液进行显影,使用Image J 软件计算目的蛋白与内参蛋白的灰度比值。
1.4平板克隆形成实验收集对数期786-O和ACHN细胞制成细胞悬液,以每孔1 000个细胞的密度接种于6孔板内培养,分别加入不同浓度水飞蓟宾处理,置于含5%CO2、37 ℃培养箱中培养1周。终止培养后使用4%多聚甲醛固定细胞15 min,PBS冲洗后加入结晶紫色液染色20~30 min,以流水缓慢洗去染色液,空气干燥后用肉眼直接计数克隆并拍照。
1.5肿瘤干细胞成球实验(Tumorsphere实验) 收集生长到对数期的肾癌细胞786-O和ACHN,胰酶消化后收集到离心管,离心后使用DMEM/F12无血清培养基(含EGF 20 ng/mL,bFGF 10 ng/mL,B27 2%)制成细胞悬液,以每孔4 000个细胞的密度接种于低粘附性24孔板内,置于37 ℃、含5%CO2培养箱中培养1周。再次收集细胞离心重悬,并更换新鲜DMEM/F12无血清培养基(含EGF 20 ng/mL,bFGF 10 ng/mL,B27 2%)继续在相同环境下培养1周,倒置24孔板在显微镜下观察拍照,并计数肿瘤球个数,进行统计分析。
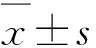
2 结 果
2.1水飞蓟宾可通过剂量依赖的方式下调肾癌细胞干细胞标记物的表达结合我们前期已发表的研究成果,使用60 μmoL/L水飞蓟宾(silibinin)处理786-O细胞以及80 μmoL/L水飞蓟宾处理ACHN细胞24 h后均未引起明显的细胞增殖抑制[6],故我们首先使用不同浓度的水飞蓟宾处理肾癌细胞系780-O和ACHN 24 h,通过Western blot技术检测干细胞标记物CD44以及P63蛋白表达量的变化。结果显示,与对照组相比,786-O细胞系(图1A、B)和ACHN细胞系(图1C、D)CD44和p63蛋白表达量随着水飞蓟宾剂量的增加而逐渐降低,差异均有统计学意义(P<0.05)。
2.2水飞蓟宾可通过时间依赖的方式下调肾癌细胞干细胞标记物的表达进一步使用60 μmoL/L的水飞蓟宾分别处理786-O细胞0、6、12、18、24 h,以及使用80 μmoL/L的水飞蓟宾于相同的时间梯度下分别处理ACHN细胞,通过Western blot技术检测CD44和p63蛋白的表达变化。结果显示,与对照组比较,786-O细胞系(图2A、B)和ACHN细胞系(图2C、D)CD44和P63的表达量随着水飞蓟宾处理时间的延长而逐渐下降,差异具有统计学意义(P<0.05)。以上结果提示了水飞蓟宾可以通过时间-剂量依赖的方式下调肾癌细胞干细胞标记物的表达。

图1水飞蓟宾通过剂量依赖性的方式下调肾癌细胞干细胞标记物的表达
不同浓度水飞蓟宾(silibinin)处理24 h后,使用Western blot检测786-O细胞(A)及ACHN细胞(B)中CD44和P63蛋白水平变化;通过Image J软件分析量化786-O细胞(C)及ACHN细胞(D)中CD44和P63蛋白灰度值相对内参比值变化。与对照组相比,*P<0.05,**P<0.01。

图2 水飞蓟宾可通过时间依赖的方式下调肾癌细胞干细胞标记物的表达
采用60 μmoL/L的水飞蓟宾分别处理786-O细胞0、6、12、18、24 h,以及使用80 μmoL/L的水飞蓟宾于相同的时间梯度下分别处理ACHN细胞,通过Western blot技术检测786-O细胞(A)及ACHN细胞(C)CD44和P63蛋白的表达变化;通过Image J软件分析量化786-O细胞(B)及ACHN细胞(D)中CD44和P63蛋白灰度值相对内参比值变化。与对照组相比,*P<0.05,**P<0.01。
2.3水飞蓟宾抑制肾癌平板克隆形成在发现水飞蓟宾可显著下调肾癌干细胞标记物的基础上,我们进一步采用平板克隆形成实验探讨水飞蓟宾对肾癌细胞克隆形成的影响。采用不同浓度梯度水飞蓟宾分别作用于786-O和ACHN细胞1周,结果显示,786-O细胞(图3A、B)以及ACHN细胞(图3C、D)平板克隆形成与空白对照相比均数量减少、体积减小,差异具有统计学意义(P<0.05)。

图3水飞蓟宾可通过剂量依赖的方式抑制肾癌平板克隆的形成
采用不同浓度梯度水飞蓟宾分别作用于786-O和ACHN细胞1周,通过平板克隆形成实验检测786-O细胞(A)及ACHN细胞(C)克隆形成的能力;量化786-O细胞(B)及ACHN细胞(D)中克隆形成数目变化。与对照组相比,*P<0.05,**P<0.01,***P<0.001。
2.4水飞蓟宾抑制肿瘤干细胞克隆球形成肿瘤干细胞成球能力是肿瘤干细胞体外鉴定的重要方法。其判断单个细胞在合适的条件培养基中自我更新的能力,一般用肿瘤干细胞克隆球数量表示。我们进一步分别用水飞蓟宾以60 μmoL/L处理786-O细胞系及80 μmoL/L处理ACHN细胞系。与对照组相比,水飞蓟宾处理后786-O细胞(图4A、B)以及ACHN细胞(图4C、D)肿瘤干细胞克隆球数量减少、体积减小,差异具有统计学意义(P<0.01)。以上平板克隆形成以及肿瘤干细胞克隆球形成结果均表明了水飞蓟宾可显著影响肾癌细胞的干性。

图4水飞蓟宾抑制肾癌干细胞克隆球的形成(×100)
分别用水飞蓟宾以60 μmoL/L处理786-O细胞系及80 μmoL/L处理ACHN细胞系,采用肿瘤干细胞克隆球形成实验检测水飞蓟宾对肾癌786-O(A、B)以及ACHN(C、D)干细胞克隆球形成数目的影响。与对照组相比,*P<0.05,
2.5水飞蓟宾抑制肾癌Wnt/β-catenin信号通路Wnt/β-catenin信号通路在肿瘤干细胞的自我复制及分化过程中起着关键的作用。我们进一步采用不同浓度梯度水飞蓟宾处理肾癌细胞系780-O和ACHN 24 h,通过Western Blot技术检测Wnt/β-catenin信号通路中关键激酶及蛋白GSK3β/p-GSK3β和β-catenin蛋白表达量的变化。同对照组相比,786-O细胞系(图5A、B)和ACHN细胞系(图5C、D)p-GSK3β和β-catenin蛋白表达量随着水飞蓟宾剂量的增加而逐渐降低,差异均有统计学意义(P<0.05)。

图5水飞蓟宾可通过浓度依赖的方式抑制肾癌Wnt/β-catenin通路
不同浓度水飞蓟宾(silibinin)处理24 h后,使用Western blot检测786-O细胞(A)及ACHN细胞(C)中GSK3β/p-GSK3β和β-catenin蛋白水平变化;通过Image J软件分析量化786-O细胞(B)及ACHN细胞(D)中p-GSK3β和β-catenin蛋白灰度值相对内参比值变化。与对照组相比,*P<0.05,**P<0.01。
3 讨 论
肿瘤干细胞具有自我更新、无限增殖和多向分化的潜能,虽然数量少,但却在肿瘤的生长、复发、转移和多药耐药中起重要作用。泌尿系肿瘤干细胞的研究起步稍晚,但也取得了很显著的进展,前列腺癌和膀胱癌目前均已经有了国际公认的干细胞表面分子标记物。而肾癌肿瘤干细胞的研究也尚处于起步阶段。
FLOREK等利用体外球体形成实验从肾癌细胞中首次发现肾癌干细胞,证实了肾癌干细胞的存在。BUSSOLATI等[8]在肾癌中分选得到CD133+细胞,通过克隆形成体外实验及小鼠体内成瘤实验等干细胞生物学特性鉴定,证明了CD133是肾癌干细胞的待选表面标记分子,为肾癌干细胞筛选带来一定启发。此后陆续又发现了一系列与肾癌干细胞密切相关的表明标记物及分子。但遗憾的是目前尚无公认的肾癌肿瘤干细胞表面标志。CD133、CD24、CD44、CD105、CTR2、Rh123、P63和Oct4都曾作为干细胞表面标记物用于肾癌肿瘤干细胞的分选研究。肾癌干细胞表明标记物的发现及应用也为更深刻的理解肾癌发生发展的分子机制以及开发新型高效的靶向特异性药物奠定了基础。
传染保肝药水飞蓟宾今年来因其抗广谱抗肿瘤作用已经受到了广泛的关注。既往文献报道,水飞蓟宾可抑制乳腺癌、胶质瘤[9]以及肺癌[10]干细胞特性,进而发挥其抗肿瘤效果。我们研究团队围绕水飞蓟宾在包括前列腺癌、膀胱癌以及肾癌在内的多种泌尿系肿瘤中的作用也开展了一系列研究。我们前期研究成果发现,水飞蓟宾可显著抑制膀胱癌的干细胞特性,进而抑制膀胱癌的侵袭及转移能力[4]。而水飞蓟宾在肾癌中对干细胞特性是否影响目前尚不清楚。Western blot法检测水飞蓟宾对肾癌细胞系786-O和ACHN干细胞标志物影响,发现水飞蓟宾下调干细胞标志物CD44、P63表达,并且呈现浓度依赖性和时间依赖性。同时,通过平板克隆实验和肿瘤干细胞克隆球实验发现,水飞蓟宾处理后平板克隆及克隆球体积明显减小、数量明显减少,有力的证实了水飞蓟宾抑制肾癌细胞干细胞特性的作用。
Wnt/β-连环蛋白(β-catenin)信号途径参与调控细胞形态与功能分化、细胞癌变、凋亡、免疫与应激等,在胚胎发育、肿瘤发生和器官纤维化等病理生理过程中发挥重要作用[11]。在稳定状态下,Wnt信号缺失导致胞质内的β-catenin被糖原合成酶激酶(glycogen synthase kinase 3β,GSK3β)磷酸化而降解;Wnt信号通路激活时GSK3β磷酸化作用被抑制,引起胞内β-catenin降解减少,β-catenin积聚增多向核内转运,β-catenin与核内的转录因子TCF/LEF相互作用调控下游靶基因表达[12]。研究发现Wnt/β-catenin信号途径与肿瘤干细胞特性有密切关系[13],过表达β-catenin引起头颈部鳞状细胞癌干细胞Oct4表达升高,自我更新能力和成瘤性增强[14]。在膀胱肿瘤中,我们前期研究也发现水飞蓟宾可通过Wnt/GSK3β/β-catenin信号通路抑制膀胱肿瘤的干性,进而抑制膀胱肿瘤的侵袭潜能。在本研究中,我们通过Western-blot检测p-GSK3β及β-catenin蛋白表达,发现水飞蓟宾能够明显下调p-GSK3β及β-catenin表达,显示水飞蓟宾可能通过抑制Wnt/β-catenin信号通路发挥抗肾癌干细胞特性的作用;但仍需要后续进一步的干预或者回复实验来验证Wnt/β-catenin信号通路在该过程中发挥的确切作用。
综上所述,水飞蓟宾能够明显抑制肾癌细胞干细胞特性,抑制Wnt/β-catenin信号通路是其可能的分子机制。进一步深入探讨水飞蓟宾抑制肾癌细胞干性的分子机制,将有可能为晚期肾癌的综合治疗带来新的选择。
参考文献:
[1] HAAKE SM,RATHMELL WK.Renal cancer subtypes:Should we be lumping or splitting for therapeutic decision making?[J].Cancer,2017,123(2):200-209.
[2] LI WG,WANG HQ.Inhibitory effects of Silibinin combined with doxorubicin in hepatocellular carcinoma; an in vivo study[J].J BUON,2016,21(4):917-924.
[3] BAYRAM D,CETIN ES,KARA M,et al.The apoptotic effects of silibinin on MDA-MB-231 and MCF-7 human breast carcinoma cells[J].Hum Exp Toxicol,2017,36(6):573-586.
[4] WU K,NING Z,ZENG J,et al.Silibinin inhibits beta-catenin/ZEB1 signaling and suppresses bladder cancer metastasis via dual-blocking epithelial-mesenchymal transition and stemness[J].Cell Signal,2013,25(12):2625-2633.
[5] DEEP G,KUMAR R,NAMBIAR DK,et al.Silibinin inhibits hypoxia-induced HIF-1alpha-mediated signaling,angiogenesis and lipogenesis in prostate cancer cells:In vitro evidence and in vivo functional imaging and metabolomics[J].Mol Carcinog,2017,56(3):833-848.
[6] MA Z,LIU W,ZENG J,et al.Silibinin induces apoptosis through inhibition of the mTOR-GLI1-BCL2 pathway in renal cell carcinoma[J].Oncol Rep,2015,34(5):2461-2468.
[7] LI F,MA Z,GUAN Z,et al.Autophagy induction by silibinin positively contributes to its anti-metastatic capacity via AMPK/mTOR pathway in renal cell carcinoma[J].Int J Mol Sci,2015,16(4):8415-8429.
[8] BUSSOLATI B,BRUNO S,GRANGE C,et al.Isolation of renal progenitor cells from adult human kidney[J].Am J Pathol,2005,166(2):545-555.
[9] CHAKRABARTI M,RAY SK.Synergistic anti-tumor actions of luteolin and silibinin prevented cell migration and invasion and induced apoptosis in glioblastoma SNB19 cells and glioblastoma stem cells[J].Brain Res,2015,1629:85-93.
[10] COROMINAS-FAJA B,OLIVERAS-FERRAROS C,CUYAS E,et al.Stem cell-like ALDH(bright) cellular states in EGFR-mutant non-small cell lung cancer:a novel mechanism of acquired resistance to erlotinib targetable with the natural polyphenol silibinin[J].Cell Cycle,2013,12(21):3390-3404.
[11] ASHIHARA E,TAKADA T,MAEKAWA T.Targeting the canonical Wnt/beta-catenin pathway in hematological malignancies[J].Cancer Sci,2015,106(6):665-671.
[12] PAI SG,CARNEIRO BA,MOTA JM,et al.Wnt/beta-catenin pathway:modulating anticancer immune response[J].J Hematol Oncol,2017,10(1):101.
[13] LIEN WH,FUCHS E.Wnt some lose some:transcriptional governance of stem cells by Wnt/beta-catenin signaling[J].Genes Dev,2014,28(14):1517-1532.
[14] LEE SH,KOO BS,KIM JM,et al.Wnt/beta-catenin signalling maintains self-renewal and tumourigenicity of head and neck squamous cell carcinoma stem-like cells by activating Oct4[J].J Pathol,2014,234(1):99-107.

