甘薯淀粉高吸水树脂促进干旱条件下小麦种子萌发和幼苗生长的研究
董宝
(安徽省化工研究院,安徽 合肥230041)
干旱胁迫是农业作物在发芽和生长发育过程中的常见问题,对农业生产有很大危害,农作物常因根系土壤养分的吸收受阻,而导致植物的发芽率降低[1-3],同时由于体内的清除自由基相关酶活性和自由基清除剂含量明显下降,导致膜脂过氧化程度和自由基水平上升[4-6],叶绿素含量减少[7-8]。此外,由于蛋白质的分解加强,其合成却受到抑制,从而蛋白质含量减少,可溶性糖含量显著增加[9-10],进而导致农作物生长发育缓慢、停滞甚至死亡。
抗旱性包衣剂又称保水剂,是解决干旱胁迫的有效方法。其作用机理是在种子周围形成“蓄水球囊”[11-15],为种子的萌发和生长发育提供水源。因此,保水剂的制备方法和其保水能力等物理化学性质一直是研究的热点[14-16],但是其对农作物生长发育的作用机理仍需进一步研究[16]。考虑到合肥工业大学食品科学与工程学院的甘薯淀粉高吸水树脂(淀粉接枝共聚树脂)是一种保水性能优良的保水剂[17],本文采用该单位制备的甘薯淀粉高吸水树脂作为种子包衣剂,在干旱胁迫下研究其对小麦种子萌发及幼苗生长的影响规律,为甘薯淀粉高吸水树脂在农业生产中的应用提供数据支撑和理论依据。
1 材料与方法
1.1 实验材料
小麦种子:淮麦20(Triticum aestivum L,huaimai 20),采购于安徽农业科学院(纯度≥99.0%,发芽率≥85%)。甘薯淀粉高吸水树脂(包衣剂):合肥工业大学食品科学与工程学院制备[17],吸水率约为1∶900(w:v)。
1.2 种子的包衣制备
本文选择了包衣剂与种子的质量比分别为1∶30,1∶40,1∶50,1∶60,1∶70 五个不同的包衣比。包衣步骤:首先每种包衣比取约5g种子加适量水湿润,按比例称量甘薯淀粉高吸水树脂粉末,加适量水分后充分搅拌使其吸水膨胀。最后将预先湿润的种子加入,充分混合均匀后,将种子平摊在搪瓷盘中风干。
1.3 干旱胁迫和种子萌发生长管理
干旱胁迫和种子萌发生长管理参照已报道的文献[5,8,18]。土壤采用肥沃大田表土,干旱胁迫条件为土重的9%(质量百分比)。初期保持土壤30%的持水量(质量百分比)5h左右,以促使种子萌发与包衣剂的吸水,之后将土壤持水量降为9%,维持生长温度25℃±1℃和10h光照时间。每个包衣比和对照组下有5个重复。
1.4 生理生化指标测试
光照培养7天后,进行生理生化指标测试:H2O2含量测定参照文献[19];丙二醛(MDA)含量参照文献[20];采用NBT光化还原法测试超氧化物歧化酶(SOD)活性,愈创木酚法测试过氧化物酶(POD)活性,过氧化氢酶(CAT)活性测定参照文献 [21];抗坏血酸过氧化物酶(APX)活性测定参照文献 [22];谷胱甘肽过氧化物酶(GPX)测定参照试剂盒(南京建成生物技术公司);叶绿素、谷胱甘肽(GSH)和抗坏血酸(ASA)测定参照文献[23]。
2 结果与讨论
2.1 甘薯淀粉高吸水树脂对小麦种子萌发和幼苗生长的影响
如图1所示,甘薯淀粉高吸水树脂作为包衣剂能有效提高干旱胁迫下小麦种子的萌发率,且促进其幼苗生长。此外,不同包衣比的小麦种子萌发和生长差异也较大,其中1∶50和1∶60包衣质量比时,种子萌发率和苗高最高(图1)。结果表明,甘薯淀粉高吸水树脂作为包衣剂对干旱下萌发的小麦种子萌发和幼苗生长的促进作用是显著的。
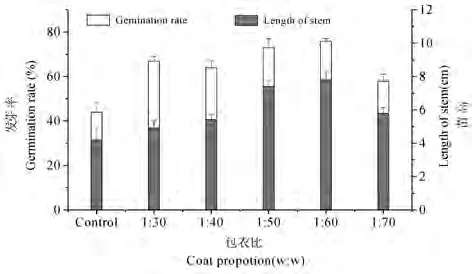
图1 不同包衣比对小麦种子发芽率和苗高的影响Fig.1 Influence of different coat proportion on germination rate and length of stem in wheat
2.2 甘薯淀粉高吸水树脂对小麦幼苗膜脂过氧化的影响
本文检测了不同包衣质量比的小麦幼苗H2O2、MDA和叶绿素的含量,结果如表1所示,对照组的H2O2、MDA含量均高于包衣组,而叶绿素的含量却低于包衣组,说明甘薯淀粉高吸水树脂作为包衣剂能够降低干旱胁迫下小麦幼苗的膜脂过氧化程度。此外,和种子萌发率的结果一致,不同包衣质量比对幼苗膜脂过氧化减轻的程度也不尽相同。其中1∶50和1∶60包衣质量比的叶绿素的含量高于其他包衣比,同时MDA和H2O2含量则显著低于其他包衣比。1∶50包衣质量比下的叶绿素的含量最高,且MDA和H2O2含量最低。结果表明,1∶50包衣比时小麦幼苗的抗膜脂过氧化的效果最好。

表1 不同包衣质量比对小麦幼苗H2O2、MDA和叶绿素含量的影响Tab.1 Influence of different coat proportion on H2O2,MDA and chlorophyl in wheat seedlings
2.3 甘薯淀粉高吸水树脂对小麦幼苗自由基清除相关酶活的影响
干旱胁迫下,农作物体内的自由基清除相关酶活性与其抗旱能力相关。因此,为了深入了解甘薯淀粉高吸水树脂处理下小麦幼苗的抗旱机理,本文重点考查了小麦幼苗的酶促活性氧清除系统的变化,自由基清除相关酶SOD、CAT、POD、GPX和APX的活性如表2所示。研究结果表明:1∶50和1∶60包衣比条件下SOD的活性最高,比对照组高了2.4倍;除1∶50包衣比外,其他衣比对幼苗POD活性影响不大,均与对照相当;同时在1∶50包衣比时,其CAT、APX及GPX活性分别是对照组的2.0倍、3.3倍及4.9倍,且明显高于其他包衣比。因此,对于提高自由基清除水平,1∶50包衣比无疑是最佳的比例。
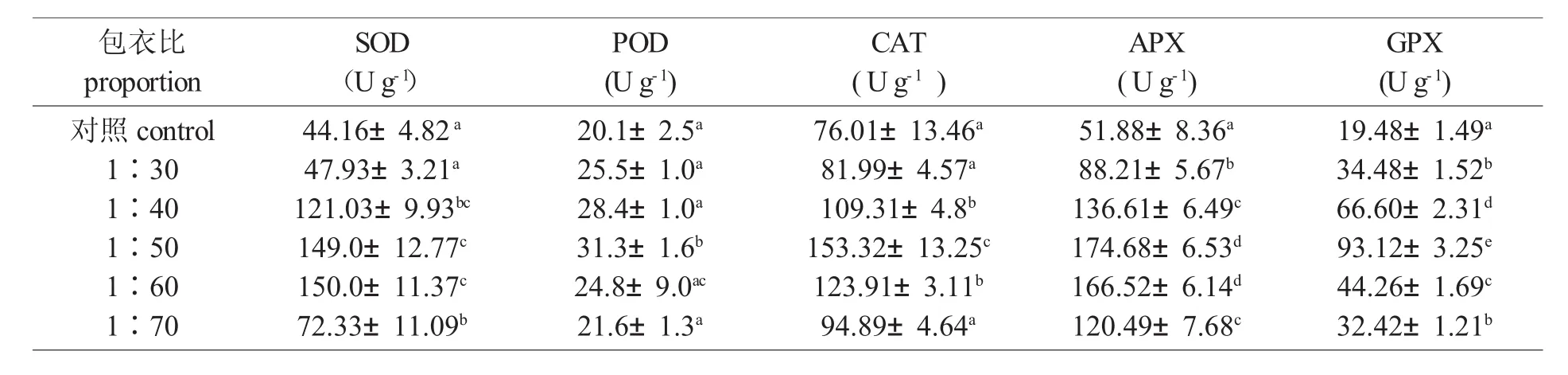
表2 不同包衣比对小麦幼苗自由基清除相关酶活性的影响Tab.2 Influence of different coat proportion on enzymes related to cleaningup free radicals in wheat seedlings
2.4 甘薯淀粉高吸水树脂对小麦幼苗GSH和ASA含量的影响
作为Halliwell-Asa-da循环的底物和活性氧的清除剂,ASA和GSH是植物体内两种主要且重要的非酶促抗氧化物质,并在植物体内和酶促系统一起维持自由基平衡[6]。如图2所示,包衣剂明显提高小麦幼苗中ASA和GSH的含量,且1∶50包衣质量比是最佳比例。
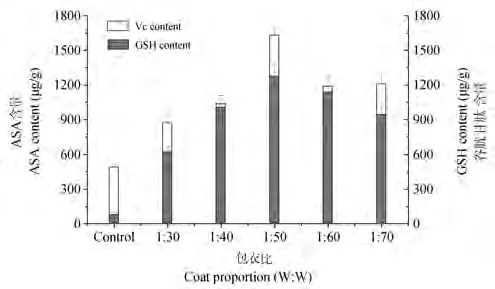
图2 不同包衣质量比对小麦幼苗ASA和GSH含量的影响Fig.2 Influence of different coat proportion on ASA and GSH content in wheat seedlings
3 讨论
种子萌发和幼苗生长必须有充分的水分供应,否则萌发率低下,且幼苗生长缓慢。干旱胁迫下,抗旱包衣剂通过在种子周围形成“蓄水球囊”,使得土壤中的水分缓慢释放,保障种子萌发的水源供应[13,24,25]。但是包衣层过厚则往往使种子吸水和气体交换受阻,而包衣层过薄则不能形成有效“蓄水球囊”,且一定程度上阻碍了种子对水和氧气等物质的吸收,从而引起发芽率低和幼苗弱势生长[25-26]。本文以甘薯淀粉高吸水树脂作为包衣剂,与对照组相比,在干旱胁迫下显著提高了小麦种子的发芽率和幼苗生长,其中1∶50和1∶60包衣质量比的发芽率高于70%。
干旱条件下植物细胞内的活性氧自由基的平衡受到破坏,严重影响植物生长。H2O2和MDA是过氧化物的主要产物,因此是反映过氧化程度的重要指标[6,27]。本文研究结果表明,甘薯淀粉高吸水树脂作为包衣剂,显著降低了小麦体内H2O2和MDA含量,且提高了叶绿素的水平,有效降低干旱条件下小麦幼苗的膜脂过氧化程度。
干旱胁迫往往导致植物体内活性氧自由基含量增加,膜脂过氧化,细胞膜受损破坏。SOD、CAT、POD、APX、GPX等是植物体内清除活性氧自由基的主要酶促系统,而非酶促主要包含ASA与GSH。为更好地理解甘薯淀粉高吸水树脂作为包衣剂对小麦种子萌发的作用机理,本文重点研究了小麦幼苗酶促系统的酶活性和非酶促物质ASA、GSH的含量变化,结果表明,甘薯淀粉高吸水树脂作为包衣剂同时提高了清除活性氧自由基的酶促系统和非酶促系统的水平,从而保障了小麦种子的萌发和幼苗生长。
4 结论
研究发现,甘薯淀粉高吸水树脂作为包衣剂可有效缓解小麦的干旱胁迫作用,且其最佳包衣质量比为1∶50。此外,本文深入研究了小麦种子的萌发和幼苗生长过程中,甘薯淀粉高吸水树脂作为包衣剂对膜脂过氧化水平和活性氧自由基清除能力的影响,为包衣剂的抗旱机理研究提供了数据支撑和理论依据。
[1]徐拾佳,郭玉洁,吴桐,等.干旱胁迫下钙离子对矮牵牛种子萌发及幼苗生长的影响[J].河北林果研究,2017,32:284-288.
[2]De Villalobos A E.,PelaH D V.Influences of Temperature and Water Stress on Germination and Establishment of Prosopis CaldeniaBurk [J].Journal of Arid Environments,.2001,49:321-328.
[3]Vijaya Singh,Charles K,Pallaghy,Dhananjay Singh.Phosphorus Nutrition and Tolerance of Cotton to Water Stress II.Water Relations,Free and Bound Water and Leaf Expansion Rate[J].Field Crops Research,2006,96:199-206.
[4]Fridovich I.Superoxidedismutase[J].Ann.Rev.Biochem.,1975,44:147-159.
[5]章崇玲,曾国平,陈建勋.干旱胁迫对菜苔叶片保护酶活性和膜脂过氧化的影响[J].植物资源与环境学报,2000(9):23-26.
[6]李明,王根轩.干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响[J].生态学报,2002,22:503-507.
[7]阮凌暄,马骁勇,林秀莲,等.干旱胁迫对铁皮石斛叶片活性氧清除系统与叶绿素荧光特性的影响 [J].西部林业科学,2017,46:103-107.
[8]Flenet F,Bouniols A,Saraiva C.Sunflower Response to A Range of Soil Water Contents[J].European Journal of Agronomy,1996(5):161-167.
[9]Munns R C J,Bracely E W.Solute Accumulation in the Apex and Leaves ofWheat DuringWater Stress[J].J plant physiol,1979(6):379-389.
[10]Fulai Liu,Christian R,Jensen,et al.Drought Stress Effect on Carbohydrate Concentration in Soybean Leaves and Pods During Early Reproductive Development:Its Implication in Altering Pod Set[J].Field Crops Research,2004,86:1-13.
[11]穆俊祥,刘拴成,曹兴明.马铃薯生产中保水剂不同用法的效果比较[J].江苏农业科学,2016,44:130-132.
[12]李蔓,陶格斯.浅谈保水剂在造林绿化中的有效应用[J].农技服务,2015,32:167.
[13]山仑.旱地农业技术发展趋向 [J].中国农业科学,2002,35:848-855.
[14]王志玉,刘作新.高吸水树脂的性能及其在农业上的应用[J].土壤通报,2004,35:352-356.
[15]王小彬,蔡典雄,张锐.几种高分子材料固土性能比较与评价研究[J].中国农业科学,2005,38:1608-1615.
[16]韩玉国,杨培岭,徐磊,等.高分子吸水树脂对果树增产保墒的影响[J].中国农业科学,2005,38:2486-2491.
[17]姜绍通,周建芹,赵妍嫣,等.甘薯淀粉接枝共聚高吸水树脂的合成及在种子包衣上的应用研究 [J].农业工程学报,2004,20:207-210.
[18]阎成仕,李德全,张建华.冬小麦旗叶旱促衰老过程中氧化伤害与抗氧化系统的响应[J].西北植物学报,2000,20:568-576.
[19]林植芳,李双顺,林桂珠,等.衰老叶片和叶绿体中H2O2的累积与膜脂过氧化的关系[J].植物生理学报,1988,14:16-22.
[20]赵世杰,许长成.植物组织中丙二醛测定方法的改进[J].植物生理通讯,1994,30:207-210.
[21]Van Rensburg L.Evaluation of Components of Oxidative Stress Metabolism for Use in Selection of Drought Tolerant Cultivars of Nicotiana TabacumL[J].J Plant Physiol,1994,143:730-737.
[22]Arrigoni O,De Gara L,Tommasi F,et al.Change in the Ascorbate System During Seed Development ofVicia faba L[J].Plant physiol,1992,99:235-239,8.
[23]张志良.植物生理学实验指导 [M].北京:高等教育出版社,1990.
[24]李景生,黄韵珠.土壤保水剂的吸水保水性能研究动态[J].中国沙漠,1996,16:86-91.
[25]李青丰,徐军,董天明.对吸水剂抗旱作用机理一些问题的探讨[J].干旱区资源与环境,2001,15:85-88.
[26]Parichehrhemyari,Nofiiger D L,Sape Siurper.Effects on Crast Strenth Water Retention,and Water Infiltration of Soils[J].SOILSCI SOC.AM.,1981,45:799-801.
[27]Bowler C,Van Montagu M.Superoxide Dismutase and Stress Tolerance[J].Annu Rev Plant Physiol Plant Mol Biol,1992,43:83-116.

