他克莫司和伊曲康唑联合使用体外抗克柔念珠菌作用的研究
宫婷婷,刘赟蕾,王中新
多年来,实体器官移植已经成为肾脏、肝脏、心脏和肺部等终末期疾病的公认治疗[1]。随着免疫抑制剂和移植物的广泛应用,如真菌病、病毒感染[2]和恶性肿瘤已成为主要的实体器官移植的并发症。尽管诊断、预防和治疗方面最近取得进展,但侵袭性真菌感染仍然是免疫功能低下或危重病患者发病和死亡的主要原因[3-4]。目前非白色念珠菌如光滑念珠菌、克柔念珠菌等菌株的感染已超过白色念珠菌,所致的侵袭性真菌的发病率和死亡率呈现上升的趋势[4], 这些难以治疗的侵袭性真菌感染的发病率增加,加上目前有限的抗真菌药物使得仍然未完全探索的钙调磷酸酶途径成为抗真菌靶向的有吸引力的新型替代物。其中环孢菌素A和他克莫司就是钙调磷酸酶抑制剂。而抗真菌药如氟康唑、伊曲康唑、伏立康唑、卡泊芬净等的使用,使得难治性的侵袭性真菌的耐药也不断的在升高[5-6],并且上述两类药物已广泛用于器官移植和真菌感染的治疗。该实验通过体外的微量稀释法,测定12株克柔念珠菌在各种药物下的耐药情况,以及分析单独应用伊曲康唑和他克莫司,与联合使用伊曲康唑和他克莫司对于克柔念珠菌的生长情况的比较。
1 材料与方法
1.1实验菌株收集2014年1月~2016年12月安徽医科大学第一附属医院检验科分离的克柔念珠菌共12株,菌株来源于痰、尿、粪便等,菌株编号依次为CK1~12。选取光滑念珠菌ATCC MYA-2950和白色念珠菌ATCC 10231作为质控菌株,使用大肠杆菌ATCC 8739作为仪器的校准菌株。
1.2试剂和仪器伊曲康唑、他克莫司、二甲亚砜AR(大连美仑生物技术有限公司);RPMI 1640粉末(美国GIBCO公司);MOPS(北京索莱宝技术有限公司);0.22 μm纤维过滤膜(上海生工生物公司)。VITEK MS-FA、VITEK MS-CHCA基质、靶板和VITEK MS IVD (V2.0) 质谱仪 (法国Biomérieux公司);酶标仪MK-3(美国ThermoFisher公司)。
1.3方法
1.3.1菌株处理和试剂配制 将菌株从-80 ℃冰箱中取出解冻,至少在沙保弱固体培养基上传代2次以上进行复苏,每次在35 ℃恒温培养箱中培养48 h后再次接种,然后用接种环将沙保弱固体培养基生长至对数生长的单个大菌落,在3 ml的PBS缓冲液中研磨混匀,接着用中国标准比浊管比浊,调整菌液浓度大约在5×106cfu/ml,用血球计数板验证菌液浓度。将伊曲康唑和他克莫司原料粉末溶于二甲亚砜分别配置为6 400 μg/ml和5 120 μg/ml。
1.3.2药物单用时最低抑菌浓度测定 采用棋盘微量稀释法分别测定伊曲康唑和他克莫司的最低抑菌浓度。使用RPMI 1640液体培养基将上述配置的菌体稀释,使得96孔板上的菌液浓度大约为2.5×103cfu/ml,然后将他克莫司和伊曲康唑的母液用RPMI 1640液体培养基对倍稀释,使得96孔板上伊曲康唑的浓度为0.125~64 μg/ml、他克莫司的浓度为1~512 μg/ml。参考Sanguinetti et al[7]将克柔念珠菌分离株在伊曲康唑的敏感性分布:最低抑菌浓度≤0.125 μg/ml为敏感,最低抑菌浓度=0.25~0.5 μg/ml为浓度信赖株,最低抑菌浓度≥1.0 μg/ml为耐药株。
1.3.3药物联用时最低抑菌浓度测定 根据CLSI方案M27-A3微量稀释法测定伊曲康唑和他克莫司联用后对所有克柔念珠菌的最低抑菌浓度。对于他克莫司使用最高浓度为64 μg/ml,伊曲康唑最高为16 μg/ml。生长对照孔为100 μl RPMI 1640培养液和100 μl菌液,空白对照组为200 μl RPMI 1640培养液,其他每孔100 μl菌液、50 μl伊曲康唑药液50 μl他克莫司药液。96孔板在35 ℃恒温培养箱培养24 h后,用酶标仪在492 nm处测光密度(OD)值。最后根据公式计算各组分级抑菌浓度指数(FICI):FICI=FICA+FICB=CA/MICA+CB/MICB,FICA、FICB分别表示药物A和药物B的分级抑菌浓度;MICA、MICB分别表示药物A和药物B单独应用时的最低抑菌浓度;CA、CB为药物A和药物B联用时达到相同药效时各自的浓度。联用作用效果评价根据Odds的建议:分级抑菌浓度指数≤0.5协同,分级抑菌浓度指数>4为拮抗,在其之间为相加或者无关。
1.4统计学处理应用SPSS 16.0软件进行分析。计数资料采用中位数表示。
2 结果
2.1ATBFUNGUS3参考抗真菌药敏实验研究克柔念珠菌分离株由ATB FUNGUS 3根据制造商的说明书进行,目视读取最小抑制浓度。有5种不同浓度的抗真菌药物:5-氟胞嘧啶(4~16 μg/ ml),两性霉素B(0.5~16 μg/ ml),氟康唑(1~128 μg/ ml),伊曲康唑(0.125~4 μg/ ml)和伏立康唑(0.06~8 μg/ ml)。使用CLSI BMD方法同时进行ATB FUNGUS 3的测试,24 h后进行视觉读数。通过测试CLSI推荐的菌株选取光滑念珠菌ATCC MYA-2950 和白色念珠菌ATCC 10231作为质控菌株来确保质量控制。12株克柔念珠菌的抗真菌药敏实验见表1。
2.2伊曲康唑和他克莫司联合使用抗克柔念珠菌的结果根据CLSI方案M27-A3微量稀释法进行他克莫司与伊曲康唑联合应用对抗克柔念珠菌的生长情况,最后根据公式计算各组分级抑菌浓度指数。他克莫司与伊曲康唑联用时12株克柔念珠菌的结果见表2。与单独使用伊曲康唑的克柔念珠菌相比,联合用药作用下伊曲康唑最低抑菌浓度远小于单独使用伊曲康唑的克柔念珠菌,其最高倍数达32倍,最小倍数达4倍;同样,他克莫司单独使用较联合伊曲康唑使用,最高倍数达32倍,最低倍数达2倍。
3 讨论
近年来,念珠菌属、隐球菌和曲霉属物种的耐药分离株种群数量不断增加,以及最近新出现的接合线虫种,木霉菌和米根霉的出现[8],这些都是免疫功能低下患者死亡率高的原因[9]。临床侵袭性操作如气管插管、导尿以及介入等使用造成了克柔念珠菌的感染呈现逐年上升的趋势。对于常见的三唑类真菌药-伊曲康唑,其耐药的情况也在逐年的升高。He et al[10]认为ERG11和ABC2基因的上调与克柔念珠菌的耐药机制相关,但却不能排除ERG11基因在此过程中突变引起的耐药。而随着器官移植的增多,免疫抑制剂(他克莫司和环孢素A)已被广泛的使用,他克莫司是钙调神经磷酸酶抑制剂,钙调神经磷酸酶是由Ca2+和钙调蛋白调节的真菌中唯一认识的磷酸酶。它是一种多功能调节剂,具有调节真菌应激反应、生理和细胞周期进程、生物膜的形成和抗真菌抗性、毒力以及发病机制的功能。
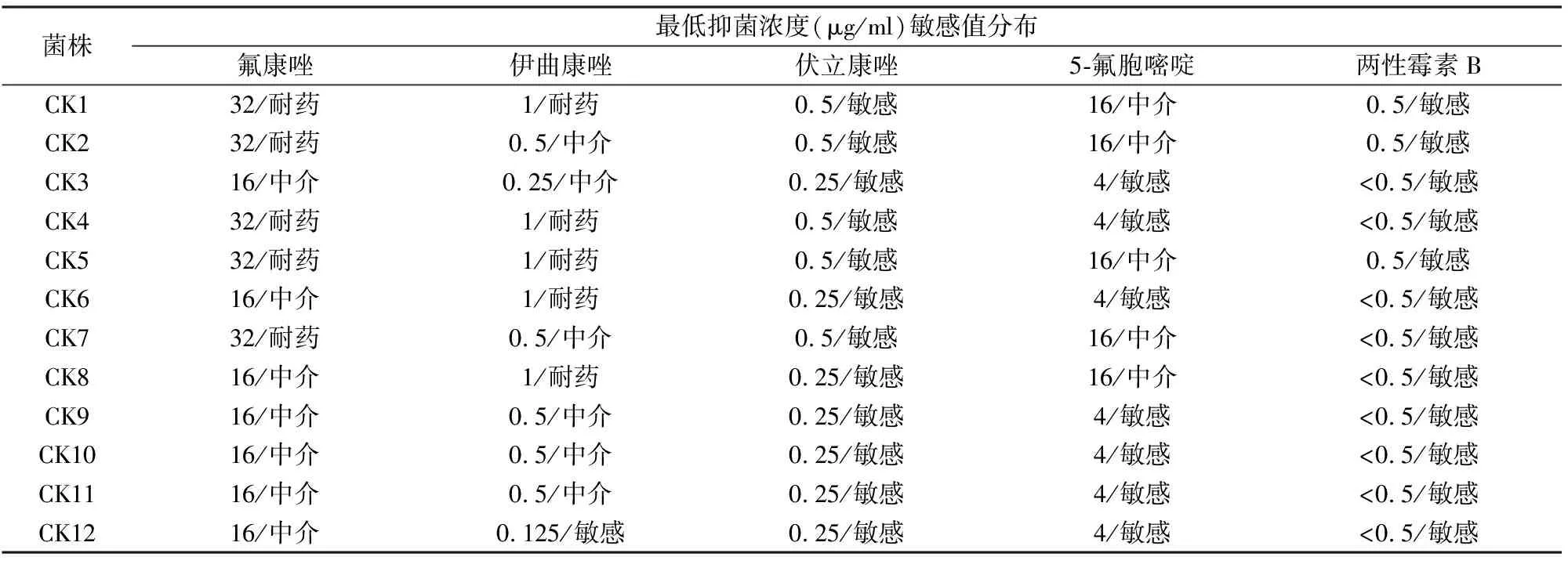
表1 12株克柔念珠菌在下列各药物中的浓度
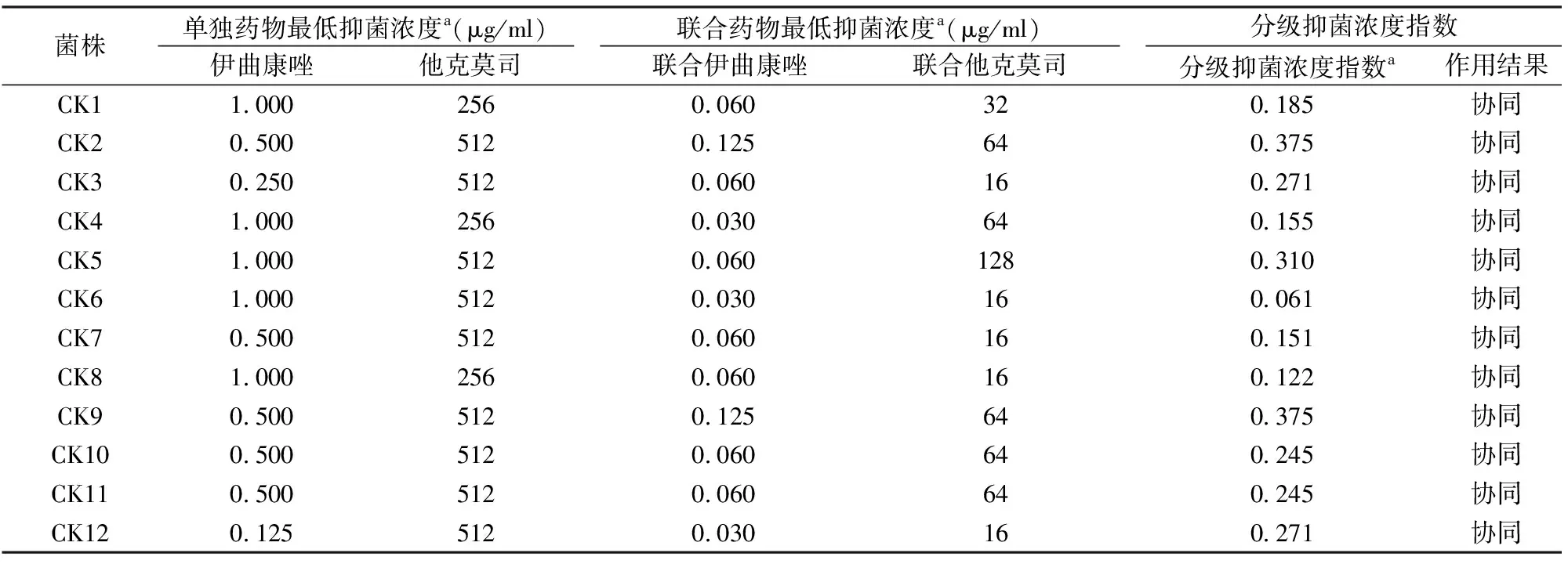
表2 12株克柔念珠菌联合使用伊曲康唑和他克莫司的结果
注:a代表3次实验的中位数
在基于上述情况下,研究新的抗真菌药一直在进行,如嗜铬粒蛋白A-N46对克柔念珠菌表现出最大的敏感性,嗜铬粒蛋白A-N46可以被认为是用于治疗克柔念珠菌感染的抗真菌化合物[11]。银纳米颗粒、羧甲基壳聚糖等都能够抑制念珠菌细胞的代谢活性。但上述药物都未进行临床人体试验。Lamoth et al[12]证实了各种唑类和钙调磷酸酶抑制剂抗真菌活性,如耐棘白菌素类的烟曲霉临床分离株。最近一项研究[13]显示他克莫司或环孢素A和氟康唑的组合靶向钙调磷酸酶信号传导可能是用于白色念珠菌感染后产生生物膜预防和治疗抗真菌的有效策略。钙调神经磷酸酶抑制剂增强白色念珠菌对最常见的抗真菌剂敏感性的基础机制。在此之前Li et al[14]研究发现他克莫司和氟康唑联合抗光滑念珠菌和克柔念珠菌具有协调作用。
基于上述研究和氟康唑对克柔念珠菌是天然耐药以及他克莫司作为临床上常用的器官移植后的免疫抑制药,笔者选用了较为廉价的伊曲康唑联合他克莫司抗克柔念珠菌。通过本研究发现体外单独使用抗真菌剂(伊曲康唑)或钙调神经磷酸酶抑制剂(他克莫司)对克柔念珠菌的作用与伊曲康唑和他克莫司相结合的抗克柔念珠菌的活性相比较,后者在抗克柔念珠菌时,无论是敏感的还是耐药的伊曲康唑,都明显降低了克柔念珠菌的生长情况。因此,在治疗器官移植后克柔念珠菌的感染时,应用他克莫司和伊曲康唑联合治疗,在临床上是有一定的应用前景。
[1] Green M.Introduction: infections in solid organ transplantation[J].Am J Transplant,2013,13 Suppl 4:3-8.
[2] Umeshita K,Inomata Y,Furukawa H,et al.Liver transplantation in Japan: registry by the Japanese liver transplantation society[J].Hepatol Res,2016,46(12):1171-86.
[3] Corzo-León D E,Satlin M J,Soave R,et al.Epidemiology and outcomes of invasive fungal infections in allogeneic haematopoietic stem cell transplant recipients in the era of antifungal prophylaxis: a single-centre study with focus on emerging pathogens[J].Mycoses,2015,58(6):325-36.
[4] Silva S,Negri M,Henriques M,et al.Candida glabrata, Candida parapsilosis and Candida tropicalis: biology, epidemiology, pathogenicity and antifungal resistance[J].FEMS Microbiol Rev,2012,36(2):288-305.
[5] Vallabhaneni S,Cleveland A A,Farley M M,et al.Epidemiology and risk factors for Echinocandin Nonsusceptible Candida glabrata bloodstream infections: data from a large multisite population-based Candidemia surveillance program, 2008-2014[J].Open Forum Infect Dis,2015,2(4):ofv163.
[6] Zhou Z L,Lin C C,Chu W L,et al.The distribution and drug susceptibilities of clinical Candida species in TSARY 2014[J].Diagn Microbiol Infect Dis,2016,86(4):399-404.
[7] Shirazi F,Kontoyiannis D P.The calcineurin pathway inhibitor tacrolimus enhances the in vitro activity of azoles against Mucorales via apoptosis[J].Eukaryot Cell,2013,12(9):1225-34.
[8] Sanguinetti M,Posteraro B,Fiori B,et al.Mechanisms of azole resistance in clinical isolates of Candida glabrata collected during a hospital survey of antifungal resistance[J].Antimicrob Agents Chemother,2005,49(2):668-79.
[9] Juvvadi P R,Lamoth F,Steinbach W J. Calcineurin as a multifunctional regulator: unraveling novel functions in fungal stress responses, hyphal growth, drug resistance, and pathogenesis[J]. Fungal Biol Rev,2014,28(2-3):56-69.
[10] He X,Zhao M,Chen J,et al.Overexpression of both ERG11 and ABC2 genes might be responsible for itraconazole resistance in clinical isolates of Candida krusei[J].PLoS One,2015,10(8):e0136185.
[11] Li R F,Yan X H,Lu Y B,et al.Anti-candidal activity of a novel peptide derived from human chromogranin A and its mechanism of action against Candida krusei[J].Exp Ther Med,2015,10(5):1768-76.
[12] Lamoth F,Juvvadi P R,Gehrke C.Invitroactivity of calcineurin and heat shock protein 90 inhibitors against Aspergillus fumigatus azole-and echinocandin-resistant strains[J].Antimicrob Agents Chemother,2013,57(2):1035-9.
[13] Jia W,Zhang H,Li C,et al.The calcineruin inhibitor cyclosporine a synergistically enhances the susceptibility of Candida albicans biofilms to fluconazole by multiple mechanisms[J].BMC Microbiol,2016,16(1):113.
[14] Li H,Chen Z,Zhang C,et al.Resistance reversal induced by a combination of fluconazole and tacrolimus(FK506) in Candida glabrata[J].J Med Microbiol,2015,64(Pt 1):44-52.

