氯化胆碱对小麦幼苗耐低温能力的生理调控效应
荆恩恩,高 翔,李宗震,张丽婷,余 幸,任永哲,王志强,辛泽毓,林同保
(河南农业大学农学院/河南粮食作物协同创新中心/省部共建小麦玉米作物学国家重点实验室,河南郑州 450002)
作为影响小麦生长发育的非生物胁迫因素之一,低温往往造成小麦产量和品质下降[1]。低温胁迫下,植株体内活性氧积累,细胞膜膜脂过氧化程度增加,膜磷脂脱脂化作用增强,从而引起膜结构改变。质膜系统的破坏会导致膜上酶活性紊乱,细胞代谢失调,进而致使小麦细胞死亡,影响植株的正常生长发育[2-4]。植物遭受低温胁迫时,体内活性氧大量积累,膜脂过氧化产物丙二醛(MDA)含量上升,同时植物体内清除活性氧的抗氧化酶类,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性增强,有助于提高植物的耐受力[5-7]。此外,脯氨酸(Pro)作为植物体内重要的渗透调节物质,具有很强的亲水性,能够保护植物免受脱水的伤害,提升细胞膜结构的稳定性,从而提高植物抵御低温胁迫的能力[8]。
植物生长调节剂在农业生产上应用广泛,已成为增强植物抗逆性、提高作物产量的有效途径之一[9]。氯化胆碱(CC)是一种季胺碱,进入植物体内后可以转化成磷脂酰胆碱,而磷脂酰胆碱是构成生物膜的重要组成部分,因此在一定条件下施用氯化胆碱有助于减少膜脂损伤的程度,增加膜脂的流动性,从而增强植物的抗逆性[10]。盐胁迫条件下,CC浸种可以降低质膜透性,减少MDA的含量,有效地缓解胁迫对小麦幼苗的损伤[11]。干旱胁迫条件下,CC叶面喷施可以有效地增加小麦叶片蛋白质的含量,降低MDA含量,从而缓解渗透胁迫对生长发育的影响,提高小麦抗旱能力[12];喷施CC可以减少过氧化氢(H2O2)和超氧阴离子(O2-·)的含量,增加Pro的含量,提高地黄的抗干旱能力[13]。叶面喷施CC可以通过缓解膜损伤,增加抗氧化酶活性,提高玉米幼苗的抗寒能力[14];或者通过降低MDA含量和电解质泄漏率,提高水稻的抗低温能力[15]。目前,有关CC对小麦低温适应的调控作用,国内外还鲜有报道。因此,本研究选用低温敏感型品种开麦21和耐低温型小麦品种周麦27为试验材料,在人工气候室内盆栽育苗,并模拟低温条件进行处理,研究外源喷施CC对低温胁迫下小麦幼苗形态指标和相关生理指标的影响,以期探究CC在小麦低温适应过程中的作用机制。
1 材料与方法
1.1 试验材料
经过前期大田盆栽研究,本实验室从河南省主要推广的12个小麦品种中筛选出低温敏感型品种开麦21和抗低温型品种周麦27[16],并且室内盆栽试验的结果也验证了这两个品种的低温响应模式与大田基本一致,因此,本试验选取开麦21和周麦27为材料开展研究。
种子经过1%的次氯酸钠消毒处理20 min,清水冲洗干净,在清水中浸泡16~20 h,挑选饱满度一致的种子,放在15 ×15 cm的玻璃皿中催芽48 h,最后筛选出发芽情况良好、长势一致的种子种植于口径为7.5 ×7.5 cm,高为10 cm的塑料小盆中,每盆种植小麦9株,培养基质为草炭土、蛭石1∶1混合制成。将栽有幼苗的小盆置于光照培养室内培养,培养室内光暗周期为16 h/8 h,温度为23 ℃。在二叶一心期时喷施浓度为500 mg·L-1的CC,每间隔1 d喷施1次,一共喷施3次,以喷施蒸馏水为对照,喷施标准是喷施均匀不下滴。喷施结束后,置于原处继续生长,待幼苗长至三叶一心期时在低温培养箱内进行低温处理,光暗周期为16 h/8 h,昼夜温度为0 ℃/-5 ℃。低温处理的时间共持续72 h,拍照记录形态指标。在低温胁迫0 h、24 h、36 h、48 h、60 h和72 h时取第一片和第二片叶,每个处理收集3次生物学重复,-80 ℃保存待用。
1.2 测定项目和方法
1.2.1 形态观察
低温处理前进行一次拍照记录,处理48 h后进行一次拍照记录。
1.2.2 生理指标的测定
选取各处理小麦叶片,测定生理指标。其中,细胞膜通透性采用电导法测定[17];脯氨酸含量采用酸性茚三酮法[18]测定;丙二醛(MDA)含量采用硫代巴比妥酸法[18]测定;过氧化物酶(POD)活性采用愈创木酚法[17]测定;过氧化氢酶(CAT)活性采用过氧化氢还原法[18]测定;超氧化物歧化酶(SOD)活性采用氮蓝四唑光化还原法[17]测定;超氧阴离子自由基产生速率采用羟胺氧化法[19]测定。
1.3 数据分析
利用Microsoft Excel 2010进行数据计算和作图,利用SPSS 19.0进行方差分析。
2 结果与分析
2.1 低温处理前后外源CC对小麦幼苗生长的影响
在正常条件下,无论喷施CC与否,开麦21和周麦27的幼苗长势及长相变化均较小(图1A和图1C)。经过低温处理48 h后,幼苗下部叶片严重萎蔫,而且周麦27叶片的萎蔫程度比开麦21轻。低温下喷施CC后,开麦21和周麦27的幼苗长势均好于对照(图1B和图1D),说明外源CC有效减轻了低温对小麦幼苗的损伤,提高了小麦的抗低温能力。
2.2 低温胁迫下外源CC对小麦叶片相对电导率的影响
随着低温胁迫时间的延长,开麦21和周麦27叶片的相对电导率均呈现持续上升的趋势。低温下喷施CC后小麦叶片相对电导率与对照相比均有所降低(图2),其中,在低温胁迫24~72 h时,开麦21的喷施CC处理与对照差异极显著或显著,而周麦27只在低温胁迫36 h和48 h时表现出显著差异。这说明周麦27由低温导致的膜损伤程度比开麦21轻,而且喷施CC可有效缓解低温造成的膜损伤。
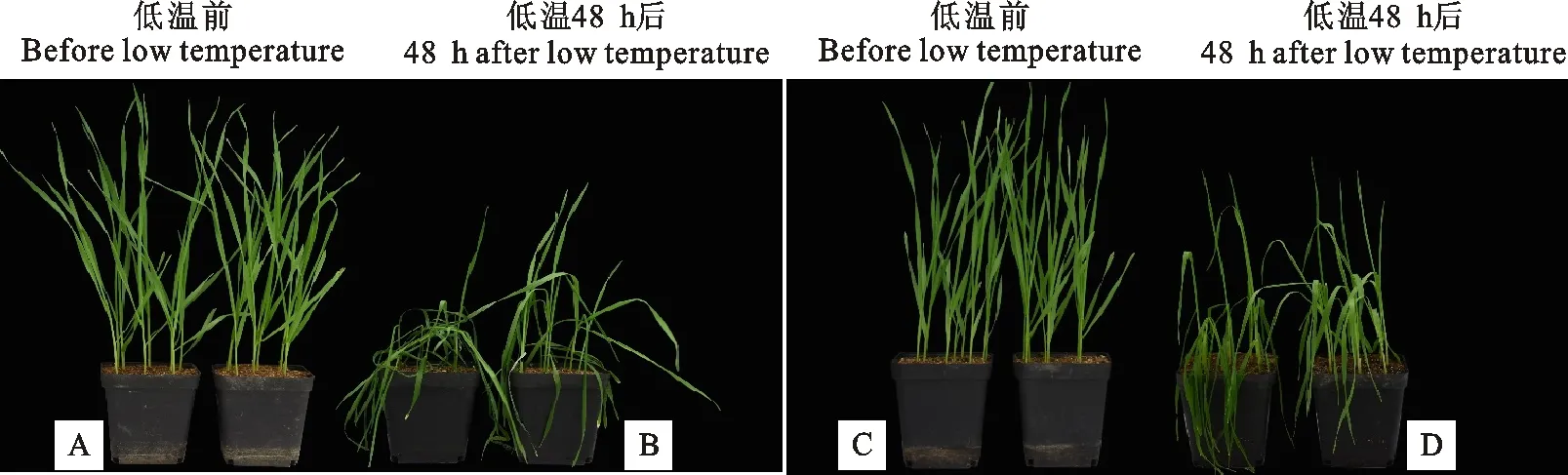
A、B、C、D中左盆为对照,右盆为CC处理。
The left and right pots are control and CC treatments,respectively.
图1低温胁迫下小麦幼苗的形态变化(左图:开麦21;右图:周麦27)
Fig.1Morphologicalchangesofwheatseedlingsundercoldtreatment(Left:Kaimai21;Right:Zhoumai27)

图中*表示处理与对照间差异显著(P<0.05),**表示差异极显著(P<0.01)。下图同。
* and ** indicate significance between the control and choline chloride at 0.05 and 0.01 levels, respectively. The same in the following figures.
图2低温处理下外源CC对小麦叶片相对电导率的影响
Fig.2Effectofcholinechlorideontherelativeconductivityofwheatleavesunderlowtemperature
2.3 低温胁迫下外源CC对小麦叶片超氧阴离子(O2-·)产生速率的影响
低温胁迫造成开麦21叶片O2-·产生速率在48 h内保持在较高的水平,之后下降;与之相比,周麦27叶片O2-·产生速率始终维持在一个相对较低的水平(图3),说明周麦27在低温下,体内不会积累大量的活性氧,抵御低温的能力较强。另外,与对照相比,喷施外源CC均降低了小麦叶片O2-·的产生速率。低温胁迫0~48 h时,喷施CC后开麦21叶片中O2-·产生速率持续下降;而周麦27叶片中O2-·产生速率变化在低温胁迫0~48 h时不明显,只在胁迫60 h时降低了40.48%(P<0.01)(图3)。
2.4 低温胁迫下外源CC对小麦叶片SOD、POD、CAT活性的影响
与对照相比,在低温胁迫开始时喷施CC后小麦叶片SOD活性较高,其中开麦21和周麦27分别增加26.70%和37.60%,均表现出显著变化(P<0.01);随着低温胁迫时间的延长,CC处理的SOD活性普遍高于对照。低温胁迫24 h后,喷施CC后开麦21叶片SOD活性升高28.92%;低温胁迫60和72 h时分别升高了23.23%和34.06%,与对照差异均显著。周麦27的SOD活性变化在喷施CC后呈现相似趋势(图4)。
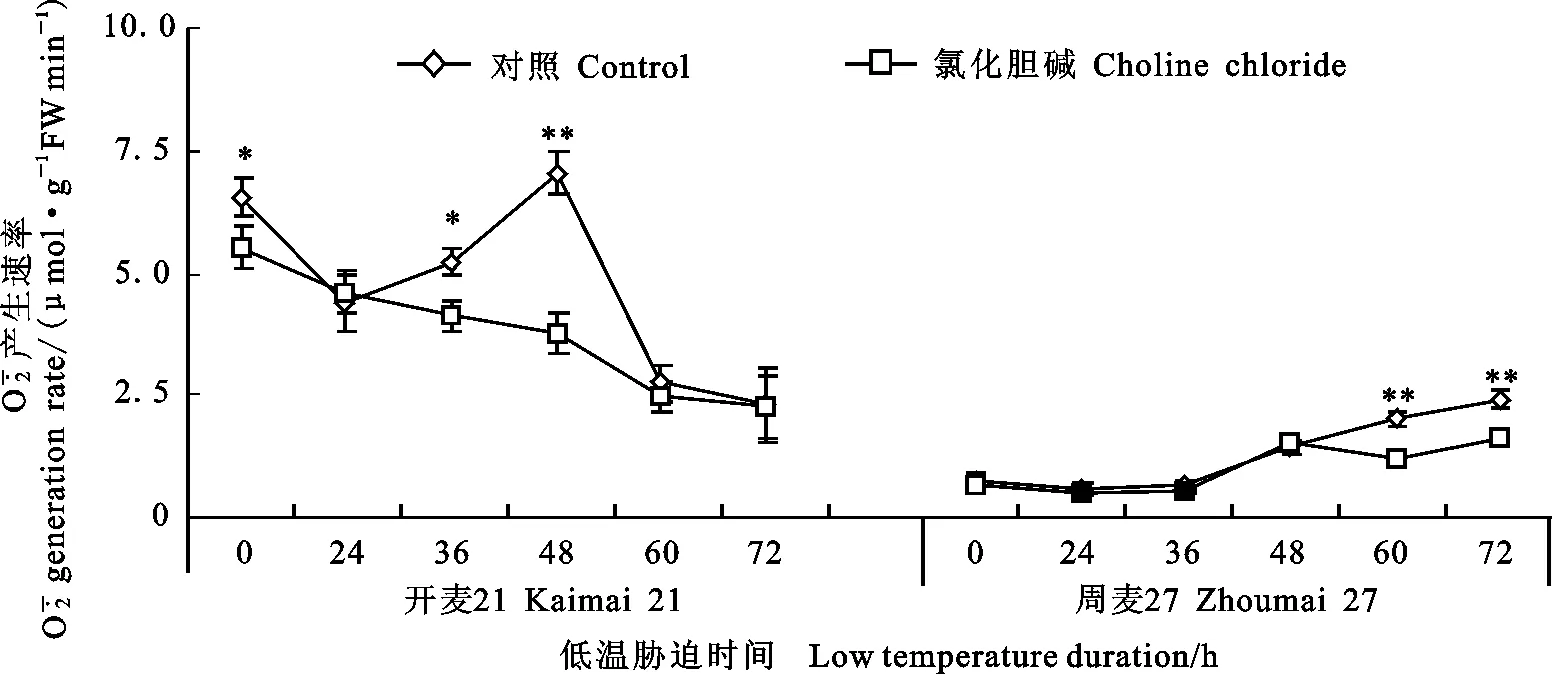
图3 低温处理条件下外源CC对小麦叶片超氧阴离子(O2-·)产生速率的影响Fig.3 Effect of choline chloride treatment on the production rate of superoxide anion(O2-·) in wheat leaves under low temperature

图4 低温处理条件下外源CC对小麦叶片超氧化物歧化酶(SOD)活性的影响Fig.4 Effect of choline chloride treatment on the activity of superoxide dismutase(SOD) in wheat leaves under low temperature
喷施CC对CAT和POD活性的影响与SOD相类似。CAT活性在低温胁迫0~72 h内呈现下降趋势,且CC处理均高于对照,在低温胁迫0 h时喷施CC后,开麦21和周麦27的CAT活性分别增加35.99%和41.03%,且差异均显著(图5)。在低温胁迫0~72 h内,两品种的POD活性变化平缓,与对照相比,喷施CC后小麦叶片POD活性普遍较高,在低温胁迫0 h时两品种的POD活性分别增高18.51%和25.56%,差异均显著(图6)。
2.5 低温胁迫下外源CC对小麦叶片丙二醛(MDA)含量的影响
开麦21叶片MDA含量在低温胁迫36~60 h 时呈先增后降趋势,在低温胁迫72 h时又继续升高;周麦27叶片MDA含量在低温胁迫0~72 h 时也呈现先增后降的趋势。在低温胁迫48 h 时,开麦21和周麦27的MDA含量均达到一个较高的值,在低温胁迫60 h时又出现下降的现象(图7),这与SOD活性在低温胁迫60 h时出现一个峰值相对应;而在低温胁迫48 h时,叶片SOD活性较低,因此在这个时间点叶片MDA含量较高。与对照相比,喷施CC后两个品种的MDA含量均显著降低,表明膜脂损伤减少,小麦的抗低温能力增强。

图5 低温处理条件下外源CC对小麦叶片过氧化氢酶(CAT)活性的影响Fig.5 Effect of choline chloride treatment on the activity of catalase(CAT) in wheat leaves under low temperature

图6 低温处理条件下外源CC对小麦叶片过氧化物酶(POD)活性的影响Fig.6 Effect of choline chloride treatment on the activity of peroxidase(POD) in wheat leaves under low temperature
2.6 低温胁迫下外源CC对小麦叶片脯氨酸(Pro)含量的影响
在低温胁迫0~72 h时,喷施CC提高了小麦叶片Pro含量(图8),其中周麦27的Pro含量在低温胁迫24和36 h时变化显著,分别增加了44.62%和31.32%,而开麦21各时段变化均不显著。这表明在低温胁迫下喷施CC可有效增加小麦叶片的Pro含量,但与品种有关。

图7 低温处理条件下外源CC对小麦叶片丙二醛(MDA)含量的影响Fig.7 Effect of choline chloride treatment on the content of malonaldehydes(MDA) in wheat leaves under low temperature
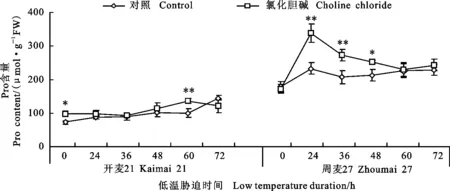
图8 低温处理条件下外源CC对小麦叶片脯氨酸(Pro)含量的影响Fig.8 Effect of choline chloride on the content of proline(Pro) in wheat leaves under low temperature
3 讨 论
低温是影响小麦产量形成的主要灾害之一,植物在受到低温胁迫时,膜脂由液相变为凝胶相,影响膜脂平衡性,导致膜透性增加,电解质外渗,并且温度越低,细胞膜透性改变的越大,膜损伤程度越深[20]。研究表明,低温下细胞膜透性发生改变,导致玉米种子的发芽率和出苗率降低[21];低温弱光条件下,喷施CC可以有效地缓解黄瓜幼苗叶片的损伤[22];低温条件下,喷施CC的水稻幼苗电解质渗透率低于对照[15]。本试验结果表明,低温胁迫下,与对照相比,喷施CC后小麦幼苗电解质渗透率较低,表明外源CC有效地缓解了低温胁迫伤害,与前人研究结果一致。另外,有学者认为,抗冷性强的植物的细胞膜透性小,抗冷性弱的植物的细胞膜透性大,电解质渗透率高,抗低温能力弱[1]。本研究中,与开麦21相比,周麦27幼苗叶片的电解质渗透率较低,膜透性改变较小,抗低温能力也较强。
活性氧是低温胁迫下信号传导过程中的重要调控因子。正常情况下,小麦植株体内的活性氧的产生与清除处于动态平衡的状态,但当受到低温胁迫的时候,小麦植株体内会产生过多的活性氧[23],从而破坏抗氧化酶类的结构和组成,影响膜脂的平衡性,破坏膜结构和膜脂过氧化,MDA是膜脂过氧化的产物之一[24]。植物体内主要的抗氧化酶类包括SOD、POD和CAT,它们可以清除活性氧以及MDA等。周峰等[25]研究表明,外源CC可以有效缓解盐胁迫对菠菜的损伤,增强SOD、POD、CAT等酶的活性,降低超氧阴离子和MDA含量。马菁平等[14]认为,160 mg·L-1的CC预处理玉米幼苗,可以有效地降低玉米幼苗MDA的含量,增强抗氧化酶类SOD、CAT、POD的活性,提高玉米抗低温能力。本试验中,外源CC可有效地增加了小麦SOD、POD、CAT活性,减少了MDA和超氧阴离子的含量,增强了小麦植株对低温的抵抗能力,与前人研究结果一致。
受到低温胁迫时,植物体自身会产生一些渗透调节物质,抵御低温造成的损伤。Pro是主要的渗透调节物质之一,可以提高蛋白质在水中的溶解度,并且维持各种酶类的结构[26]。祁春苗等[27]研究表明,干旱条件下,外源CC处理提高了地黄叶片的Pro含量。也有报道表明,低温弱光处理的黄瓜幼苗叶片中Pro含量呈现先上升后下降的趋势,而CC处理过的黄瓜幼苗叶片Pro含量均比对照高[22]。另外,在PEG胁迫条件下,CC处理的小麦幼苗叶片Pro含量比对照高[12]。本研究中,在低温胁迫过程中,Pro的含量呈现先升高后降低的趋势;与对照相比,喷施CC的小麦幼苗叶片的Pro含量较高,表明喷施CC可以提高小麦幼苗的抗低温能力。
参考文献:
[1] 赵黎明,李 明,郑殿峰,等.冷害后植物生理变化及外源物质调控研究进展[J].中国农学通报,2015,31(12):218.
ZHAO L M,LI M,ZHENG D F,etal.Research progress of physiological changes and regulation of exogenous substance of chilling injury on plant [J].ChineseAgriculturalScienceBulletin,2015,31(12):218.
[2] POTTERS G,HOREMANS N,JANSEN M A K.The cellular redox state in plant stress biology—a charging concept [J].PlantPhysiologyandBiochemistry,2010,48(5):292.
[3] 毛桂莲,许 兴,米海莉,等.NaCl胁迫下枸杞愈伤组织活性氧产生与质膜H+-ATPase活性的关系[J].干旱地区农业研究,2003,21(3):112.
MAO G L,XU X,MI H L,etal.Relationship between active oxygen production and plasma membrane H+-ATPase activity in calli ofLyceumbarbarumunder salt stress [J].AgriculturalResearchintheAridAreas,2003,21(3):112.
[4] YAMAMOTO Y,KOBAYASHI Y,MATSUMOTO H.Lipid peroxidation is an early symptom triggered by aluminum,but not the primary cause of elongation inhibition in pea roots [J].PlantPhysiology,2001,125:203.
[5] 张文静,刘 亮,黄正来,等.低温胁迫对稻茬小麦根系抗氧化酶活性及内源激素含量的影响[J].麦类作物学报,2016,36(4):502.
ZHANG W J,LIU L,HAUNG Z L,etal.Effect of low temperature on antioxidative enzymes activity and endogenous hormone content in wheat root of rice-wheat rotation [J].JournalofTriticeaeCrops,2016,36(4):502.
[6] 陈 龙,吴诗光,李淑梅,等.低温胁迫下冬小麦拔节期生化反应及抗性分析[J].华北农学报,2001,16(4):45.
CHEN L,WU S G,LI S M,etal.Biochemical reaction and resistance analysis of jointing stage of winter wheat under low temperature stress [J].ActaAgriculturaeBoreali-Sinica,2001,16(4):45.
[7] 李春燕,陈思思,徐 雯,等.苗期低温胁迫对扬麦16叶片抗氧化酶和渗透调节物质的影响[J].作物学报,2011,37(12):2297.
LI C Y,CHEN S S,XU W,etal.Effect of low temperature at seedling stage on antioxidation enzymes and cytoplasmic osmoticum of leaves in wheat cultivar Yangmai 16 [J].ActaAgronomicaSinica,2011,37(12):2297.
[8] KHEDR A H A,ABBAS M A,WAHID A A A,etal.Proline induces the expression of salt-stress-responsive proteins and may improve the adaptation ofPancratiummaritimumL.to salt-stress [J].JournalofExperimentalBotany,2003,54(392):2553.
[9] 李春喜,王言景,邵 云,等.化学调控剂不同施用方式对小麦抗冻性的影响[J].麦类作物学报,2010,30(2):384.
LI C X,WANG Y J,SHAO Y,etal.Effects of chemical-control reagents application on physuological and morphological indexes to cold tolerance of wheat [J].JournalofTriticeaeCrops,2010,30(2):384.
[10] CHE F S,CHO C,HYEON S B,etal.Metabolism of choline chloride and its analogs in wheat seedlings [J].PlantandCellPhysiology,1990,31(1):45.
[11] 陈 楚,张云芳,荆小燕.氯化胆碱浸种处理对盐胁迫下小麦种子萌发以及幼苗生长的影响[J].麦类作物学报,2013,33(5):1030.
CHEN C,ZHANG Y F,JING X Y.Effects of seed soaking with choline chloride solution on seed germination and seedling growth of wheat under salt stress [J].JournalofTriticeaeCrops,2013,33(5):1030.
[12] 季玉龙,刘世名,陈靠山,等.氯化胆碱对小麦幼苗叶片在渗透胁迫下的影响[J].干旱地区农业研究,2002,20(1):57.
JI Y L,LIU S M,CHEN K S,etal.Effect of choline chloride on seedling leaves of wheat under osmotic stress [J].AgriculturalResearchintheAridAreas,2002,20(1):57.
[13] ZHAO H J,TAN J F,QI C M,Photosynthesis ofRehmanniaglutinosasubjected to drought stress is enhanced by choline chloride through alleviating lipid peroxidation and increasing proline accumulation [J].PlantGrowthRegulation,2007,51:255.
[14] 马菁平,朱昌华,夏 凯,等.卵磷脂和氯化胆碱对玉米幼苗生长及抗冷性的影响[J].江苏农业科学,2008(5):27.
MA J P,ZHU C H,XIA K,etal.Effects of lecithin and choline chloride on growth and cold resistance of maize seedlings [J].JiangsuAgriculturalSciences,2008(5):27.
[15] 梁煜周,何若天.氯化胆碱对低温胁迫下稻苗的保护作用[J].中国水稻科学,1999,13(1):34.
LIANG H Z,HE R T.Protective effect of choline chloride on rice under chilling stress at seedling stage [J].ChineseJournalofRiceScience,1999,13(1):34.
[16] 孙苗苗,王志强,高 翔,等.河南主推小麦品种对低温胁迫的生理响应及耐寒性分析[J].麦类作物学报,2016,36(3):318.
SUN M M,WANG Z Q,GAO X,etal.Cold tolerance evaluation of wheat varieties in Henan based on their physiological response to low temperature stress [J].JournalofTriticeaeCrops,2016,36(3):318.
[17] 高俊风.植物生理学实验技术[M].西安:世界图书出版社,2006:140-144,210-217.
GAO J F.Physiological experimental technology [M].Xian:World Publishing House,2006:140-144,210-217.
[18] 张志良.植物生理实验指导[M].北京:高等教育出版社,1990:259-261.
ZHANG Z L.Handbook of plant physiology experiment [M].Beijing:Higher Education Press,1990:259-261.
[19] 王爱国,罗广华.植物的超氧物自由基与羟胺反应的定量关系[J].植物生理学通讯,1990(6):57.
WANG A G,LUO G H.Quantitative relation between the reaction of hydroxylamine and superoxide anion radicals in plants [J].PlantPhysiologyCommunications,1990(6):57.
[20] YIN G,SUN H,XIN X,etal.Mitochondrial damage in the soybean seed axis during imbibition at chilling temperatures [J].PlantandCellPhysiology,2009,50(7):1313.
[21] 胡海军,王志斌,陈凤玉,等.玉米冷害生理机制研究进展[J].玉米科学,2009,17(2):149.
HU H J,WANG Z B,CHEN F Y,etal.Progress in reseachon cold damage physiological mechanism of maize [J].JournalofMaizeSciences,2009,17(2):149.
[22] 盛瑞艳,李鹏民,薛国希,等.氯化胆碱对低温弱光下黄瓜幼苗叶片细胞膜和光合机构的保护作用[J].植物生理与分子生物学学报,2006,32(1):87.
SHENG R Y,LI P M,XUE G X,etal.Choline chloride protects cell membrane and the photosynthetic apparatus in cucumber seedling leaves at low temperature and weak light [J].JournalofPlantPhysiologyandMolecularBiology,2006,32(1):87.
[23] DAT J,VANDEMABEELE S,VRANOVA E,etal.Dual action of the active oxygen species during plant stress responses [J].CellularandMolecularLifeSciences,2000,57(5):786.
[24] 赵天宏,孙加伟,付 宇.逆境胁迫下植物活性氧代谢及外源调控机理的研究进展[J].作物杂志,2008(3):11.
ZHAO T H,SUN J W,FU Y.Advances of research on m etabolism of plant reactive oxygen species and exogenous regulation under abiotic stresses [J].Crops,2008(3):11.
[25] 周 峰,张边江,华 春,等.氯化胆碱对低盐处理下菠菜光合生理和抗氧化酶的效应[J].华北农学报,2012,27(1):164.
ZHOU F,ZHANG B J,HUA C,etal.Effect of choline chloride on photosynthetic physiology and antioxidant enzyme activity of spinach under low NaCl treatment [J].ActaAgriculturaeBoreali-Sinica,2012,27(1):164.
[26] 王茂良.植物抗渗透胁迫及其与脯氨酸的关系[J].北京园林,2006,22(2):24.
WANG M L.Plant resistance to osmotic stress and its relationship with proline [J].BeijingBotanicalGarden,2006,22(2):24.
[27] 祁春苗,张秀月,赵会杰.氯化胆碱对受旱地黄叶片渗透调节物质与光合的影响[J].河南农业科学,2007(1):86.
QI C M,ZHANG X Y,ZHAO H J.Effects of choline chloride on osmolytes and photosynthesis ofRehmanniaglutinosaunder drought stress [J].JournalofHenanAgriculturalSciences,2007(1):86.

