普通小麦 TaCAT 9基因的克隆与表达分析
褚莹莹,王晨阳,2,陈雨露,康 娟,马 耕,刘卫星,胡阳阳,李莎莎
(1.河南农业大学农学院,河南郑州 450002; 2.国家小麦工程技术研究中心,河南郑州 450002)
氨基酸是植物体内氮素存在的主要形式,能够作为含氮通货参与到各种代谢途径中,而这个过程有赖于氨基酸转运蛋白的运输功能,因此研究氨基酸转运蛋白的功能对于植物氮代谢的研究具有重要意义[1-2]。植物中的氨基酸转运蛋白可分为五大超家族,但研究较多的主要有两个超家族:一个是氨基酸转运蛋白超家族(ATFs),约有46个成员,至少又可分为5个亚家族;另一个是氨基酸-多胺-胆碱转运蛋白超家族(APCs),有14个成员,又分为L型氨基酸转运蛋白(LATs)和阳离子氨基酸转运蛋白(CATs)两个亚家族[3-5]。研究表明,除了脯氨酸转运蛋白,所有的氨基酸转运蛋白都表现出显著的底物专一性[6]。许多研究证明氨基酸转运蛋白的表达具有组织及器官特异性,且受多种因素的影响,如光、线虫感染、蔗糖、渗透势、铵盐、硝酸盐及谷氨酸等[7-9]。目前对ATFs超家族的研究较为透彻,而对APCs超家族的研究相对较少,本试验的研究对象CAT9是CATs亚家族中的一员[9]。
对植物CATs亚家族的研究报道主要集中在模式植物中,拟南芥CATs亚家族有9个成员,大都定位于质膜或液泡膜上,具有11~14个推测的跨膜结构域[9-10]。AtCAT1启动子与GUS融合表达分析显示,该基因主要高表达于衰老的叶片,在初生根的根尖及花中也能检测到少量表达,猜测该基因可能参与氨基酸向种子的运输[11]。AtCAT2主要定位于液泡膜,可能通过参与氨基酸的跨液泡膜转运来调节叶片可溶性氨基酸浓度;AtCAT3和AtCAT4分别定位于高尔基体膜和液泡膜,具体功能有待研究[12]。AtCAT5主要在籽粒中表达,可能在籽粒形成或种子萌发过程中装载种柄中的氨基酸,又有研究表明该基因在真叶边缘部位的表达量也比较高,可能参与重新吸收叶缘部位渗漏的氨基酸[13-14]。AtCAT6只在根原基、花及种子等作为库的组织器官中表达,而且在根部的表达水平能够受到根结线虫感染的诱导[9]。AtCAT7在正常环境下的表达水平非常的低[13],AtCAT8在根和植株上部的分生组织中有较高的表达丰度,其功能可能是介导氨基酸特别是谷氨酸和谷氨酰胺向植株幼嫩分生组织分配[14]。研究表明,拟南芥中AtCAT9基因主要定位于囊泡膜上,具有比较广泛的表达特性,在大多数组织器官中都有表达,可能参与调控液泡内外氨基酸浓度的平衡,过表达AtCAT9的拟南芥植株在低氮胁迫下具有生长发育延迟、叶片衰老缓慢的现象[15]。番茄中的研究表明,CAT9可能充当膜两侧GLU/ASP与GABA之间交换的媒介,导致番茄成熟过程中大液泡内GLU/ASP增加,GABA减少,从而影响番茄的口感与营养品质[16]。
小麦是全球最重要的粮食作物之一,其产量高低直接关系着世界粮食安全。研究氮代谢相关基因的功能对提高氮素利用率及产量具有重要意义。本实验室通过前期的蛋白组学研究发现小麦幼苗叶片中的TaCAT9蛋白参与低氮胁迫的应答,说明其可能在氮素胁迫条件下起着某种调控作用(数据未发表)。通过查阅文献发现,目前有关小麦TaCAT9基因及CATs基因家族的研究尚未见报道。鉴于此,本研究采用同源克隆的方法,从普通小麦品种豫麦49-198中克隆TaCAT9两个部分同源基因的cDNA序列,对其进行生物信息学分析,同时研究了TaCAT9在不同组织器官中及氮素胁迫下的表达特性,以期为进一步探索TaCAT9的生物学功能奠定基础。
1 材料与方法
1.1 材料及处理
供试材料为河南省大面积种植的小麦品种豫麦49-198,该品种具有丰产、优质、抗逆性好的特点,由河南平安种业有限公司惠赠。
选取籽粒饱满的豫麦49-198种子,经75%酒精浸泡10 min后,用蒸馏水清洗干净,置于干净的湿毛巾上,在黑暗条件下放置48 h,期间保持毛巾湿润状态。待种子露白后,选取发芽一致的种子置于灭菌培养皿中,在光暗周期16/8 h、光照强度250 μmol·m-2·s-1、昼夜温度25/15 ℃、昼夜相对湿度60%和70%的培养箱中培养。培养液为Hoagland全营养液,每天更换一次。待幼苗长至两叶一心,将幼苗做两种处理:一种为对照组,在Hoagland全营养液中生长;另一种为处理组,生长于缺氮的Hoagland营养液(用KCl和CaCl2代替Hoagland营养液中的KNO3和Ca(NO3)2)中。分别在0、0.25、0.5、1和7 d时取对照组与处理组的小麦幼苗叶片用于低氮胁迫下目的基因的表达模式分析。剪取正常处理两叶一心期的叶片用于目的基因的克隆。所有材料用液氮速冻后保存于-80 ℃冰箱备用。
目的基因组织特异性表达分析:于2016年10月将豫麦49-198种植于河南农业大学科教园区试验田,正常水肥管理,即施纯氮240 kg·hm-2、磷肥(P2O5)150 kg·hm-2、钾肥(K2O)120 kg·hm-2,分别于拔节期和扬花期灌水,水表计量,每次灌水量750 m3·hm-2。小区面积为21 m2(7 m×3 m)。由于从2010年起,连续六年对该小区采取了精细化的栽培管理措施,因此土壤养分等条件基本一致。在小麦开花期选取花期与长势一致的植株挂牌标记,于花后15 d取标记植株的根、茎、叶和籽粒,液氮速冻后保存于-80 ℃ 冰箱备用。
1.2 RNA的提取及cDNA第一链的合成
小麦根、茎、叶和籽粒总RNA的提取采用Trizol法,具体提取步骤参照Trizol Reagent(北京索莱宝科技有限公司)说明书进行。用1%的琼脂糖凝胶电泳检测提取总RNA的完整性,并采用ND-1000微量紫外分光光度计(基因有限公司)测定RNA的浓度和纯度。总RNA经DNaseⅠ(普洛麦格(北京)生物技术有限公司)处理后作为模板,参照PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit(宝生物工程(大连)有限公司)合成cDNA第一条链,-20 ℃保存备用。
1.3 引物设计及TaCAT9基因的克隆
以二穗短柄草CAT9(XM_003569968.3)的cDNA序列为探针在Ensembl Plants六倍体小麦数据库(http://plants.ensembl.org/Triticum_aestivum/Info/Index)进行比对,得到三条高度相似且分别定位在6 A、6 B和6 D长臂上的序列,对应的序列号分别为TRIAE_CS42_6AL_TGACv1_471594_AA1511590.1,RIAE_CS42_6BL_TGACv1_501182_AA1614650.1和TRIAE_CS42_6DL_TGACv1_526398_AA1682300.1;长度分别为2 462、2 572和2 365 bp,均包含一个长度为1 818 bp的开放阅读框。比对这三条序列开放阅读框的上下游,利用Primer5.0软件在三条序列相似的部位设计两对引物TaCAT9-F-1/TaCAT9-R和TaCAT9-F-2/TaCAT9-R用于三个部分同源基因cDNA序列的扩增。由于上游引物5′端第五个碱基在三条序列的结合位点上存在一个由T到C的替换,所以设计两条上游引物TaCAT9-F-1和TaCAT9-F-2,它们只在的5′端第五个碱基存在差异,分别为T和C。引物由北京奥科鼎盛生物科技有限公司合成,序列信息见表1。以豫麦49-198两叶一心时期叶片的cDNA为模板进行PCR扩增,所用的酶为2×Phanta Max Master Mix(南京诺唯赞生物科技有限公司)。扩增体系与程序参照说明书,其中循环数为32,退火温度为56 ℃,延伸时间为2 min 30 s。扩增结束后,用1%的琼脂糖对PCR产物进行电泳检测,回收纯化目的片段后,将目的片段连接至克隆载体pTOPO-Blunt simple(北京爱德莱生物科技有限公司),转化大肠杆菌感受态细胞DH10B(北京中美泰和生物技术有限公司),从两对引物组合的扩增产物中挑选经PCR鉴定正确的阳性克隆送至北京奥科鼎盛生物科技有限公司进行测序。
1.4 TaCAT9基因编码蛋白的生物信息学分析
运用ExPASy-ProtParam(https://web.expasy.org/protparam/)对TaCAT9基因编码蛋白的理化性质进行预测;运用WOLF PSORT(https:// psort.hgc.jp/)和TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)对编码蛋白的信号肽、亚细胞定位及跨膜区进行预测;运用InterProScan(http://www.ebi.ac.uk/interpro/)对编码蛋白保守结构域进行预测。利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)预测TaCAT9蛋白质的二级结构,用Phyre 2(http://www.sbg.bio.ic.ac.uk/Phyre2/html/page.cgi?id=index)预测蛋白质的三级结构。以TaCAT9蛋白序列为探针,在NCBI(https://www.ncbi.nlm.nih.gov/)搜索不同物种的同源蛋白,并利用DNAMAN5.2.2进行蛋白序列的多重比对,利用MEGA5.0构建基于neigbor-joining(bootstrap值为1 000)的系统发育树。
1.5 TaCAT9基因的表达分析
由于序列高度相似,未能设计出分别针对TaCAT9-A和TaCAT9-B的特异引物,只设计了一对针对两序列的特异性引物。利用NCBI在线引物设计工具primer-BLAST(https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi?LINK_LOC=BlastHome)在TaCAT9-A和TaCAT9-B序列的保守区(避开核苷酸突变点)设计引物对TaCAT9-qPCR-F/TaCAT9-qPCR-R(表1),用于检测TaCAT9基因的相对表达量;内参基因采用小麦看家基因β-Actin(AB181991),所用引物Actin-F/Actin-R序列见表1[17]。qRT-PCR体系与程序参照SYBR Premix ExTaqTMⅡ(宝生物工程(大连)有限公司)说明书,其中循环数为40,退火温度为60 ℃,延伸时间为30 s。所用反应平台为CFX Connect Real-time Systerm(伯乐生命医学产品(上海)有限公司),每个样品设置3次生物学重复。目的基因相对表达量的计算采用2-△△CT法,用SPSS 19.0对数据进行显著性分析,用Excel 2003作图。

表1 本研究中所用引物的基本信息Table 1 Primers used in this study
2 结果与分析
2.1 小麦TaCAT9基因克隆结果
利用引物TaCAT9-F1/TaCAT9-R和TaCAT9-F2/TaCAT9-R分别对豫麦49-198的cDNA进行扩增,分别得到两条大小约为2 000 bp的特异性条带(图1)。将目的条带回收纯化后,经连接、转化,各筛选30个阳性克隆进行测序。测序结果与中国春的三条序列(见材料方法)进行比对,结果表明:TaCAT9-F1/TaCAT9-R扩增产物连接转化的30个阳性单克隆的序列信息都与TRIAE_CS42_6AL_TGACv1_471594_AA1511590.1相同,而TaCAT9-F2/ TaCAT9-R有3个单克隆的序列与TRIAE_CS42_6BL_TGACv1_501182_AA1614650.1相同,其余都与TRIAE_CS42_6AL_TGACv1_471594_AA1511590.1相同。所以本试验共得到两个TaCAT9基因的cDNA序列,因其分别位于小麦A和B亚基因组上,故将其分别命名为TaCAT9-A和TaCAT9-B。对于TaCAT9-D,可能由于表达量过低或者没有表达,本研究没能克隆到其cDNA序列。通过比对分析发现,两序列间存在28个单核苷酸突变位点,其中8个为有义突变,导致7个氨基酸的改变,分别为第116、136、154、652、1 420、1 546、1 547和1 711位碱基,其中第1 546位与第1 547位共同导致一个氨基酸的改变;其余20个为沉默突变 ,没有导致氨基酸的变化(图2)。
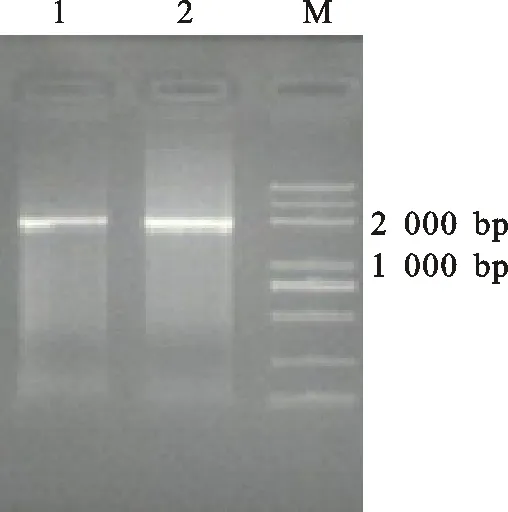
1:引物TaCAT9-F1/TaCAT9-R 的扩增产物;2:引物TaCAT9-F2/TaCAT9-R 的扩增产物;M:Trans2k Plus DNA marker。
1:Amplified products of primer TaCAT9-F1/TaCAT9-R;2:Amplified products of primer TaCAT9-F2/TaCAT9-R;M:Trans2k Plus DNA marker.
图1TaCAT9基因的RT-PCR扩增产物
Fig.1AmplifiedproductsofTaCAT9genebyRT-PCR

图2 TaCAT9-A和TaCAT9-B的cDNA序列比对Fig.2 Alignment of cDNA sequences between TaCAT9-A and TaCAT9-B
2.2 TaCAT9基因编码蛋白的生物信息学分析
2.2.1TaCAT9基因编码蛋白的理化性质
由于序列相似度极高,protparam在线预测分析显示TaCAT9-A和TaCAT9-B两蛋白基本理化性质非常接近,分子式分别为C2959H4619N743O802S19和C2962H4626N746O799S19,分子量分别为64.04和64.08 kDa,理论等电点(pI)分别为8.23和8.27,属于弱碱性蛋白。脂肪族氨基酸指数分别为114.91和114.76,负电荷的氨基酸残基数(Asp+Glu)分别为31和30;正电荷的氨基酸残基数(Arg+Lys)分别为34和35。总平均亲水性值(GRAVY)分别为0.745和0.739,不稳定系数分别为35.62和35.68,两者都属于疏水稳定蛋白。
2.2.2TaCAT9基因编码蛋白的亚细胞定位、跨膜区及保守结构域
WOLF PSORT预测分析显示,两蛋白均定位于细胞膜上,没有分泌通路信号肽,即两蛋白都不属于分泌型蛋白。TMHMM在线预测表明TaCAT9-A和TaCAT9-B蛋白都存在13个跨膜区,属于膜蛋白,这和前人对CAT亚家族蛋白跨膜区的描述相吻合。InterProScan保守结构域分析显示(图3),两蛋白都属于氨基酸透性酶家族,且都含有一个典型的阳离子氨基酸转运蛋白的保守C末端。
2.2.3TaCAT9基因编码蛋白的氨基酸序列比对及进化分析
利用DNAMAN将TaCAT9-A和TaCAT9-B蛋白的氨基酸序列与来自玉米(NP_001168279.1)、水稻(XP_015627412.1)和高粱(XP_002454544.1)的CAT9氨基酸序列进行多重比对。结果(图4)表明,4个物种间的CAT9蛋白氨基酸序列长度差别不大,都约有600个氨基酸,且同源性较高。TaCAT9-A和TaCAT9-B两者的同源性达到98.84%,4个物种间的同源性达到91.26% ,氨基酸序列高度保守,都包含13个跨膜区和1个保守的阳离子氨基酸转运蛋白的C末端。

图3 TaCAT9-A和TaCAT9-B蛋白的保守结构域分析Fig.3 Conserved domains of TaCAT9-A protein and TaCAT9-B protein
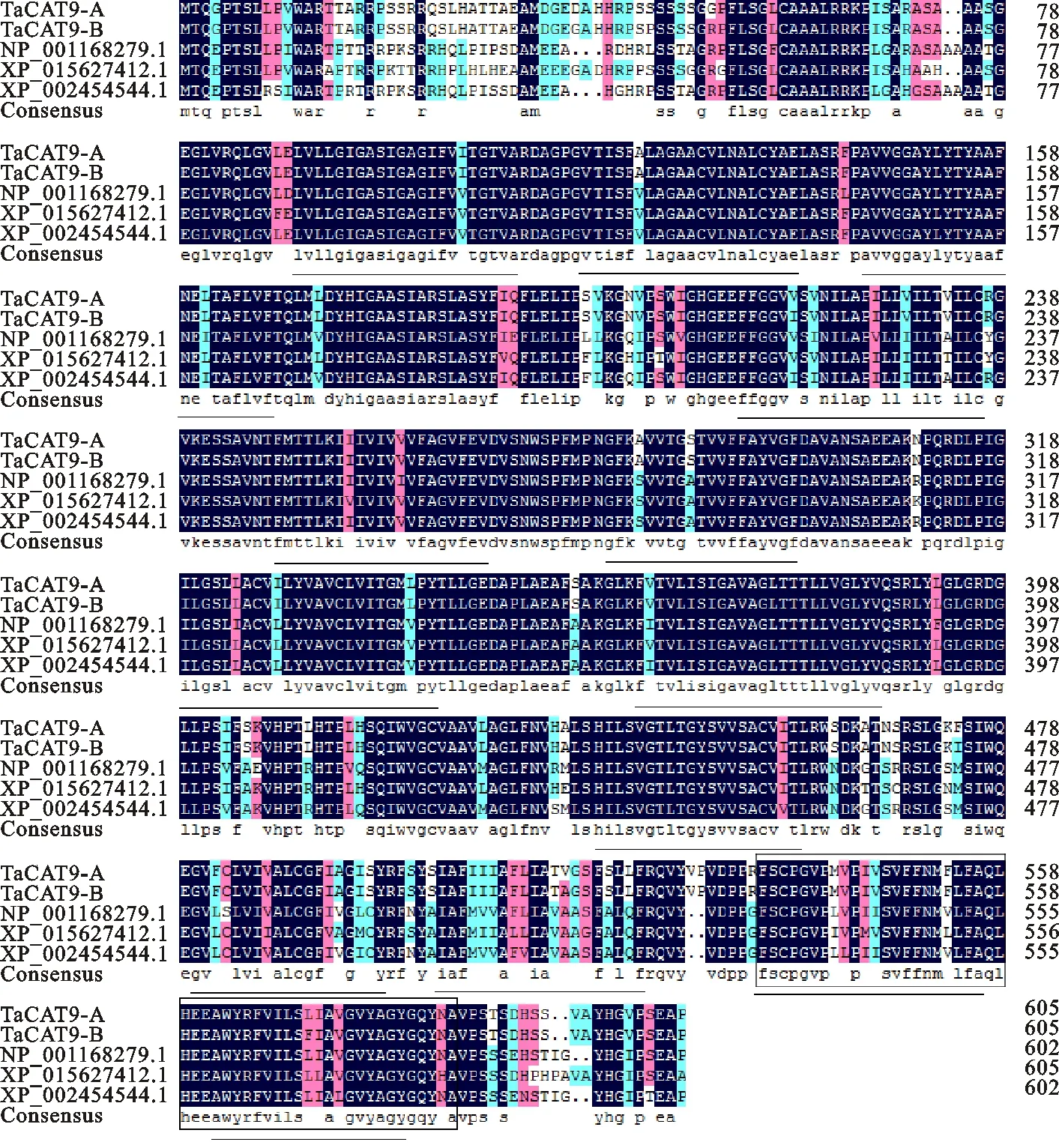
方框指示阳离子氨基酸转运蛋白的C末端,横线指示13个跨膜区。
The box indicates the C-terminal of cationic amino acid transporter and the horizontal lines indicate 13 transmembrane regions.
图4TaCAT9与其他物种同源蛋白的多序列比对
Fig.4Multi-alignmentofTaCAT9aminoacidsequencewithotherCAT9s
进化分析(图5)表明,所有参比的CAT9蛋白可以被分为两大类,小麦等单子叶植物为一类,拟南芥等双子叶植物为一类。其中与TaCAT9-A蛋白亲缘关系最近的为乌拉尔图小麦的CAT9蛋白,而山羊草CAT9蛋白与前二者聚类在一起,TaCAT9-B蛋白与上述三者聚类在一起。
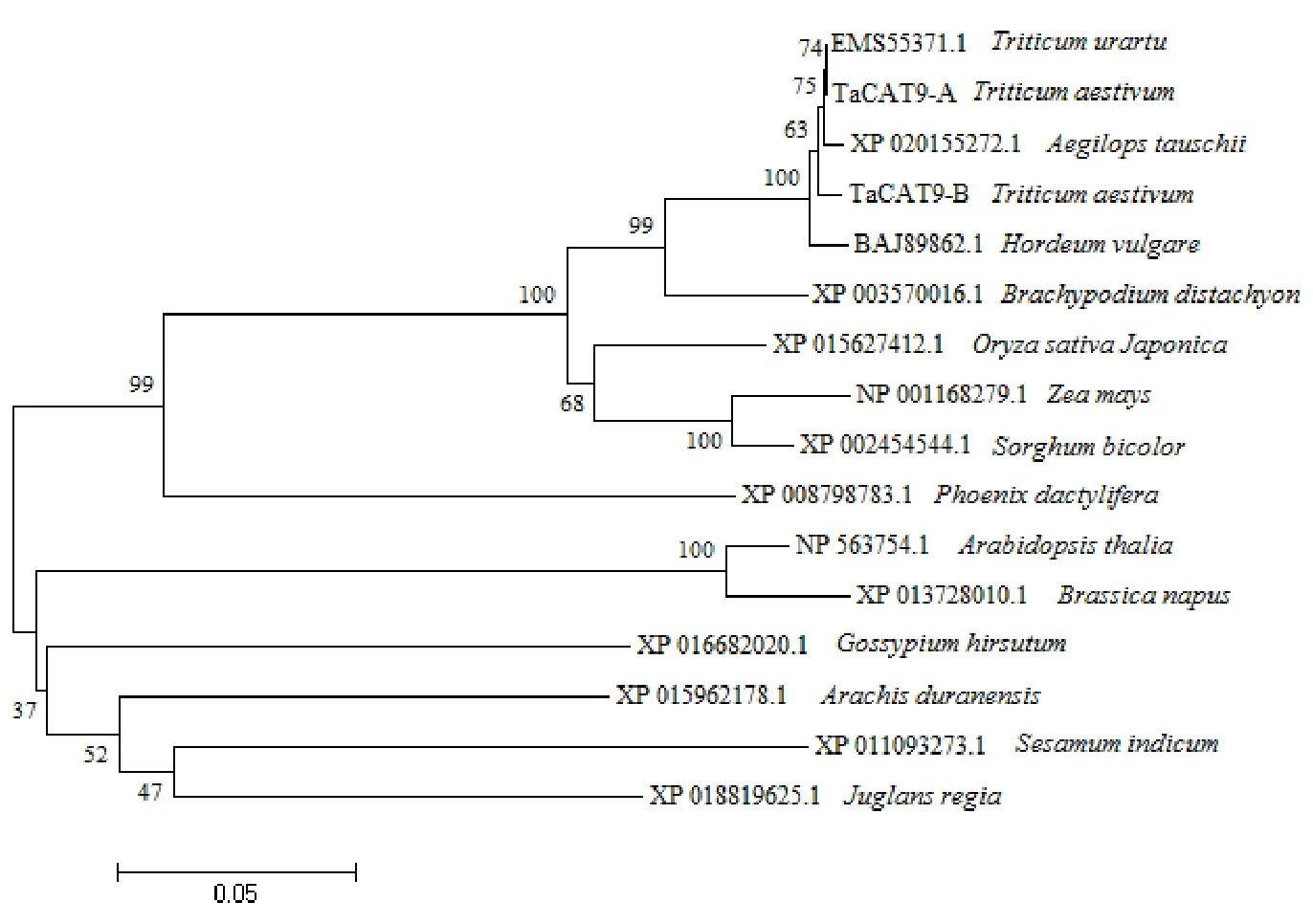
图5 小麦与其他物种CAT9蛋白的进化分析Fig.5 Phylogene tree of CAT9 proteins from wheat and other species表2 TaCAT9蛋白的二级结构预测及所占比例Table 2 Prediction proportion of secondary structure of TaCAT9 protein %

2.2.4TaCAT9基因编码蛋白的二级及三级结构预测结果
通过SOPMA在线预测分析了TaCAT9-A和TACAT9-B的二级结构组成(表2),两者都是由α-螺旋、延伸直链、β-转角和无规则卷曲四种二级结构组成,两个蛋白所含的各种二级结构比例相近,其中α-螺旋所占比例最高,无规则卷曲次之。通过Phyre 2构建了蛋白的3D模型,因TaCAT9-A 与TACAT9-B氨基酸序列高度相似,所以同源建模选用的蛋白模型相同,3D结构图也相同。该模型中有73%的氨基酸序列结构预测置信度达到100%,因此该蛋白质结构模型可信度较高。由图6可知,两蛋白主要由13个α-螺旋组成,这与TMHMM预测的两个蛋白都有13个跨膜区一致。
2.3 TaCAT9基因的表达特性分析
在根、茎、叶和籽粒中均可检测到TaCAT9基因的表达,但在根和籽粒中的表达量最低,茎中次之,叶片中的表达量最高,推测TaCAT9基因主要在叶片中表达(图7)。进一步的分析显示,在氮胁迫下,小麦叶片TaCAT9基因的表达呈上升趋势,在胁迫初期变化不明显,随着胁迫时间的增加表达量逐渐上调。
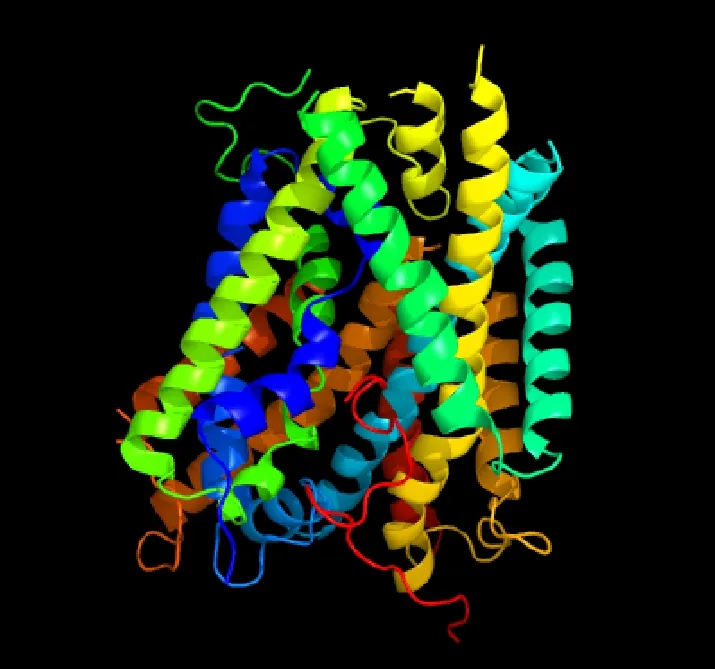
图6 TaCAT9蛋白的三级结构预测Fig.6 Prediction of three dimensional structure of TaCAT9 protein
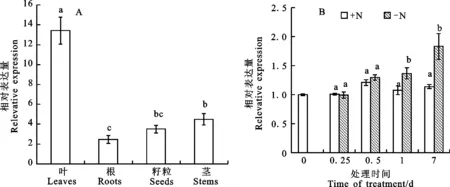
图柱上的小写字母不同表示在0.05水平差异显著。
The different lower-case letters above the bar indicate significant difference at 0.05 level.
图7TaCAT9基因的组织器官表达模式(A)和氮胁迫下TaCAT9基因在叶片中的表达模式(B)
Fig.7ExpressionpatternsofTaCAT9indifferenttissuesofwheatandexpressionpatternsofTaCAT9geneinleavesundernitrogenstress
3 讨 论
普通小麦是一个典型的异源六倍体物种,由三个序列高度同源的亚基因组A、B和D组成[18]。因此,小麦中大部分基因在A、B和D三个亚基因组上都有一个基因位点,这三个基因称为部分同源基因。研究表明,在六倍体小麦的产生以及进化过程中,部分同源基因的表达可能产生分化[1,19]。如小麦膨胀素基因(TaEXPA1),它的三个部分同源基因TaEXPA1-A/B/D在幼苗的根中都是沉默的,但TaEXPA1-A和TaEXPA1-D在幼叶中表达,而TaEXPA1-B在该组织中则是沉默的[20]。小麦TaWLHSI-A/B/D在不同的组织器官中具有不同的表达模式:TaWLHSI-B几乎在所有组织器官中的表达量都低于另外两个基因,TaWLHSI-A在幼穗中表达量最高,TaWLHSI-D则在稃中高表达[21]。以上研究表明,三个部分同源基因可能通过表达的分化来实现功能的相互协调,从而来调控小麦的生长发育。这一调控网络的复杂性,大大增加了小麦遗传和功能分析的难度。在研究小麦的某个基因时,研究者需要面对三个序列高度同源的基因,由于缺乏小麦基因组信息,使得区分部分同源基因的难度会很大,所以很多研究者并没有对它们加以区分。2014年,IWGSC(国际小麦基因组测序组织)采用先分离染色体臂,再对染色体臂分别测序的方法,发表了基于染色体测序的六倍体小麦中国春的序列草图,这为研究小麦部分同源基因的遗传和功能分析提供了一个很好的参考[22]。本研究所用的Ensemble plants网站中的小麦数据库是基于中国春基因组信息而形成的,其中很多基因的转录本信息都是通过分析软件预测的,而且不同品种间的序列信息也可能有所不同,比如存在SNP位点,存在不同的剪切体,这些都需要实验加以验证[23-24]。本研究通过二穗短柄草CAT9基因的 cDNA序列在Ensembl plants小麦数据库中比对到三条高度同源的转录本,分别位于小麦6A、6B和6D染色体上,可以初步判定为TaCAT9的三个部分同源基因。以中国春的这三条转录本为参考,设计引物,从豫麦49-198克隆到位于6A和6B上的两条序列,分别将其命名为TaCAT9-A和TaCAT9-B。比对分析发现克隆的两条序列与中国春的序列相似性达到100%,猜测该基因序列在不同品种间较为保守。可能由于D基因组上的序列表达量过低或者没有表达,所以本研究没有克隆到。另一方面从筛选单克隆测序的结果来看,本研究所采用的组织材料中,A基因组上的序列表达量最高,其他两种远远低于该序列,推测三个部分同源基因中TaCAT9-A基因发挥主要功能。当然不排除在其他组织器官或受到内外因素的刺激后,三个基因的表达量会发生变化,这需要进一步的研究。
本研究从豫麦49-198中克隆到的两个TaCAT9基因的cDNA序列编码区长度都为1 818 bp,编码605个氨基酸,它们所编码的蛋白无论从基本理化性质还是结构特征上都高度相似。保守结构域分析表明,两蛋白都有一个阳离子氨基酸转运蛋白家族的C末端,且都有13个跨膜结构,这都符合模式作物中CATs亚家族的结构特点。由于尚未发现与小麦TaCAT9基因相关的研究报道,因此了解该基因的功能只能通过参考其他物种中已有的报道。拟南芥中的研究表明氨基酸转运蛋白是个庞大的多基因家族,而CATs作为APCs家族中的一个亚族,主要参与中性氨基酸的运输[14]。2015年,Christopher等[16]通过定量蛋白组学的方法分析了番茄由绿变红过程中果肉细胞液泡膜蛋白的变化,发现CAT9蛋白占液泡膜总蛋白的比例由0.02% 升至0.12%,亚细胞定位分析表明该蛋白不仅存在于液泡膜,而且广泛存在于细胞的各种膜结构中;进一步研究表明,该蛋白可能在番茄果实成熟过程中充当液泡膜内外GLU/ASP与GABA交换的载体。同一年,Yang等[15]在拟南芥中研究发现,在氮素亏缺的生长条件下,AtCAT9缺失会造成植株萎黄失绿,早衰死亡,而过表达AtCAT9则完全相反,植株发育迟缓,存活率升高,叶片的持绿性明显增强;进一步分析发现相对于AtCAT9缺失植株,转基因植株叶片的可溶性氨基酸含量显著降低,这说明过表达AtCAT9有利于提高氮素利用率,缓解氮素缺失造成的不利影响。本研究中,WOLF PSORT预测分析显示TaCAT9-A和TaCAT9-B均定位于细胞膜,说明TaCAT9为膜蛋白,但软件预测的结果较为模糊,该蛋白也有可能位于细胞的多种膜结构中,需要进一步的实验去明确小麦中CAT9的亚细胞定位。另外,采用同源建模的方法构建TaCAT9蛋白的 3D模型时,Phyre2服务器预测该蛋白可能为GLU与GABA的逆向转运蛋白,这和番茄中的研究结果较为相似,所以猜测GLU与GABA这两种氨基酸可能为TaCAT9转运的底物。qRT-PCR结果显示,TaCAT9基因主要在小麦叶片中表达,茎中次之,根和籽粒中最少;与正常供氮的植株相比,缺氮植株叶片TaCAT9基因在胁迫初期无变化,随着胁迫时间的延长该基因的表达量显著上调,说明TaCAT9参与低氮胁迫应答。而胁迫响应表现出一定的滞后可能是因为无机氮不是氨基酸转运蛋白的直接作用底物,其在根部吸收后,需要同化为氨基酸及经过一系列反应才能影响到氨基酸转运蛋白的表达,所以缺氮不会立即影响到TaCAT9的表达。
参考文献:
[1] 卢永恩.水稻谷氨酸合酶基因和胞质异柠檬酸脱氢酶基因的功能研究以及氨基酸转运蛋白基因家族分析[D].武汉:华中农业大学,2014:31.
LU Y E.Functional analysis of glutamate synthase genes and cytosolic isocitrate dehydrogenase genes and genome-wide analysis of amino acid transporter gene family in rice [D].Wuhan:Huazhong Agricultural University,2014:31.
[2] RENTSCH D,SCHMIDT S,TEGEDER M.Transporters for uptake and allocation of organic nitrogen compounds in plants [J].FebsLetters,2007,581(12):2281.
[3] 马 清,管 超,夏曾润,等.高等植物氮素转运蛋白研究进展[J].兰州大学学报(自然科学版),2015,51(2):222.
MA Q,GUAN C,XIA Z R,etal.Membrane proteins mediating nitrogen transport in higher plants [J].JournalofLanzhouUniversity(NaturalSciences),2015,51(2):222.
[4] FISCHER W N,ANDR B,RENTSCH D,etal.Plant amino acid transport [J].TrendsinPlantScience,1998,3(5):189.
[5] 宋奇超,曹凤秋,巩元勇,等.高等植物氨基酸吸收与转运及生物学功能的研究进展[J].植物营养与肥料学报,2012,18(6):1509.
SONG Q C,CAO F Q,GONG Y Y,etal.Current research progresses of amino acids uptake transport and their biological roles in higher plants [J].PlantNutritionandFertilizerScience,2012,18(6):1509.
[6] RENTSCH D,HIRNER B,SCHMELZER E,etal.Salt stress-induced proline transporters and salt stress-repressed broad specificity amino acid permeases identified by suppression of a yeast amino acid permease-targeting mutant [J].ThePlantCell,1996,8(8):1437.
[7] OKUMOTO S,KOCH W,TEGEDER M,etal.Root phloem-specific expression of the plasma membrane amino acid proton co-transporter AAP3 [J].JournalofExperimentalBotany,2004,55(406):2155.
[8] HIMER A,LADWIG F,STRANSKY H,etal.ArabidopsisLHT1 is a high-affinity transporter for cellular amino acid uptake in both root epidermis and leaf mesophyll [J].ThePlantCell,2006,18(8):1931.
[9] HAMMES U Z,NIELSEN E,HONAAS L A,etal.AtCAT6,a sink-tissue-localized transporter for essential amino acids inArabidopsis[J].PlantJournal,2006,48(3):415.
[10] WIPF D,LUDEWIG U,TEGEDER M,etal.Conservation of amino acid transporters in fungi,plants and animals [J].TrendsinBiochemicalSciences,2002,27(3):141.
[11] YANG H,POSTEL S,KEMMERLING B,etal.Altered growth and improved resistance ofArabidopsis,against pseudomonas syringae by overexpression of the basic amino acid transporterAtCAT1 [J].PlantCell&Environment,2014,37(6):1404.
[12] YANG H,KREBS M,STIERHOF Y D,etal.Characterization of the putative amino acid transporter genesAtCAT2,3&4:the tonoplast localized AtCAT2 regulates soluble leaf amino acids [J].JournalofPlantPhysiology,2014,171(8):594.
[13] LIU X,BUSH D R.Expression and transcriptional regulation of amino acid transporters in plants [J].AminoAcids,2006,30(2):115.
[14] SU Y H,FROMMER W B,LUDEWIG U.Molecular and functional characterization of a family of amino acid transporters fromArabidopsis[J].PlantPhysiology,2004,136(2):3104.
[15] YANG H,STIERHOF Y D,LUDEWIG U.The putativeCationicAminoAcidTransporter9 is targeted to vesicles and may be involved in plant amino acid homeostasis [J].FrontiersinPlantScience,2015,6:212.
[16] SNOWDEN C J,BENJAMIN T,BAXTER C J,etal.A tonoplast Glu/Asp/GABA exchanger that affects tomato fruit amino acid composition [J].PlantJournal,2015,81(5):651.
[17] 轩红梅,王永华,魏利婷,等.小麦幼苗叶片中硝酸盐转运蛋白NRT1和NRT2家族基因对氮饥饿响应的表达分析[J].麦类作物学报,2014,34(8):1022.
XUAN H M,WANG Y H,WEI L T,etal.Transcription analysis of the genes encoding nitrate transporter NRT1 and NRT2 families in response to nitrogen starvation in wheat seedlings leaves [J].JournalofTriticeaeCrops,2014,34(8):1022.
[18] MARCUSSEN T,SANDVE S R,HEIER L,etal.Ancient hybridizations among the ancestral genomes of bread wheat [J].Science,2014,345(6194):1250092.
[19] LIU Z L,ADAMS K L.Expression partitioning between genes duplicated by polyploidy under abiotic stress and during organ development [J].CurrentBiology,2007,17(19):1669.
[20] HU Z,HAN Z,SONG N,etal.Epigenetic modification contributes to the expression divergence of threeTaEXPA1 homoeologs in hexaploid wheat(Triticumaestivum) [J].NewPhytologist,2013,197(4):1344.
[21] SHITSUKAWA N,TAHIRA C,KASSAI K,etal.Genetic and epigenetic alteration among three homoeologous genes of a classEMADSbox gene in hexaploid wheat [J].ThePlantCell,2007,19(6):1728.
[22] MAYER K F X,ROGERS J,DOLEEL J,etal.A chromsome-based draft sequence of the hexaploid bread wheat(Triticumaestivum) genome [J].Science,2014,345(6194):1251788.
[23] 韩俊杰,王昊龙,李淼淼,等.小麦淀粉合成酶SSⅡa基因克隆及生物学分析[J].麦类作物学报,2015,35(7):908.
HAN J J,WANG H L,LI M M,etal.Cloning and biological analysis of wheatSSⅡagene [J].JournalofTriticeaeCrops,2015,35(7) :908.
[24] 郎丹莹,吕庚寅,梁广旺,等.小麦UROS基因的可变剪接[J].麦类作物学报,2016,36(12):1560.
LANG D Y,LÜ G Y,LIANG G W,etal,Alternative splicing of uroporphyrinogen Ⅲ synthase genes in wheat [J].JournalofTriticeaeCrops,2016,36(12):1560.

