二硝基脲法合成HMX的过程监测及动力学分析
张 乐,王 志,许建新,王建龙,曹端林
(1.中北大学化学工程与技术学院,山西 太原 030051;2.甘肃银光化学工业集团有限公司,甘肃 白银 730900)
引 言
化学反应的热危险性源自多方面因素,其中最主要的是热失控。关于含能材料热安定性的分析评价十分必要,尤其是HMX等高能炸药,在其生产、运输、贮存等过程的热安定性问题是其应用研究的主要问题[1-2]。
国内对含能材料反应过程的热危险性进行了较多研究,多数基于应用过程尤其是合成过程的热危险性研究。罗帅等[3]研究了HMX在丙酮中的热安全性,发现HMX丙酮溶液的临界爆炸温度高于HMX,说明丙酮在HMX分解过程中起到了抑制作用;彭浩梁[4]研究了醋酐法合成HMX工艺的热危险性,结果表明,醋酐法合成HMX的危险度等级为4级,易引发二次分解反应,因此应采取措施避免风险发生;Radhakrishnan S等[5]对中间体DPT进行了研究,测定了其分解温度及感度,结果表明,DPT的起始分解温度为211℃,其对外部刺激钝感。
现有的尿素法合成HMX的工艺仍然存在很大危险性。因此,本研究对二硝基脲法合成HMX反应过程进行了在线监测,研究了其热危险性,并进行了反应动力学分析,以期为应用生产提供理论基础和帮助。
1 实 验
1.1 试剂与仪器
发烟硝酸(质量分数98%)、发烟硫酸(质量分数20%,SO3质量分数为20%)、尿素、甲醛溶液(质量分数37%~40%)、氨水溶液(质量分数25%~28%)、硝酸铵,以上均为分析纯,天津化学试剂公司;去离子水,实验室自制。
全自动反应量热仪(RC1),Mettle-Toledo公司;绝热加速量热仪(ES ARC),英国THT公司。
1.2 实验装置
用绝热加速量热仪(ES ARC)[6-7]对反应中间体二硝基五亚甲基四胺(DPT)进行分解实验测试。样品质量为50mg,样品球质量为8.6222g,样品球材质为钛合金。设置测试起始温度为100℃,终止温度为250℃,加热梯度为5℃,检测灵敏度为0.02℃/min,等待时间为15min。用全自动反应量热仪(RC1)对各步反应进行量热实验测试。
RC1是一种智能控温的反应量热仪,主要由100mL反应釜、电子控制装置、智能温度控制装置和PC软件构成。
1.3 实验过程
用尿素合成HMX的合成路线如下:
本实验采用半间歇等温控温模式,首先将35g质量分数20%的发烟硫酸和32.5g发烟硝酸配制成混酸[8]加入反应器中作为反应底液,在-5~-2℃下加入9g尿素反应60min,测量反应放热,随后在-2~0℃加入52.5mL去离子水水解,取出其中一半液体作为下一步反应的底液,在8℃下加入45g甲醛溶液反应50min,再取其中一半液体放入100mL反应釜中作为底液,加入氨水先将pH值调至1.5,升温至18℃继续滴加氨水进行缩合反应,直至pH值为7,保温30min,过滤、洗涤、干燥得固体DPT[9-10],在反应器中加入70g发烟硝酸作为反应底液,保温在10℃校准,随后加入10.3g硝酸铵,采用RC1通过等温量热法测量反应放热,升温至34℃校准,加入7gDPT,以同样方法测量反应放热。在实验结束后,利用仪器自身所带的软件Icontral5.4对各步反应过程的放热速率曲线分别进行面积积分,可以得到各步反应过程的放热量。
2 结果与讨论
2.1 热力学参数计算
通过RC1可以测量各步反应放热速率曲线[11-12],利用配套的软件Icontral5.4对各步反应过程的放热速率曲线进行面积积分,可以得到反应热ΔrH或者摩尔反应热ΔrHm以及绝热温升ΔTad,由实验得到的反应热数据计算合成反应能达到的最高温度MTSR。
(1)
式中:ΔrHm为摩尔反应热,kJ/mol;m为质量,kg;Cp为物料的比热容,kJ/(kg·K);ΔTad为绝热温升,K;n为反应物的摩尔量,mol。
对于半间歇等温模式反应来说,MTSR是指目标反应失控后积累的热量可使反应体系在绝热条件下所能达到的最高温度,其中每一时刻的理论放热量是在假设匀速加料,从开始加料便产生热量、结束加料热量就完全释放的情况下均匀分配总放热量的结果。热量积累可由每一时刻的理论放热量减去实验中该时刻实际测得的放热量得到。因此应采用限制投料进行计算,可以得到如下公式计算各步反应的热量积累。
(2)
(3)
积累能量:C=A-B
(4)
由式(4)可得到任意t时刻的热积累可导致的绝热温升ΔTad,r,见式(5)。
(5)
式中:Mt为t时刻反应体系的总质量,kg;Cp为t时刻反应体系的比热容,kJ/(kg·K)。由此可得t时刻反应热积累可使反应体系绝热升到的最高温度Tcf,见式(6)。
Tcf=Tp+ΔTab,r
(6)
式中:TP为合成反应的工艺温度,采取等温模式时,即为设定的反应温度。
根据MTSR的定义可以得到:
MTSR=max(Tcf)
(7)
由RC1测得加9g尿素经硝硫混酸硝化得到二硝基脲的反应放热量ΔrH为16.77kJ,绝热温升ΔTad为127.58℃,相同反应进行3次以减小误差,
如表1所示。由式(2)、(3)、(4)作图,尿素硝化为二硝基脲反应过程的热量积累曲线如图1所示。再由式(5)、(6)、(7)计算可以得到MTSR为36.84℃。采用上述方法分别计算不同反应过程的MTSR,可得不同反应过程放热量ΔrH、绝热温升ΔTad和MTSR见表1。
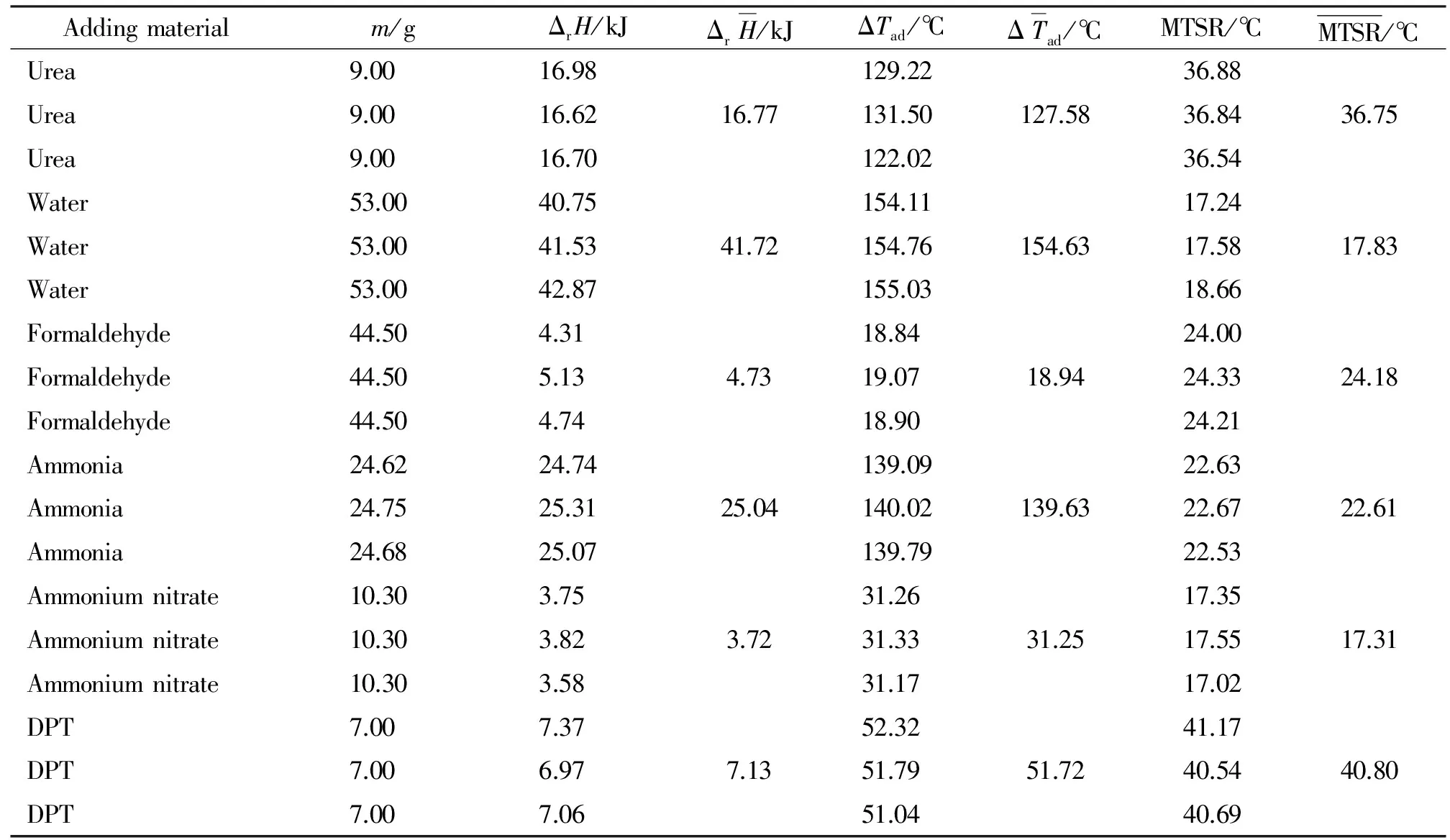
表1 不同反应过程的ΔrH、ΔTad和MTSRTable 1 ΔrH、ΔTad and MTSR in different reaction processes
从表1可以看出,加水过程的放热量ΔrH和绝热温升ΔTad最大,这个热量主要用于稀释混酸。第二次加氨水的放热量ΔrH和绝热温升ΔTad最小,这是因为,与酸的稀释反应和硝化反应相比,缩合反应的放热量较小。加DPT反应过程的MTSR最大,因此比其他过程安全。从图1可以看出,在7580s时,反应过程积累的热量最大,此时刻正是加料结束的时刻。即在反应过程中,加料结束的时刻往往是反应热量积累最多的时刻。因为在加料过程中物料不断积累,热量累积,加料结束时,不再有新的物料加入,但反应仍在继续,消耗原有的物料,热量累积量降低。
2.2 放热速率及严重度
对各步反应放热速率进行在线测量,可得到相应的放热速率(qr)并计算其热转化率(X)。尿素经硝硫混酸硝化的放热速率典型曲线和热转化率曲线如图2所示。
从图2放热速率曲线可以看出,加入尿素2s后,反应体系立即放热,放热速率明显增大,加料结束1s后,放热速率逐渐减小,说明硝化反应进行得很快,在加料完成后有一小段成熟过程,放热速率明显又升高,说明部分反应到达成熟期才完成。
二硝基脲水解的放热速率典型曲线和热转化率曲线如图3所示。
从图3放热速率曲线可以看出,加入水后反应体系立即放热,放热速率明显增大,加料结束后,放热速率逐渐减小,说明放热量主要来源于水稀释硫酸的放热,水解放热量很小。其余各步反应的放热速率曲线与水解反应放热速率相似。
根据表2列出的严重度评估准则可以判断各步反应的严重度[13]。
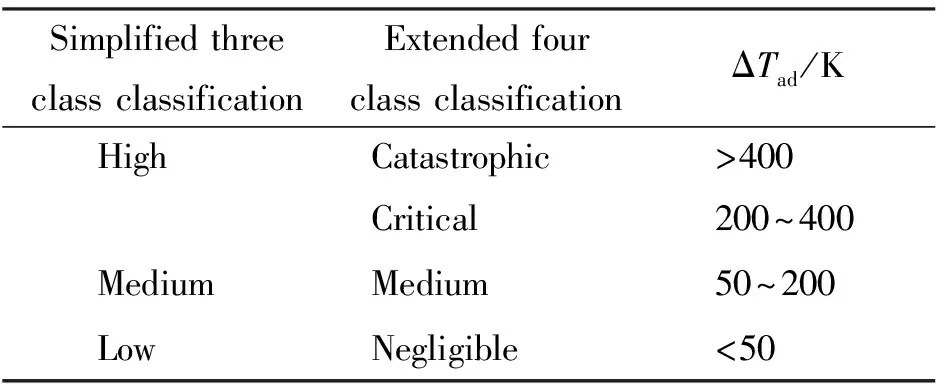
表2 失控反应严重度的评估准则Table 2 Criteria used for the evaluation of uncontrolled response severity
从以上实验所得数据可知,加入甲醛溶液和加入硝酸铵过程的失控严重度为低等,其余各步反应的失控反应严重度都为中等。
2.3 动力学分析
用绝热加速量热仪对反应中间体DPT进行测试,所得曲线如图4所示。
由图4可看出,DPT起始分解温度为145.9℃,起始分解速率为0.087℃/min,最大分解速率温度为147.9℃,最大分解速率为0.22℃/min,终止分解温度为151.3℃。
采用仪器自带分析软件分析数据,得到DPT分解反应的反应级数为0.88,再根据公式(8)、(9)计算其分解反应的活化能Ea和指前因子A。
(8)
(9)
(10)
式中:T1为起始分解温度;T2为分解终止温度;R为气体常数;r为分解速率;TMR为绝热条件下最大反应速率到达时间;TD24为TMR等于24h的温度。
由实验数据计算可得DPT分解的活化能Ea为254kJ/mol,指前因子A为1.26×1030s-1,TD24为136.6℃.
3 结 论
(1)二硝基脲法合成HMX的过程中加入尿素、水、甲醛、氨水、硝酸铵和DPT时的绝热温升ΔTad分别为127.58、154.63、、18.94、139.63、31.25、51.72℃。绝热温升越高,发生失控反应的严重度越高。
(2) 从二硝基脲法合成HMX过程中合成反应的最高温度MTSR来看,加水的过程要在0℃以下进行,加硝酸铵的过程要在10℃以下进行,加尿素的合成反应温度可以较原工艺提高2℃,加DPT反应过程最为安全,合成反应的最高温度MTSR为40.8℃。
(3) 二硝基脲法合成HMX的过程中,加甲醛溶液和加硝酸铵反应过程严重度为低等,其余过程的严重度为中等。
(4) 对中间产物DPT进行动力学分析得到DPT分解的活化能Ea为254kJ/mol,指前因子A为1.26×1030s-1,TD24为136.6℃。
参考文献:
[1] 曹新茂,李福平.奥克托今高能炸药及其应用[M].北京:兵器工业出版社,1993: 218-240.
[2] 边小果,潘葆,高志强,等. 奥克托今炸药在螺压改性双基推进剂中的应用研究[J].含能材料,2004,18(3): 187-190.
BIAN Xiao-guo, PAN Bao, GAO Zhi-qiang, et al. Application research of octogen explosives in screw extrusion composite modefied double base propellant[J]. Chinese Journal of Energetic Material, 2004, 18(3): 187-190.
[3] 罗帅,曹雄,侯向军,等. 奥克托今在丙酮中的热安全性研究[J].中国安全科学学报,2015, 19(3): 66-70.
LUO Shuai, CAO Xiong, HOU Xiang-jun, et al. Research on thermal safety of HMX in acetone[J]. China Safety Science Journal, 2015, 19(3): 66-70.
[4] 彭浩梁. 醋酐法合成奥克托今工艺的热危险性研究[D].南京:南京理工大学,2016.
PENG Hao-liang. Process safety assessment for the synthesis of HMX by acetic anhydride method[D]. Nanjing: Nanjing University of Science and Technology,2016.
[5] Radhakrishnan S, Talawar M B, Venugopalan S, et al. Synthesis, characterization and thermolysis studies on 3,7-dinitro-1,3,5,7-tetraazabicyclo [3,3,1] nonane (DPT): a key precursor in the synthesis of most powerful benchmark energetic materials(RDX/HMX) of today[J]. Journal of Hazardous Materials, 2008, 152(3): 1317-1324.
[6] 朱鹏,刘惠平,周波,等. 过氧化环己酮的热稳定性研究[J].上海应用技术学院学报,2011, 4(11): 330-334.
ZHU Peng, LIU Hui-ping, ZHOU Bo, et al. An investigation on the thermal stability of cyclohexanone peroxide[J]. Journal of Shanghai Institute of Technology, 2011, 4(11): 330-334.
[7] 庄众. 醋酸酐水解反应热失控危险性研究[D].南京:南京理工大学,2009.
ZHUANG Zhong. Study on risk of heat controlled by hydrolysis of acetic acid[D]. Nanjing: Nanjing University of Science and Technology, 2009.
[8] 杨建明,余秦伟,薛云娜,等. 二硝基脲的合成、表征及热力学的理论研究[J].含能材料,2011, 19(2): 160-164.
YANG Jian-ming, YU Qin-wei, XUE Yun-na, et al. Synthesis characterization and theoretical research of thermodynamics on dinirourea[J]. Chinese Journal of Energetic Material, 2011, 19(2): 160-164.
[9] 王鹏,宋红燕,孟子晖,等. 一锅法合成二硝基五亚甲基四胺工艺研究[J].北京理工大学学报,2011, 31(5): 603-605.
WANG Peng, SONG Hong-yan, MENG Zi-hui, et al. Reaction process of synthesizing dinitro pentamethylene tetttramine by one-pot mnthod[J]. Transactions of Beijing Institute of Technology, 2011, 31(5): 603-605.
[10] 宋红燕,王鹏,覃光明,等. 一锅法合成二硝基五亚甲基四胺反应机理的研究[J].有机化学,2010, 30: 414-418.
SONG Hong-yan, WANG Peng, QIN Guang-ming, et al. Reaction mechanism of one-pot synthesis of dinitro pentamethylene tetramine[J]. Chinese Journal of Organic Chemistry, 2010, 30: 414-418.
[11] 程春生,秦福涛,魏振云,等. 氟吗啉合成工艺热危险性及动力学研究[J].化学学报,2012, 70: 1227-1231.
CHENG Chun-sheng, QIN Fu-tao, WEI Zhen-yun, et al. Thermal hazard and kinetic study for synthesis process of flumorph[J]. Acta Chimica Sinica, 2012, 70: 1227-1231.
[12] 高宇鹏,陈丽珍,王建龙,等. 反应量热仪在线探究硝酸硝解乌洛托品反应过程[J]. 科学技术与工程,2007, 17(17): 288-291.
GAO Yu-peng, CHEN Li-zhen, WANG Jian-long, et al. The exploration of the reaction process of nitrifying methenamine by reaction calorimeter[J]. Science Technology and Engineering, 2017,17(17): 288-291.
[13] 陈网桦,陈利平,李春光,等. 苯和甲苯硝化及磺化反应热危险性分级研究[J].中国安全科学学报,2010, 20(5): 67-73.
CHEN Wang-hua, CHEN Li-ping, LI Chun-guang, et al. Classification investigation on thermal hazards in nitration and sulfonation reactions of benzene and toluene[J]. China Safety Science Journal, 2010, 20(5): 67-73.

