VM、Leptin、VEGF对子宫内膜癌的诊断评价
李美艳,韩新彦,陈永学,牛广旭
(1邯郸市中心医院妇一科,邯郸 056008;2邯郸市中心医院麻醉科;3邯郸市中心医院病理科;*通讯作者,E-mail:everlasting321@163.com)
子宫内膜癌(endometrial carcinoma,EC)是女性生殖道最常见恶性肿瘤之一,已对女性健康造成极大威胁[1]。血管生成拟态(vasculogenic mimicry,VM)作为全新肿瘤血管结构被证实在多种恶性肿瘤中存在[2,3]。瘦素(Leptin)是重要的脂肪因子,与EC发生密切相关[4]。血管内皮生长因子(vascular endothelial growth factor,VEGF)可促进内皮细胞的活化与迁移,是一重要促血管生成蛋白[5]。VM、Leptin、VEGF均与EC等肿瘤的侵袭性密切相关,本研究旨在探讨三者单独及联合检测对EC的诊断价值。
1 材料与方法
1.1 临床资料
选取我院2012-01~2013-11期间诊治的患者345例为研究对象:经病理检查为EC的患者197例、不典型增生患者85例、正常子宫内膜患者63例,其中EC患者年龄范围24-72岁,平均年龄(50.19±9.54)岁。197例EC患者按照平均年龄50.19岁四舍五入为50岁分组:≥50岁104例,<50岁93例;根据国际妇产科联盟(FIGO 2009)手术-病理分期标准:Ⅰ-Ⅱ期170例,Ⅲ-Ⅳ期27例;组织学分化:高-中分化144例,低分化53例;肌层浸润深度:≥1/2肌层51例,<1/2肌层146例;组织学类型:Ⅰ型155例,Ⅱ型42例;术后证实是否有淋巴结转移:有转移25例,无转移172例。实验用标本均来自于诊刮及手术切除子宫的内膜标本,所有病例术前均未接受过放化疗,未用过激素类药物,排除有心、脑、肾重要器官功能障碍、凝血系统障碍、出血疾病者,EC患者均为初次手术且肿瘤均为原发。由2名高年资病理医生复习病理切片,并选取包含肿瘤组织及非癌的内膜组织的石蜡标本备用。
1.2 实验方法和结果判定
采用CD34-PAS双重染色法,检测各内膜组织中VM的表达;免疫组织化学SP法检测Leptin和VEGF蛋白的表达情况。各实验步骤均严格按相应试剂的说明书进行操作。CD34-PAS双染色步骤参见文献[6],存在VM结构的判定标准:由CD34染色结果阴性的肿瘤细胞构成管腔样结构,PAS阳性物质(紫红色)衬附其周围,且未见CD34阳性的内皮细胞,部分管腔内可见红细胞,即VM结构阳性标志为CD34-/PAS+[7]。免疫组化SP法步骤和判定评分标准参见文献[8],Leptin蛋白阳性细胞染色为细胞质中出现棕黄色或黄色颗粒;VEGF蛋白阳性染色大多数定位于癌细胞胞浆或胞膜中,阳性着色呈淡黄色至棕黄色颗粒。
试剂:PAS染色试剂盒购自美国Sigma公司,大鼠抗小鼠CD34抗体购自美国Santa Cruz公司,兔抗体Leptin多克隆抗体购自北京中山生物技术有限公司,鼠抗人VEGF单克隆抗体、免疫组织化学SP试剂盒、PBS缓冲液、DAB试剂盒均购自福州迈新生物技术公司。
1.3 诊断效能评价指标
EC的诊断效能评价指标采用灵敏度、特异度、阳性预测值、阴性预测值、准确度和约登指数表示(%),所用计算公式[9]如下:
灵敏度=真阳性例数/(真阳性例数+假阴性例数)×100%
特异度=真阴性例数/(真阴性例数+假阳性例数)×100%
阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%
阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%
准确度=(真阳性例数+真阴性例数)/(参加测试总例数)×100%
约登指数=(灵敏度+特异度-1)×100%
1.4 统计学处理
采用统计软件IBM SPSS StatisticsVersion 19.0对数据进行计算处理,各计数资料以率表示,组间比较采用χ2检验,用Pearson法和连续校正公式来计算。采用列联系数进行VM、Leptin、VEGF三者之间的相关性分析。各检验均以P<0.05为差异有统计学意义的检验标准。
2 结果
2.1 VM、Leptin、VEGF及其联合在各组内膜组织中表达的比较
本实验应用CD34-PAS双重染色和免疫组化SP法,检测VM结构和Leptin、VEGF蛋白单项检测、两两配对检测及三者联合检测均为同一切片标本,在各组中的表达情况见表1。染色结果提示,CD34-PAS双重染色:VM阳性78例,阴性119例;Leptin阳性155例,阴性42例;VEGF阳性134例,阴性63例。典型染色图见图1-3。其中,EC癌组的各蛋白及组合的阳性表达率均明显高于癌前病变组及正常对照组,差异均有统计学意义(均P<0.05)。
表1VM、Leptin、VEGF及其联合在各组中阳性率比较例(%)
Table1ComparisonofpositiveratesofVM,Leptin,VEGFandtheircombinationsamongthreegroupscases(%)

组别nVMLeptinVEGFVM+LeptinVM+VEGFLeptin+VEGFVM+Leptin+VEGF正常对照组631(1.59)6(9.52)3(4.76) 7(11.11)4(6.35) 8(12.70) 9(14.29)不典型增生组854(4.71)28(32.94)18(21.18)28(32.94)20(23.53)28(32.94)28(32.94)癌组19778(39.59)155(78.68) 134(68.02) 159(80.71) 149(75.63) 161(81.73) 167(84.77) χ2*60.668105.87398.976111.805119.347113.675124.936 P0.0000.0000.0000.0000.000.0000.000
*Pearson法或连续校正公式进行癌组与非癌组比较的卡方值
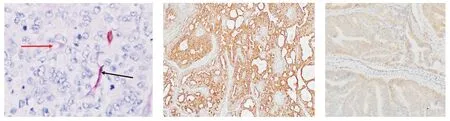
红色箭头指向部分即为VM管腔结构;黑色箭头指向部分即为正常血管图1 VM在子宫内膜癌中CD34-PAS双重染色 (×400)Figure 1 CD34-PAS double staining of VM in endometrial carcinoma (×400)图2 Leptin蛋白在低分化子宫内膜癌中的表达 (SP,×200)Figure 2 Expression of Leptin protein in poorly differentiated endometrial carcinoma (SP,×200)图3 VEGF蛋白在低分化子宫内膜癌中的表达 (SP,×200)Figure 3 Expression of VEGF protein in poorly differentiat-ed endometrial carcinoma (SP,×200)
2.2 VM、Leptin及VEGF与EC临床病理特征的关系
197例EC组织中VM、Leptin及VEGF蛋白在各临床病理参数分组中的表达情况见表2。VM结构和Leptin、VEGF蛋白表达均与手术病理分期、组织学分化有关(均P<0.05);VM和Leptin表达还与淋巴结转移有关(均P<0.05);VM、Leptin及VEGF蛋白在其他组(年龄、肌层浸润深度、组织学类型)中差异无统计学意义(P>0.05,见表2)。
2.3 VM、Leptin和VEGF在EC中的相关关系
应用列联系数对VM、Leptin、VEGF蛋白三者在EC中表达情况进行相关性分析,结果显示VM与VEGF蛋白表达呈正相关(r=0.286,P=0.001,见表3);Leptin与VEGF表达呈正相关(r=0.649,P=0.000,见表4);VM与Leptin呈正相关(r=0.435,P=0.000,见表5)。三者均呈正相关关系,表明三者在EC的发生、发展中具有明显的正向协同效应。
2.4 单独或联合检测VM、Leptin和VEGF对EC诊断效力分析
以术后病理诊断为金标准,VM、Leptin和VEGF蛋白单独检测中阳(阴)性即为检测阳(阴)性,两两联合或三者联合检测中任一项为阳性即视为检测阳性,两两配对检测中两者均为阴性或三者联合检测中三者均为阴性视为检测阴性,诊断效力分析结果见表6。
3 讨论
目前EC诊断检查方法主要有超声检查、诊断性刮宫组织病理学检查和宫腔镜检查,但超声检查的漏诊率偏高;诊断性刮宫病理检查,因为是盲刮,对于早期病变,或者位置位于两侧宫角者,容易漏诊;宫腔镜检查易受出血、穿孔等不定因素影响。寻求更为敏感和特异的肿瘤标志物和恰当的检测方式,对提高EC的诊断率将有重要意义。
3.1 VM结构与肿瘤
经典观点认为只有内皮细胞才能形成血管,但VM作为除血管外供应肿瘤生长的重要结构,在多种肿瘤的进展、转移中均发挥着重要作用,VM这一肿瘤内管状网络模式,可能为抗肿瘤血管治疗提供新的思路[10,11]。
表2VM、Leptin、VEGF与EC临床病理特征的关系例(%)
Table2RelationshipbetweenVM,Leptin,VEGFandclinicopathologicalfeaturesofendometrialcarcinomacases(%)

临床病理特征nVM结构Leptin表达VEGF表达阳性χ2P阳性χ2P阳性χ2P年龄0.0580.8100.0830.7730.7040.402 ≥50岁10442(40.38)81(77.88)68(65.38) <50岁9336(38.71)74(79.57)66(70.97)手术-病理分期7.1440.0085.7880.01611.5000.001 Ⅰ-Ⅱ17061(35.88)129(75.88)108(63.53) Ⅲ-Ⅳ2717(62.96)26(96.30)26(96.30)组织学分化90.8600.00016.3230.0005.7300.017 高-中14428(19.44)103(71.53)91(63.19) 低5350(94.34)52(98.11)43(81.13)肌层浸润深度3.7300.0530.1200.7290.0120.914 ≥1/25126(50.98)41(80.39)35(68.63) <1/214652(35.62)114(78.08)99(67.81)组织学类型0.2380.6260.1970.6570.3420.559 Ⅰ型15560(38.71)123(79.35)107(69.03) Ⅱ型4218(42.86)32(76.19)27(64.29)淋巴结转移9.6600.0025.1210.0240.2080.648 有2517(68.00)24(96.00)18(72.00) 无17261(35.47)131(76.16)116(67.44)
表3EC中VM表达和VEGF蛋白的关系
Table3RelationshipbetweenVMexpressionandVEGFproteininendometrialcarcinoma
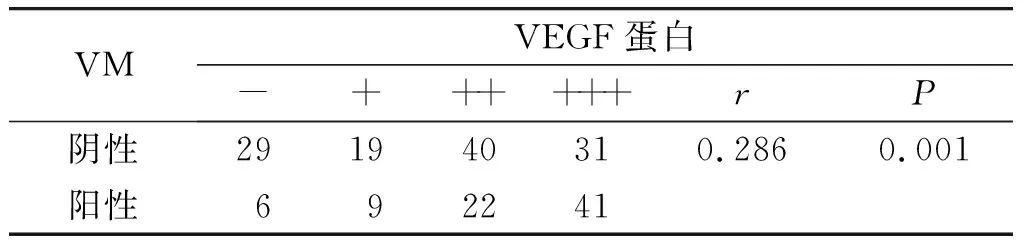
VMVEGF蛋白-++++++rP阴性291940310.2860.001阳性692241
表4EC中Leptin和VEGF蛋白表达的关系
Table4RelationshipbetweenLeptinandVEGFproteinexpressioninendometrialcarcinoma
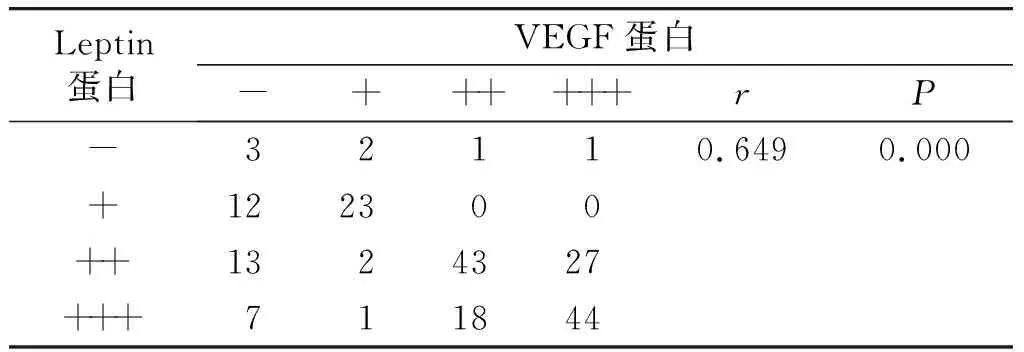
Leptin蛋白VEGF蛋白-++++++rP-32110.6490.000+122300++1324327+++711844
表5EC中VM表达和Leptin的关系
Table5RelationshipbetweenVMexpressionandLeptininendometrialcarcinoma
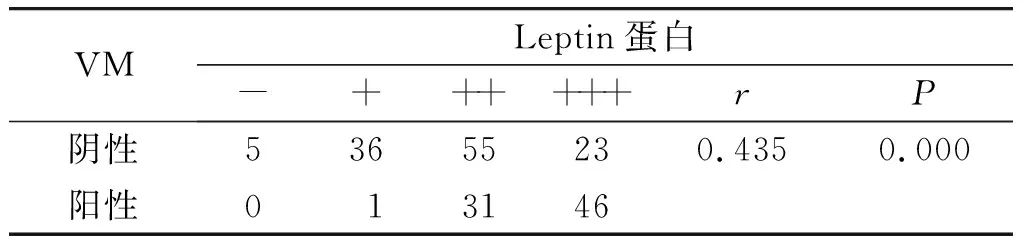
VMLeptin蛋白-++++++rP阴性53655230.4350.000阳性013146
VM是一种不依赖于内皮细胞的肿瘤新生血管,是近年来肿瘤血管的研究热点[12],拥有VM的恶性肿瘤,更易复发转移、生存率低[6]。梁军等[13]指出,VM模拟内皮细胞形成的管状结构,血液在该结构内流动,为肿瘤的持续生长及转移提供营养支持。为更好阻止肿瘤血供,必须对VM与肿瘤血管生成进行联合治疗,才能起到良好疗效[14]。本研究中VM结构染色结果显示,197例EC组织中,VM结构阳性(VM+)78例(39.59%),VM阴性(VM-)119例(60.41%),EC组织中有78例存在符合标准的通道结构,而在不典型增生子宫内膜和正常子宫内膜中分别仅为4.71%和1.59%,说明EC中存在VM现象,EC组VM存在的概率显著增高,在EC组较其他组差异有统计学意义(χ2=60.668,P<0.05),这与陈纯等[11]研究结果一致。
表6VM、Leptin、VEGF蛋白及其联合检测的诊断效能比较(%)
Table6ComparisonofdiagnosticefficiencyofVM,LeptinandVEGFproteinsandtheircombineddetectionforEC(%)
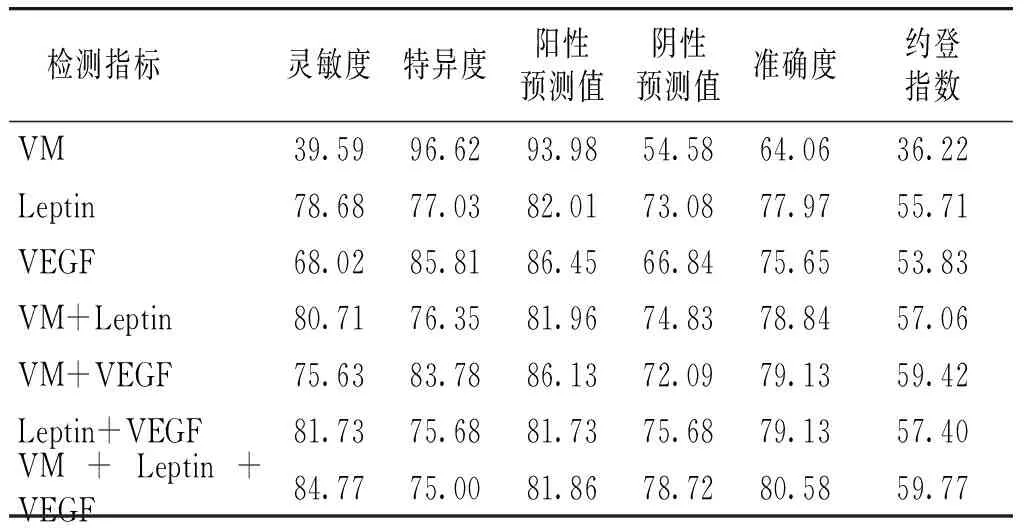
检测指标灵敏度特异度阳性预测值阴性预测值准确度约登指数VM39.5996.6293.9854.5864.0636.22Leptin78.6877.0382.0173.0877.9755.71VEGF68.0285.8186.4566.8475.6553.83VM+Leptin80.7176.3581.9674.8378.8457.06VM+VEGF75.6383.7886.1372.0979.1359.42Leptin+VEGF81.7375.6881.7375.6879.1357.40VM+Leptin+VEGF84.7775.0081.8678.7280.5859.77
陈纯等[11]研究表明,口腔鳞癌中存在VM,并与肿瘤临床分期及有无淋巴结转移密切相关。王龙等[15]指出,在食管鳞状上皮癌中VM的表达与淋巴结转移有关。梁军等[10]研究指出,VM的形成与EC患者年龄、组织类型无关,与分期、组织学分级、肌层浸润深度及淋巴结是否转移密切相关。有VM的EC患者具有更高的恶性程度、侵袭性和转移能力。本研究采用免疫组织化学和CD34-PAS双重染色技术从蛋白质水平研究VM结构,结果显示,EC组织中有78例存在符合标准的通道结构,证实了EC中存在VM。EC组织中VM的形成与患者的年龄、肌层浸润深度及组织学类型均无关,而与EC手术病理分期、组织学分化及淋巴结转移均密切相关,差异有统计学意义(均P<0.05)。提示,具有VM的EC恶性程度高易发生转移,随着较晚的手术病理分期、较差的组织学分化和淋巴结转移,VM存在的概率显著增高(P<0.05)。组织学分化程度越低及恶性程度越高的EC形成VM的能力越强,越易发生转移,恶性度越高,这与陈纯等[11]的研究结果相一致,提示VM可能会成为诊断EC的重要指标之一。
3.2 Leptin蛋白与肿瘤
Leptin是一种分泌型蛋白质,是第1个被发现的脂肪细胞分泌的激素,Leptin作为肥胖基因编码的产物,已证实在促进细胞增殖和血管生成等方面具有重要作用,与妇科肿瘤、前列腺癌、胃癌等多种肿瘤的发生相关[16]。临床流行病学研究发现,Leptin通过多种机制参与EC细胞的形成,高Leptin水平和EC发病风险密切相关[4],Leptin在卵巢癌、乳腺癌等恶性肿瘤中均表达异常[17],Zhang等[18]对80例EC和50例正常子宫内膜组织标本研究发现,EC中Leptin的阳性表达明显较高。
本研究中Leptin蛋白染色结果显示,197例EC组织中,Leptin阳性155例(78.68%),Leptin阴性42例(21.32%),而在不典型增生子宫内膜和正常子宫内膜中分别仅为32.94%和9.52%,说明EC中Leptin蛋白表达阳性的比率显著增高,EC组较其他组差异有统计学意义(χ2=105.873,P<0.05)。这提示高Leptin表达水平可能促进EC的发生发展,Leptin可能促进肿瘤增殖和抑制细胞凋亡,Leptin的检测可能成为临床预测EC的一个指标,有可能作为区分良恶性子宫内膜组织的标志。以往资料,Yuan等[19]通过免疫组化方法分析宫颈鳞状细胞癌标本资料,Leptin的阳性表达率约75%;林世龙等[20]表明,在低级别、高级别膀胱癌中,Leptin的阳性表达率分别约44%,76%;范晓琳等[16]报道,胃癌组织和癌旁组织中Leptin的表达阳性率分别约81%,59%,均与本研究一致。
范晓琳等[16]报道,Leptin在胃癌组织中的表达与肿瘤的临床分期、浸润深度、淋巴结转移有关,而与肿瘤位置、性别、体质量指数、肿瘤分化程度无关。林世龙等[20]研究显示,Leptin的表达与膀胱癌的组织学分级有关。国外资料Zhang等[18]对EC和正常子宫内膜组织标本研究发现,EC中Leptin的阳性表达与EC的恶性程度、侵袭性、转移性相关。本研究结果显示,EC组织中Leptin的高表达与患者的年龄、肌层浸润深度及组织学类型均无关,而与EC患者的手术-病理分期、组织学分化程度和淋巴结转移均密切相关,差异有统计学意义(均P<0.05)。表明,有淋巴结转移者Leptin的表达阳性率高于无淋巴结转移者;Leptin的表达与EC恶性程度有关,Leptin蛋白高表达的EC恶性程度高易发生转移;Leptin阳性表达会随着EC的期别上升而增高,而且组织学分化程度越差,Leptin阳性表达将越高。提示,Leptin阳性表达与EC病情进展有紧密联系,这与范晓琳等[16]、林世龙等[20]的研究结果相一致,提示Leptin可能参与了EC的侵袭和迁移过程。
3.3 VEGF蛋白与肿瘤
VEGF能调节肿瘤的血管生成、生长、转移和侵袭[21],已成为目前在肿瘤血管生成中作用最强的血管生成诱导因子[14]。近期,王淑贞等[22]研究发现,EC组织中VEGF表达明显高于子宫内膜不典型增生、正常子宫内膜患者。说明,VEGF表达与EC有着密切联系,VEGF能刺激肿瘤血管生长,增加血管通透[22]。本实验VEGF蛋白表达检测结果显示,197例EC患者中VEGF表达阳性(VEGF+)134例(68.02%),阴性(VEGF-)63例(31.98%),而在不典型增生子宫内膜和正常子宫内膜中分别仅为21.18%和4.76%,VEGF在EC组较其他组表达差异有统计学意义(χ2=98.976,P<0.05),提示VEGF的高表达和EC的形成发展过程密切相关。VEGF可能是通过促进内皮细胞的分化,调控血管的生成,从而促进肿瘤形成与发展[23],这预示着EC组织中VEGF的高侵袭性及易转移性,这与王淑贞等[22]的研究结果相一致。
王龙等[15]结果显示,VEGF的表达与食管癌的临床分期有关。王淑贞等[22]研究同样证实,VEGF阳性表达率在不同临床分期中的差异有统计学意义,与年龄和淋巴结转移无相关性。本研究结果显示,EC组织中VEGF的高表达与患者的年龄、肌层浸润深度、组织学类型及淋巴结转移均无关,而与EC患者的手术-病理分期、组织学分化程度均密切相关,差异有统计学意义(均P<0.05)。说明,VEGF阳性表达会随着EC的临床分期增加而增高,会随肿瘤恶性程度的增高而增强,VEGF表达与EC病情进展有着紧密的联系,可能成为判断EC预后的指标,这与王淑贞等[22]的研究结果大体一致,但组织学分化因素的不太一致,这可能由于本研究病例数相对较少,有必要在以后的诊断治疗过程中收集更多的病例,展开更深入的研究。
3.4 EC中VM、Leptin和VEGF蛋白三者之间的相关关系
国内廖丹等[14]研究发现,VEGF在EC中的VM形成过程中发挥着重要调节作用。刘林枝等[4]报道,Leptin参与EC的细胞增殖、血管生成、凋亡抑制等过程,Leptin发挥类似于生长因子的作用。范晓琳等[16]也指出,Leptin是血管生成的刺激因子,可通过促进血管内皮细胞的分裂增殖促进新生血管形成。和倩倩等[24]研究也显示,在血管内皮细胞上存在Leptin受体,Leptin可直接或间接作用于其受体,促进血管内皮细胞增殖或上调VEGF表达,最终促进血管生成。国外,Misztal-Dethloff等[25]的研究表明,Leptin通过VEGF等内源性血管内皮刺激因子促进血管生成。本研究VM、Leptin、VEGF蛋白的相关性结果显示,VEGF阳性表达情况与VM结构阳性呈正相关,存在VM的EC中VEGF表达水平更高。Leptin与VEGF蛋白阳性表达呈正相关;VM与Leptin呈正相关,VM结构阳性、Leptin蛋白高表达、VEGF蛋白高表达的病例具有更高的临床分期和更差的组织学分化,也更易发生淋巴结转移,这与上述报道相一致。存在VM结构的EC侵袭性和转移能力更强,Leptin蛋白及VEGF蛋白能较好地诱导血管新生,与EC病情进展联系紧密,提示三者可能在EC的发生、发展过程中起重要作用,参与了EC肿瘤的增殖,可作为EC诊断的标志物,有望为寻求EC肿瘤检测排查的新方法提供理论依据。
3.5 VM、Leptin和VEGF蛋白对EC的诊断
曹庆生等[26]在研究中指出,免疫组化染色方法能够明显提高术中肿瘤诊断准确率,具有准确率高、快速、简便、经济等优势,可解决癌症患者诊断困难,误诊、漏诊率高的问题,适合推广。龚圣勇等[27]研究表明,多种免疫标志物联合检测是提高病理诊断准确性的有效方法。本文研究了VM、Leptin和VEGF蛋白单项、两两配对及三项联合检测对EC的诊断价值,结果显示,各蛋白进行单项检测时,Leptin的灵敏度(78.68%)高于VEGF(68.02%)和VM(39.59%),Leptin较其他肿瘤标志物具有较强的优势。进一步两两联合分别检测,观察灵敏度、准确度和约登指数:VM+Leptin(80.71%,78.84%,57.06%)、VM+VEGF(75.63%,79.13%,59.42%)、Leptin+VEGF(81.73%,79.13%,57.40%),较单项检测灵敏度、准确度及约登指数均有明显升高。VM+Leptin+VEGF三指标联合检测时诊断效能达到本实验观察组最高:灵敏度84.77%,特异度75.00%,准确度80.58%,约登指数59.77%,除特异度略有下降外灵敏度、准确度和约登指数均高于各单项及两两配对EC检测的诊断效能,表明三者联合检测在EC诊断中更有优势。可见,诊断EC的效力方面三项指标联合检测优于单项及两两配对检测,可提高EC的诊断准确性,且有助于判断EC患者严重程度。VM、Leptin和VEGF蛋白的联合检测能更有效地鉴别子宫内膜良恶性肿瘤,尤其是在EC的早期诊断筛查、术前评估及术后监测方面。三者具有一致性、协同性和互补性,可作为EC术后随诊监测重要指标。
VM、Leptin和VEGF蛋白的表达各自独立,各肿瘤标记物单独检测诊断EC的效力均是有限的,联合检测三者较各自单独检测能获得更多的信息,一方面可以支持EC诊断,弥补单项指标检测的不足与局限;另一方面可筛选出更敏感的肿瘤标志物,进行动态监测,在判断疗效和提示复发方面有积极作用。基于此进行下步设想,EC术中可在观察冰冻切片的同时进行VM、Leptin和VEGF蛋白相关染色检测,操作流程参照[26]方法,镜下观察并与术后常规切片的免疫组化结果对比,以期联合检测为术中EC的诊断提供准确、快速、简便的实验方法。
概言之,VM、Leptin和VEGF蛋白的检测均可用于EC的辅助诊断和辅助评估EC患者病情,三者在肿瘤侵袭及转移过程中存在相关及正向协同作用,三者均对EC具有重要作用,是肿瘤发展中较为重要的生物学蛋白及因子,可为肿瘤诊断及治疗提供依据。三者联合检测对有效地鉴别子宫内膜良恶性肿瘤和提高EC的早期诊断均具有重要临床价值和意义,有可能成为EC临床诊断和预测的参考指标之一。
参考文献:
[1] 顾胜蓝,王玉东.子宫内膜癌免疫逃逸的研究进展[J].中国妇产科临床杂志,2018,19(1):85-86.
[2] Qi L, Song W, Liu Z,etal. Wnt3a promotes the vasculogenic mimicry formation of colon cancer via Wnt/β-Catenin signaling[J]. Int J Mol Sci,2015, 16(8):18564-18579.
[3] 孙清华,尹格平,陈铭,等.子宫内膜癌中血管生成拟态及基质金属蛋白酶-2表达情况研究[J].中华妇幼临床医学杂志:电子版,2016,12(1):29-34.
[4] 刘林枝,王小慧,尚晨光,等.瘦素及瘦素受体与子宫内膜癌的相关性研究进展[J].现代妇产科进展,2017,26(9):704-706.
[5] 贾志凌,杨永昌,张淑艳,等.血管内皮生长因子诊断多种恶性肿瘤临床价值[J].中华实用诊断与治疗杂志,2015,29(7):701-705.
[6] 高赛楠,张玉泉,苏敏,等.CGB5对卵巢癌OVCAR-3细胞血管生成拟态形成的影响[J].肿瘤防治研究,2016,43(9):733-737.
[7] Gong L, Zhang W, Zhou J,etal. Prognostic value of HIFs expression in head and neck cancer: a systematic review[J]. PLoS One, 2013, 8(9): e75094.
[8] 李美艳.HE4、OPN及uPA检测对子宫内膜癌患者诊断的临床意义[J].国际肿瘤学杂志,2017,44(5):351-355.
[9] 郝长宏,田永会,刘正玲,等.子宫内膜异位症患者血清CA125、HE4、EMAb的表达及其临床意义[J].实用妇产科杂志,2014,30(11):855-857.
[10] 梁军,苗蕊,邢慧敏.血管生成拟态在子宫内膜癌组织中的表达及意义[J].中国肿瘤临床,2015,42(23):1124-1127.
[11] 陈纯,赵小朋,吴宇翎,等.舌鳞状细胞癌上皮-间质转化与血管生成拟态的关系及意义[J].中华口腔医学研究杂志:电子版,2016,10(3):161-165.
[12] 周芳芳,陈冰.食管鳞癌组织中Slug、Vimentin、E-cadherin与血管生成拟态的表达及意义[J].山西医科大学学报,2017,48(2):144-148.
[13] 梁军,杨波,吴小华.肿瘤干细胞标志物CD117在上皮性卵巢癌血管生成拟态中的表达及意义[J].肿瘤,2016,36(1):70-76.
[14] 廖丹,邓亚丽,禹正扬,等.子宫内膜癌血管生成拟态与VEGF、COX-2表达的意义[J].临床和实验医学杂志,2015,14(17):1418-1421.
[15] 王龙,戴天阳.VEGF和VM对食管鳞状上皮癌血液供应的影响及临床意义[J].重庆医学,2014,43(11):1380-1382.
[16] 范晓琳,张鹏飞,王静,等.瘦素系统在胃癌组织表达及与临床病理特征关系[J].青岛大学医学院学报,2016,52(2):223-225.
[17] El-Masry OS,Al-Sakkaf K,Brown BL,etal. Differential crosstalk between the AMPK and PI3K/Akt pathways in breast cancer cells of differing genotypes: Leptin inhibits the effectiveness of AMPK activation[J]. Oncol Rep,2015,34(4): 1675-1680.
[18] Zhang Y, Liu L, Li C,etal. Correlation analysis between the expressions of leptin and its receptor (ObR) and clinicopathology in endometrial cancer[J]. Cancer Biomark,2014,14(5):353-359.
[19] Yuan Y, Zhang J, Cai L, e t al. Leptin induces cell proliferation and reduces cell apoptosis by activating c-myc in cervical cancer[J]. Oncol Reports, 2013, 25(6): 90-94.
[20] 林世龙,杨国良,张连华,等.瘦素在非肌层浸润性膀胱癌中的表达及其意义[J].肿瘤学杂志,2014,20(2):131-134.
[21] 米小芳,姜霞,郑绘霞,等.RACK1和VEGF蛋白在非小细胞肺癌中的表达及意义[J].山西医科大学学报,2017,48(5):458-461.
[22] 王淑贞,王秋红.HIF-1α和VEGF在子宫内膜癌中的临床表达及相关性[J].实用癌症杂志,2017,32(4):536-538.
[23] 王玎,李志英,罗飞,等.子宫内膜癌患者组织中COX-2蛋白及VEGF的表达及临床意义[J].中国老年学杂志,2016,36(10):2418-2420.
[24] 和倩倩,石琨.脂肪因子与子宫内膜癌的研究进展[J].中华实用诊断与治疗杂志,2014,28(5):428-430.
[25] Misztal-Dethloff B, Stepien H, Komorowski J. Effect of leptin on proliferative activity and vascular endothelial growth factor (VEGF) secretion from cultured endothelial cells HECa10 in vitro[J]. Endocr Regul, 2004, 38(4): 161-166.
[26] 曹庆生,杨宝友,李志超.联合检测CT、CEA对术中诊断甲状腺髓样癌的意义[J].现代肿瘤医学,2016,24(1):36-39.
[27] 龚圣勇,肖阳,宋芳,等.Galectin-3、CK19、CD56和TPO联合检测鉴别甲状腺乳头状癌与良性乳头状增生[J].中国组织化学与细胞化学杂志,2015,24(5):388-392.

