长链非编码RNA XIST在神经胶质瘤中的表达和临床意义
宋 千,庞宏刚,祁 磊,梁 晨,王 拓,王 伟,郭世文*
(1西安交通大学第一附属医院神经外科,西安 710061;2西安交通大学第一附属医院周围血管科;*通讯作者,E-mail:gsw1962@126.com)
神经胶质瘤是中枢神经系统最常见的恶性肿瘤,约占神经系统肿瘤的45%,颅内恶性肿瘤的80%[1,2]。神经胶质瘤细胞呈浸润性生长、具有极强的侵袭性,且生长迅速,患者病情进展迅速。尽管临床上采用手术切除联合放、化疗可在短期内改善患者症状,但术后肿瘤极易复发,患者死亡率高、预后较差[3-5]。近年来,针对神经胶质瘤相关基因的研究成为目前研究的热点。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度超过200个核苷酸的非编码RNA,虽然lncRNA并不能编码蛋白质,但越来越多的研究发现,lncRNA在多种疾病的发生发展过程中均发挥了重要的调控作用[6]。近年来,在肿瘤相关的研究中表明多种lncRNA通过不同的途径调节促癌基因或抑癌基因的功能,从而参与肿瘤的增殖、凋亡、侵袭以及迁移等生物进程[7,8]。XIST作为长链非编码RNA的一种,其在肿瘤调控中的作用受到了研究者的关注。有研究证实,XIST通过靶向microRNA-137在人脑胶质瘤中发挥致癌作用[9]。国内学者证实,沉默XIST能够通过靶向microRNA-185抑制胶质瘤U87细胞增殖,从而发挥抑癌作用[10]。但XIST的表达水平与胶质瘤患者的临床病理特征以及预后的关系尚无文献报道,因此,本课题组通过检测不同级别胶质瘤组织中XIST的表达水平,探讨其与胶质瘤患者临床病理特征和预后的相关性以及作为肿瘤标志物的可能性,从而为胶质瘤的早期诊断及其治疗提供新的靶点。
1 资料与方法
1.1 一般资料
本研究选取西安交通大学第一附属医院2010-01~2012-11期间收住院并行手术切除的64例神经胶质瘤患者,其中男性39例,女性25例,年龄22-73岁,平均47岁。根据2007年WHO中枢神经系统肿瘤分类标准进行组织学分级:WHO Ⅰ级12例,WHO Ⅱ级14例,WHO Ⅲ级17例,WHO Ⅳ级21例。本研究中所有患者均为首次手术治疗,术前均未行放疗或化疗,且具备完整的术后5年随访调查资料。入选患者自手术之日起至少每3月以门诊复查或电话等方式进行术后随访,根据患者的具体情况,随访资料随之进行更新,随访截止日期为2017年11月。癌旁正常脑组织来自于患者术中胶质瘤组织旁正常的组织,手术切除的组织标本立刻储存在-80 ℃液氮中,以备分离提取RNA。该研究获得西安交通大学第一附属医院伦理委员会同意,术前均签署知情同意书。
1.2 胶质瘤组织和癌旁正常脑组织中XIST的提取和检测
从液氮中取出冰冻的胶质瘤组织和癌旁正常脑组织标本,采用Trizol法(Invitrogen,CA,USA)提取样本中的总RNA,然后采用紫外分光光度计测定样本在波长260 nm和280 nm处的吸光度比值,计算OD 260/280,鉴定RNA的纯度。应用反转录酶-聚合酶链锁反应(RT-PCR)检测组织标本中XIST的表达水平,内参设置为U6。引物序列如下:XIST上游引物正向:5′-AGCTCCTCGGACAGCTGTAA-3′;XIST下游引物反向:5′-CTCCAGATAGCTGGCAACC-3′。U6上游引物正向:5′-CTCGCTTCGGCAGCACA-3′;U6下游引物反向:5′-AACGCTTCACGAATTTGCGT-3′。采用2-ΔΔCt法对测得的数据进行相对定量分析,所有样品至少重复3次。
1.3 统计学处理

2 结果
2.1 XIST在胶质瘤组织中的表达水平明显升高
RT-PCR检测结果显示,与癌旁正常脑组织相比,XIST在胶质瘤组织中的表达水平显著升高(1.00±0.73vs2.88±0.73,P=0.001 2)。与此同时,高级别胶质瘤中XIST的表达水平要明显高于低级别胶质瘤中的表达(4.20±1.09vs2.88±0.73,P=0.013 4,见图1)。
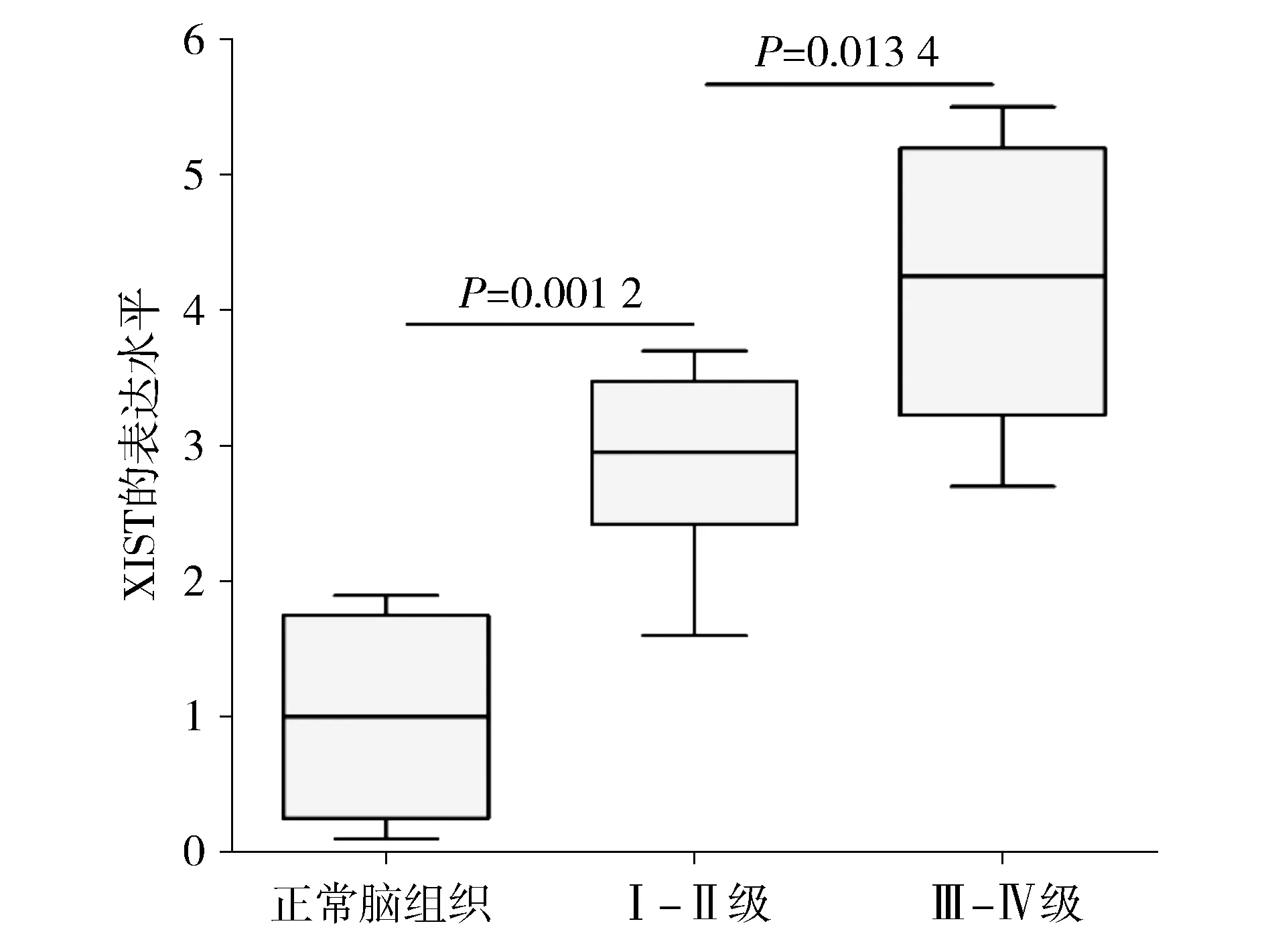
图1 XIST在胶质瘤组织和正常脑组织中的表达水平Figure 1 The expression level of XIST in normal brain tissues and glioma tissues
2.2 XIST的表达水平与胶质瘤患者临床病理特征之间的相关性
根据XIST在所有胶质瘤组织标本中的平均表达水平(3.67±0.83),将本研究中所有的患者分为两组:XIST高表达组(35例,4.31±0.97),XIST低表达组(29例,3.02±0.86)。χ2检验分析显示:高表达的XIST与高WHO分级(P<0.001)和低KPS评分(P=0.001)有关,而与患者年龄、性别、肿瘤大小、肿瘤数目等均无关(P分别为0.632,0.494,0.838,0.728,见表1)。
表1XIST表达水平与胶质瘤患者临床病理特征的相关性
Table1CorrelationbetweentheexpressionlevelofXISTandclinicopathologicalcharacteristicsingliomapatients
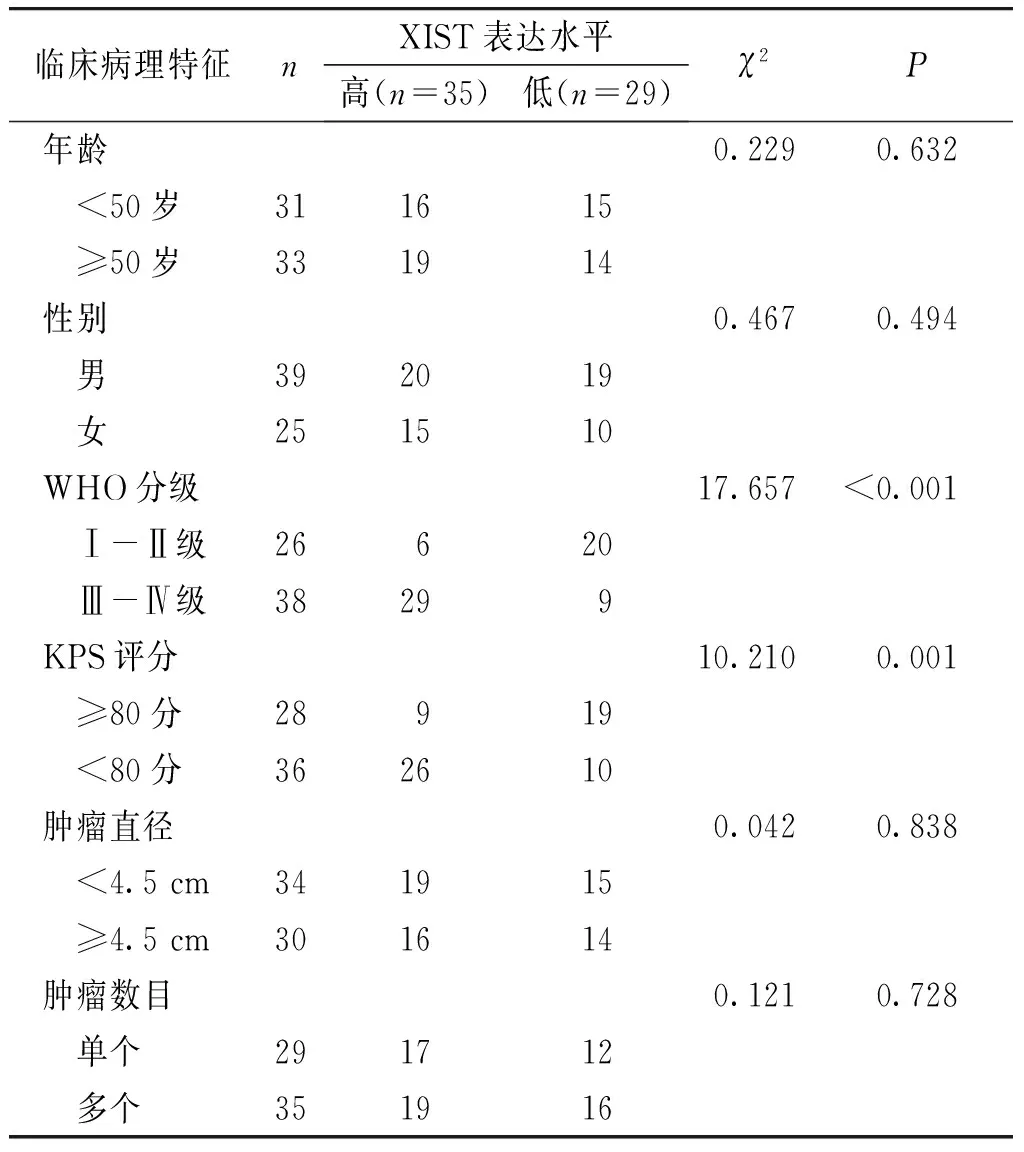
临床病理特征nXIST表达水平高(n=35)低(n=29)χ2P年龄0.2290.632 <50岁311615 ≥50岁331914性别0.4670.494 男392019 女251510WHO分级17.657<0.001 Ⅰ-Ⅱ级26620 Ⅲ-Ⅳ级38299KPS评分10.2100.001 ≥80分28919 <80分362610肿瘤直径0.0420.838 <4.5 cm341915 ≥4.5 cm301614肿瘤数目0.1210.728 单个291712 多个351916
KPS:卡氏行为状态评分
2.3 XIST的表达水平与胶质瘤患者预后之间的相关性
Kaplan-Meier法绘制生存曲线,Log-rank检验比较两组患者的生存曲线是否有差异。结果表明,XIST高表达组患者的生存率显著低于XIST低表达组,且差异有统计学意义(P=0.007,见图2)。
单因素分析结果显示,WHO分级增高、KPS评分<80分、XIST高表达均是影响胶质瘤患者预后的危险因素,见表2。多因素Cox比例风险回归模型分析结果显示:WHO分级增高、KPS评分<80分、XIST高表达均是影响胶质瘤患者临床预后的独立因素(见表3)。
3 讨论
目前,在胶质瘤的临床诊疗中,现有的治疗手段包括手术、放化疗等虽然在一定程度上降低了胶质瘤患者的死亡率,但是由于缺乏特异性的治疗靶点,胶质瘤,尤其是胶质母细胞瘤患者术后5年生存率仍旧偏低[11,12]。因此,探索潜在的可靠的可作为早期诊断、治疗和评估预后的生物学标记物,对胶质瘤患者的诊疗具有很大的意义。

图2 XIST高表达组和低表达组患者生存率的比较Figure 2 Comparison of overall survival rate in glioma patients with high XIST expression and low XIST expression
表2胶质瘤患者不同临床病理变量和XIST表达水平的单变量分析
Table2UnivariateanalysisofdifferentclinicopathologicalvariablesandXISTexpressioninpatientswithglioma

临床病理特征HR(95%CI)P年龄(<50vs≥50岁)1.367(0.792-2.201)0.285性别(男vs女)0.744(0.311-1.814)0.796KPS评分(<80vs≥80)1.987(1.124-3.655)0.018WHO分级(I—II级vsIII—IV级)1.912(1.098-3.345)0.026肿瘤直径(<4.5vs≥4.5厘米)1.207(0.714-2.145)0.539肿瘤数目(单个vs多个)1.132(0.664-2.087)0.714XIST表达水平(低vs高)2.534(1.411-4.753)0.004
KPS:卡氏行为状态评分;HR:风险比
表3胶质瘤患者不同临床病理变量和XIST表达水平的多变量分析
Table3MultivariateanalysesofdifferentclinicopathologicalvariablesandXISTexpressioninpatientswithglioma
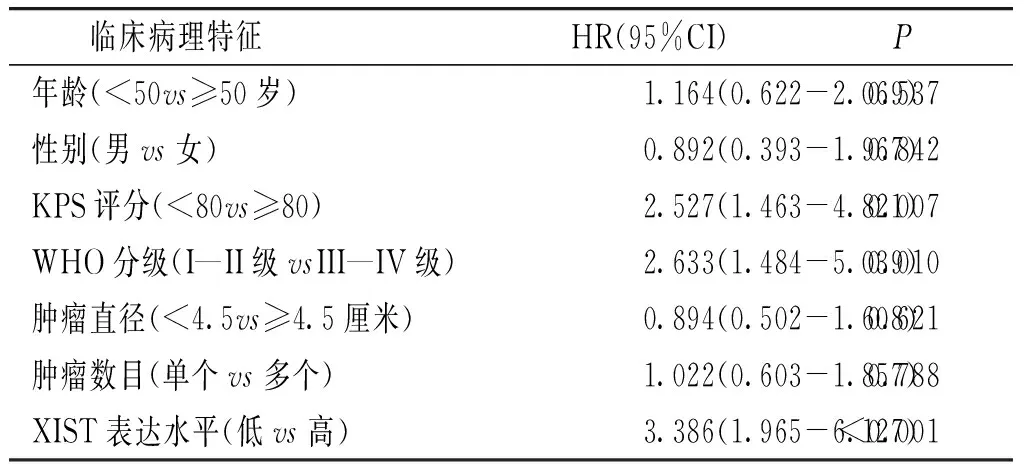
临床病理特征HR(95%CI)P年龄(<50vs≥50岁)1.164(0.622-2.069)0.537性别(男vs女)0.892(0.393-1.967)0.842KPS评分(<80vs≥80)2.527(1.463-4.821)0.007WHO分级(I—II级vsIII—IV级)2.633(1.484-5.039)0.010肿瘤直径(<4.5vs≥4.5厘米)0.894(0.502-1.608)0.621肿瘤数目(单个vs多个)1.022(0.603-1.857)0.788XIST表达水平(低vs高)3.386(1.965-6.127)<0.001
KPS:卡氏行为状态评分
越来越多的研究证据表明,lncRNA可能涉及多种生物和病理活动,包括细胞增殖、分化、迁移、凋亡、细胞周期等,从而在肿瘤的发生和发展过程中发挥促癌或抑癌作用。此外,也有研究证实很多lncRNAs与肿瘤患者的临床预后密切相关。例如过表达的lncRNA-LINC00673与舌鳞状细胞癌患者的预后不良具有显著相关性[13];食管鳞状细胞癌组织中上调的lncRNA-FOXD2-AS1预示着患者的预后不佳[14];表达下调的lncRNA-LOC389332与肾细胞癌患者的不良预后密切相关[15]。然而,到目前为止,只有少数lncRNA被报道可作为预测胶质瘤患者预后的独立因素。
XIST是目前研究较多的一种lncRNA,异常表达的XIST参与调节了多种肿瘤的发生发展过程。有研究发现XIST通过对miR-101/EZH2的促进食管鳞状细胞癌的恶性肿瘤[16]。也有研究证实XIST在人非小细胞肺癌组织和细胞中表达异常增高,下调XIST的表达可抑制癌细胞的增殖和侵袭,诱导细胞凋亡,同时在体内实验条件下抑制皮下肿瘤生长[17]。XIST在胶质瘤中的作用也有研究报道。有研究发现XIST在血-肿瘤屏障通透性和胶质瘤血管生成中起着关键作用,抑制XIST的表达可能是胶质瘤临床治疗的潜在靶点[18]。也有文献报道,XIST在胶质瘤细胞中的表达显著增高,下调XIST的表达通过与microRNA-429相互作用抑制了肿瘤的侵袭性以及促血管生成能力,表明XIST可能作为治疗胶质瘤的潜在靶点[19]。然而,到目前为止,XIST评估胶质瘤患者的临床预后价值却没有文献报道。因此,本课题组通过检测XIST在胶质瘤组织中的表达水平,探讨其与胶质瘤患者预后的关系。
本研究中,我们首先检测XIST在胶质瘤组织和癌旁正常脑组织中的表达水平,RT-PCR分析结果显示XIST在胶质瘤组织中的表达水平显著高于癌旁正常脑组织,并且XIST的表达水平随着胶质瘤的WHO分级的增高而增加。随后,探讨了XIST的表达水平与胶质瘤患者多项临床病理特征之间的相关性。χ2检验分析显示:高表达的XIST与高WHO分级和低KPS评分具有显著相关性,而与患者年龄、性别、肿瘤大小、肿瘤数目等均无关。而且Kaplan-Meier分析结果表明,XIST高表达组患者的生存率显著低于XIST低表达组。最后研究结果显示WHO分级增高、KPS评分<80分、XIST高表达均是影响胶质瘤患者临床预后的独立因素。
综上所述,本研究提供了有力的证据证实XIST在评估胶质瘤患者临床预后的潜在价值。此外,XIST可作为影响胶质瘤患者临床预后的独立因素,从而为胶质瘤的早期诊断及其治疗提供新的靶点。
参考文献:
[1] 孙广升,王翔毅.胶质瘤的治疗进展[J].世界最新医学信息文摘,2015,86(15):54-55.
[2] 周苏娜,张琰君,何东杰,等.低级别胶质瘤36例患者术后放疗的预后分析[J].山西医科大学学报,2016,47(9):847-850.
[3] 陈正和,陈忠平.脑胶质瘤的治疗进展[J].新医学,2015,46(7):417-422.
[4] 曾剑平,刘青,林志雄,等.脑胶质瘤患者预后相关影响因素分析[J].临床神经外科杂志,2015,12(6):410-414.
[5] 郑立影,吕红,林赋桂,等.[J].吉林医药学院学报,2016,37(1):50-53.
[6] 李灵,宋旭.长链非编码RNA在生物体中的调控作用[J].遗传,2014,36(3):228-236.
[7] 王一,李学民,柳琛.长链非编码RNA在神经胶质瘤中作用的研究进展[J].基础医学与临床,2016,36(3):411-414.
[8] 胡倩,姚和瑞.长链非编码RNA与肿瘤研究现状[J].中华肿瘤防治杂志,2014,21(21):1746-1750.
[9] Wang Z, Yuan J, Li L,etal. Long non-coding RNA XIST exerts oncogenic functions in human glioma by targeting miR-137[J]. Am J Transl Res, 2017,9(4):1845-1855.
[10] Zhang Q, Chen B, Liu P,etal. XIST promotes gastric cancer (GC) progression through TGF-beta1 via targeting miR-185[J]. J Cell Biochem, 2017, 119(3):2787-2796.
[11] 梅喜平,郑鲲,邵碧波,等.microRNA-211在脑胶质瘤中的表达及其与临床病理预后的关系[J].山西医科大学学报,2017,48(7):711-714.
[12] 刘晓东,范益民.脑肿瘤干细胞的研究进展[J].山西医科大学学报,2007,38(7):663-668.
[13] Yu J, Liu Y, Gong Z,etal. Overexpression long non-coding RNA LINC00673 is associated with poor prognosis and promotes invasion and metastasis in tongue squamous cell carcinoma[J]. Oncotarget, 2017,8(10):16621-16632.
[14] Bao J,Zhou C,Zhang J,etal.Upregulation of the long noncoding RNA FOXD2-AS1 predicts poor prognosis in esophageal squamous cell carcinoma[J].Cancer Biomark,2017,21(3):527-533.
[15] Jin P, Wang J, Liu Y. Downregulation of a novel long non-coding RNA, LOC389332, is associated with poor prognosis and tumor progression in clear cell renal cell carcinoma[J]. Exp Ther Med, 2017,13(3):1137-1142.
[16] Wu X, Dinglin X, Wang X,etal. Long noncoding RNA XIST promotes malignancies of esophageal squamous cell carcinoma via regulation of miR-101/EZH2[J]. Oncotarget, 2017,8(44):76015-76028.
[17] Wang H, Shen Q, Zhang X,etal. The Long non-Coding RNA XIST controls non-small cell Lung cancer proliferation and invasion by modulating miR-186-5p[J]. Cell Physiol Biochem, 2017,41(6):2221-2229.
[18] Yu H, Xue Y, Wang P,etal. Knockdown of long non-coding RNA XIST increases blood-tumor barrier permeability and inhibits glioma angiogenesis by targeting miR-137[J]. Oncogenesis, 2017,6(3):e303.
[19] Cheng Z, Li Z, Ma K,etal. Long non-coding RNA XIST promotes glioma tumorigenicity and angiogenesis by acting as a molecular sponge of miR-429[J].J Cancer,2017,8(19):4106-4116.

