微小RNA-103a对宫颈癌细胞增殖、迁移和侵袭能力的影响
苏 喆,洪 阁
(中国医学科学院北京协和医学院生物医学工程研究所,天津 300192;*
在全世界范围内,由HPV感染导致的宫颈癌受到广泛关注。据国际癌症研究署(IARC)统计,2012年全世界新增宫颈癌约527 600例,死亡人数高达265 700人[1]。现阶段在发达国家中,由于宫颈癌筛查手段的提升以及医疗机制的发展完善,宫颈癌的发病率得到了很好的控制。然而在大多数发展中国家,每年新增宫颈癌病例非常高,且一经发现通常已处于癌症晚期,这对生命健康形成了极大的威胁[2]。因此,通过从分子水平探索影响宫颈癌发生发展的关键因素,并寻找宫颈癌诊疗的生物标志物和潜在的作用靶点,对改善宫颈癌患者的生存质量及预后有着非常重要的意义。
miRNA是一类小的非编码RNA,其通过与位于3′-UTR(3′-非翻译区)中的靶序列结合来抑制靶mRNA的转录后表达,既可以作为致癌基因也可以作为肿瘤抑制剂[3]。许多研究表明,miRNA通过结合靶mRNA的3′-UTR来阻止翻译或促进特异性靶标的降解[4]。有众多研究报道,miRNA家族中的miR-107在乳腺癌[5]、头颈部鳞癌[6]、胃癌[7]、宫颈癌[8]和结肠癌[9]等恶性肿瘤中均发挥着抑癌的作用,而与miR-107高度同源的miR-103a是否参与宫颈癌的发生和发展及其具体机制尚未阐明。因此,为了从miRNA的角度探索宫颈癌的新治疗靶点,本研究以宫颈癌细胞系为研究对象,检测了miR-103a在宫颈癌细胞系中的表达水平,并系统性研究了miR-103a对宫颈癌细胞的增殖、迁移和侵袭能力的影响,以期为宫颈癌的诊疗及预后奠定基础。
1 材料与方法
1.1 细胞系及培养条件
人宫颈癌细胞株SiHa、C33A、CaSki、HeLa及人永生化表皮细胞HaCaT购自中国科学院上海细胞库。SiHa、C33A、CaSki和HaCaT细胞培养基为DMEM(含10% FBS,100 U/ml青霉素和0.1 mg/ml链霉素);HeLa细胞培养基为RPMI 1640(含10% FBS,100 U/ml青霉素和0.1 mg/ml链霉素),培养条件均为:37 ℃,5% CO2的细胞培养箱。
1.2 主要试剂
细胞培养基DMEM及RPMI 1640购自美国Gibco公司;FBS、青霉素及链霉素溶液均购自美国Gibco公司;胰蛋白酶购自美国Thermo Fisher公司;MTT购自美国Sigma公司;Trizol购自美国Invitrogen公司;miScriptⅡ RT试剂盒和miScript SYBR Green PCR试剂盒购自德国Qiagen公司;结晶紫和焦碳酸二乙酯(DEPC)购自北京Solarbio科技有限公司;miR-103a mimic及miR-NC由江苏Biomics生物技术有限公司合成;LipofectamineTM2000转染试剂购自美国Invitrogen公司;Opti-MEM购自美国Gibco公司;Transwell小室购自美国Corning公司,Matrigel基质胶购自美国BD公司。
1.3 RT-qPCR法检测宫颈癌细胞中miR-103a的表达水平
用Trizol试剂盒分别提取宫颈癌细胞HeLa、SiHa、C33A和CaSki及对照细胞HaCaT中的总RNA,用微量紫外-可见分光光度计测定样品浓度和纯度,纯度以A260/A280值表征,比值在1.8-2.1为合格。按照miScriptⅡ RT试剂盒说明书逆转录获取cDNA模板。按miScript SYBR Green PCR试剂盒说明书操作进行PCR反应,采用U6作为内参。反应条件如下:95 ℃预变性10 min,98 ℃ 10 s,60 ℃ 30 s,共45个循环。miR-103a上游引物:5′-AGCAGCATTGTACAGGGCTATGA-3′,miR-103a下游引物:5′-GTGCAGGGTCCGAGGT-3′;U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,U6下游引物:5′-AACGCTTCACGAATTTGCGT-3′。采用2-ΔΔCt法分析miR-103a的相对表达水平。
1.4 细胞转染
将常规培养的人宫颈癌细胞HeLa用胰蛋白酶消化,制成单细胞悬液并计数,按照每孔2.5×106个细胞接种于6孔板中培养24 h。待细胞融合度为55%-75%时,按LipofectamineTM2000说明书操作,将miR-103a mimics和miR-NC转染至宫颈癌细胞HeLa中。
1.5 MTT法检测细胞增殖
将转染miR-103a mimics和miR-NC的HeLa细胞用胰蛋白酶消化,制成单细胞悬液并计数,按照每孔4×103个细胞接种至96孔板,设3个复孔,置培养箱中培养,待细胞充分贴壁后,分别于0,24,48,72,96 h,每孔加入20 μl MTT(5 mg/ml)溶液,继续培养4 h,弃去培养基,每孔加入150 μl二甲基亚砜,充分振摇使结晶完全溶解。将96孔板置于酶标仪中,于480 nm波长处检测各孔的吸光度值(630 nm作为参比波长)。
1.6 划痕实验检测细胞迁移能力
将转染miR-103a mimics和miR-NC的HeLa细胞用胰酶消化,制成单细胞悬液并计数,按照每孔4×106个细胞接种于6孔板,设置3个复孔。弃去培养液,用划痕器沿6孔板中央轻轻做一直线划痕,用PBS清洗孔板以除去残留细胞碎片。每孔加入培养基,分别于0 h和24 h,倒置显微镜观察细胞迁移情况并拍照,随机选取5个视野测量划痕宽度,比较miR-103a mimics组和miR-NC组细胞的迁移距离差异。
1.7 Transwell实验检测细胞侵袭能力
将Matrigel用无血清的培养基按1 ∶10进行稀释,每孔100 μl加入至Transwell小室中,于37 ℃培养箱过夜。将转染miR-103a mimics和miR-NC的HeLa细胞用胰蛋白酶消化,制成单细胞悬液并计数,按2×105个/孔加入至每个Transwell小室内,下室加入含FBS的细胞培养基并设置3个复孔,放入孵箱培养48 h。取出Transwell小室,PBS清洗,70%乙醇溶液固定30 min,0.1%结晶紫溶液染色10 min,再用PBS清洗2次。在高倍倒置显微镜下随机选取5个视野观察并拍照,统计穿过Transwell小室的细胞数量。
1.8 统计学分析

2 结果
2.1 miR-103a在宫颈癌细胞SiHa、HeLa、C33A和CaSki中呈低表达
本研究通过RT-qPCR检测了4种宫颈癌细胞系SiHa、HeLa、C33A和CaSki以及人永生化表皮细胞HaCaT中miR-103a的表达水平。RT-qPCR结果显示,采用标准化公式计算,4种宫颈癌细胞系中miR-103a的相对表达量与HaCaT细胞比较,SiHa细胞为0.236±0.012,t=12.286,P=0.005 9;HeLa细胞为0.069±0.025,t=14.692,P=0.000 8;C33A细胞为0.354±0.062,t=9.043,P=0.006 8;Caski细胞为0.199±0.016,t=12.829,P=0.005 0。与对照组人永生化表皮细胞HaCaT细胞相比,miR-103a在4种宫颈癌细胞系中表达均下调,其差异均具有统计学意义(均P<0.05,见图1)。而与SiHa、C33A和CaSki细胞相比,miR-103a在HeLa细胞中的表达水平下调更加明显,因此选用HeLa细胞作为后续实验的研究对象。
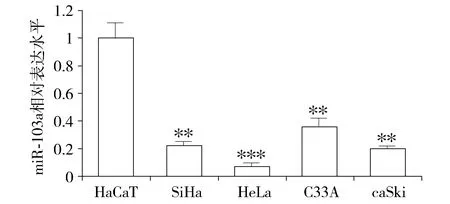
与HaCaT细胞比较,**P<0.01,***P<0.001图1 宫颈癌细胞SiHa、HeLa、C33A和CaSki中miR-103a的相对表达水平Figure 1 The relative expression of miR-103a in four diffe-rent cervical cancer cells
2.2 上调miR-103a的表达对细胞增殖能力的影响
采用细胞转染的方法将miR-103a mimics和miR-NC分别转染到宫颈癌细胞HeLa中。通过RT-qPCR实验结果显示,转染miR-NC的HeLa细胞中miR-103a的相对表达量为1.009±0.015;转染miR-103a mimics的HeLa细胞中miR-103a的相对表达量为35.576±0.830。经t检验,与miR-NC组相比,miR-103a mimics组细胞中miR-103a的表达量明显上调,二者差异具有统计学意义(t=-72.126,P=0.000 1,见图2)。
采用MTT法检测上调miR-103a的表达对宫颈癌细胞HeLa增殖的影响,结果显示上调miR-103a的表达能够抑制HeLa细胞的增殖,即与转染miR-NC的HeLa细胞相比,转染miR-103a mimics的细胞生长速度明显减慢。培养96 h(4 d)时,miR-NC组和miR-103a mimics组的吸光值分别为2.832±0.152和1.735±0.172,两组间差异具有统计学意义(t=10.687,P=0.000 2,见图3)。

与miR-NC组比较,***P<0.001图2 miR-103a mimics和miR-NC转染后HeLa细胞中miR-103a的表达Figure 2 The expression of miR-103a in HeLa cells after transfected with miR-103a mimics or miR-NC
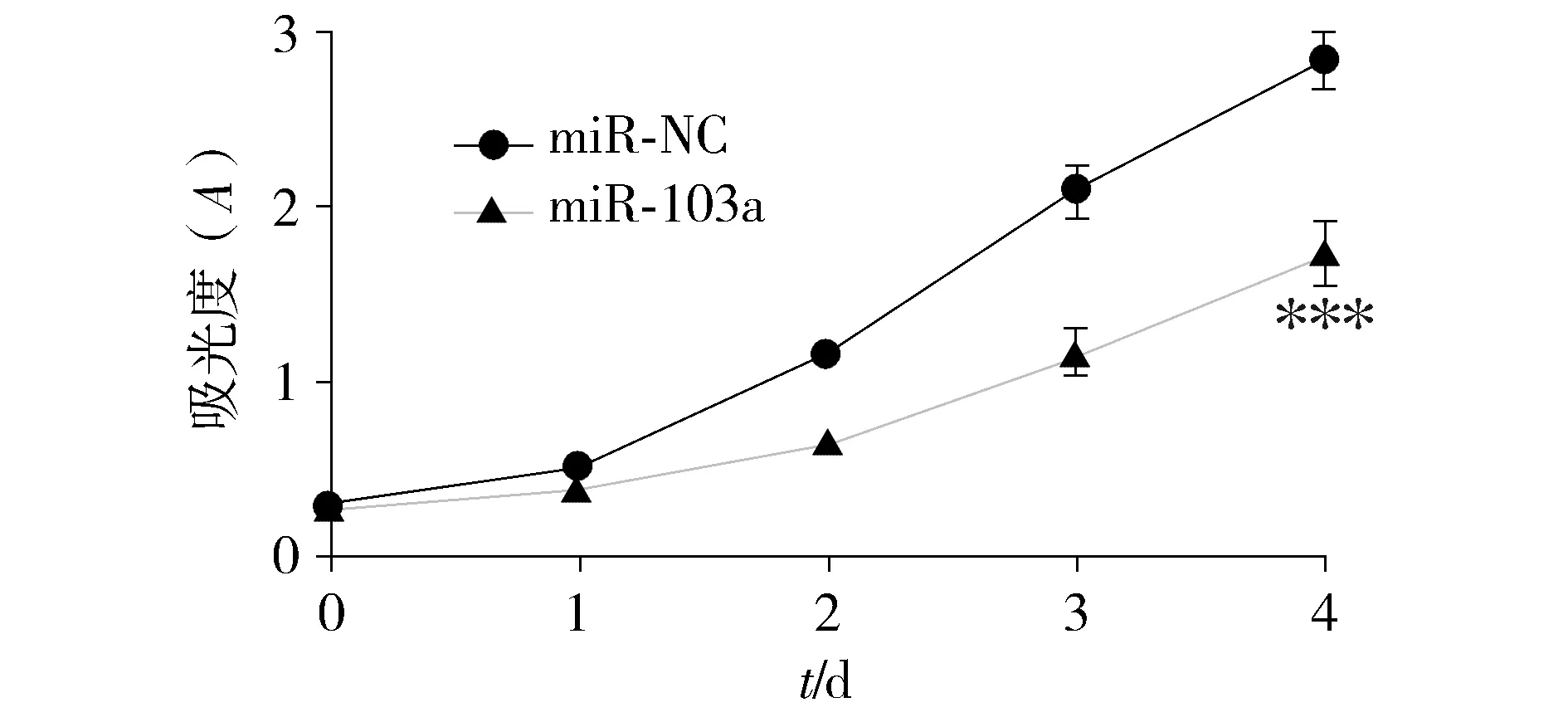
与miR-NC组比较,***P<0.001图3 MTT法检测上调miR-103a表达对HeLa细胞增殖的影响Figure 3 The effect of miR-103a up-regulation on the proliferation of HeLa cells by MTT assay
2.3 上调miR-103a的表达对细胞迁移能力的影响
为了研究上调miR-103a的表达对细胞迁移能力的影响,采用划痕实验观察miR-103a mimics和miR-NC转染的HeLa细胞的迁移情况。结果显示,转染miR-NC的HeLa细胞迁移距离为(126.084±9.501)μm,转染miR-103a mimics的HeLa细胞迁移距离为(65.748±8.181)μm。经t检验,两组细胞迁移距离差异具有统计学意义(t=11.788,P=0.004 2),转染miR-103a mimics的细胞迁移能力受到明显抑制,划痕宽度变化较小;而转染miR-NC的细胞迁移能力未受影响,划痕宽度随时间变化明显(见图4)。
2.4 上调miR-103a的表达对细胞侵袭能力的影响
为了进一步验证miR-103a在宫颈癌发生发展中的作用,应用Transwell小室检测miR-103a过表达对细胞侵袭能力的影响。结果显示,转染miR-NC的HeLa细胞穿出数目为(180.750±17.261)个;转染miR-103a mimics的HeLa细胞穿出数目为(75.375±15.775)个。经t检验,两组穿出细胞数目差异具有统计学意义(t=12.746,P=0.001 2)。显微镜视野中miR-103a mimics组结晶紫染色细胞数明显减少(见图5),即表明miR-103a mimics组穿膜细胞数较miR-NC组相比明显减少。以上结果显示,上调miR-103a的表达可以抑制宫颈癌HeLa细胞的侵袭能力。

图4 划痕实验检测上调miR-103a的表达对HeLa细胞迁移能力的影响Figure 4 The effect of miR-103a up-regulation on the migration of HeLa cells by would healing assay
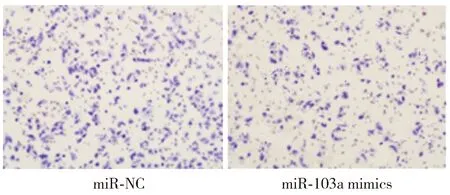
图5 Transwell实验检测上调miR-103a的表达对HeLa细胞侵袭能力的影响Figure 5 The effect of miR-103a up-regulation on the invasion of HeLa cells by Transwell assay
3 讨论
据多项研究报道,包括宫颈癌在内的多种恶性肿瘤的发生、发展等生物学行为均与微小RNA的异常表达密切相关。宫颈癌的发生是一个多步骤的过程,涉及正常宫颈上皮细胞向宫颈上皮瘤前病变的转化,随后转变为宫颈癌,这一疾病进展的每个阶段都有相应的miRNA参与。miRNA可以通过对致癌基因、抑癌基因以及相关蛋白的调控来影响宫颈癌的发生和进展。
目前,在宫颈癌中发现了许多致癌miRNA。其中,miR-21在多种癌细胞中过表达,并且直接靶向肿瘤抑制基因程序性细胞死亡因子4(programmed cell death factor 4,PDCD4)。PDCD4的表达诱导细胞凋亡并抑制肿瘤生长,因此miR-21与PDCD4的3′-UTR结合可抑制其功能,进而导致癌症的发生[10]。miR-19a和miR-19b在宫颈癌细胞系中呈高表达,能够通过靶向调控Cullin-5来促进宫颈癌细胞HeLa和C33A的增殖,并增强其侵袭转移的能力[11]。miR-20a靶向致癌基因人端锚聚合酶2(TNKS2),通过正向调控TNKS2的表达来增强宫颈癌细胞转移和侵袭的能力[12]。miR-133b通过调控哺乳动物不育系20样激酶2(mammalian sterile 20-like kinase 2,MST2)、细胞分裂控制蛋白42同系物(cell division control protein 42 homolog,CDC42)和Ras同源基因家族成员A(ras homolog gene family member A,RHOA)的表达和丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1,MAPK1)和v-akt小鼠胸腺瘤病毒致癌基因同系物1(AKT1)信号通路,从而促进肿瘤恶性转化[13]。随着miR-133b表达的增加,宫颈肿瘤的潜伏期缩短。因此miR-133b可作为诊断早期宫颈癌的生物标志物。
许多研究也发现了肿瘤抑制性miRNA。例如,miR-138在细胞中参与端粒酶的调节。端粒酶是一种通过在染色体末端延伸端粒而与细胞永生化及肿瘤发生密切相关的酶,其活性取决于人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)的表达。miR-138能够降低hTERT mRNA水平并抑制端粒酶活性,从而抑制细胞永生化并阻止其恶性转化[14]。另据报道,在宫颈癌细胞HeLa和C33A中,过度表达miR-7能够靶向调节X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)来抑制癌细胞增殖并促进凋亡,从而起到肿瘤抑制剂的作用[15]。miR-17-5p靶向肿瘤蛋白p53诱导的核蛋白1(tumor protein p53-induced nuclear protein 1,TP53INP1)从而抑制癌细胞生长,导致细胞凋亡[16]。此外,Cui等[17]通过MTT实验和流式细胞技术分析宫颈癌细胞的生物学行为,结果显示过表达miR-125b能够通过靶向PI3K/Akt/mTOR信号通路抑制磷酸肌醇3-激酶催化亚基(phosphoinositide 3-kinase catalytic subunit delta,PIK3CD),从而抑制细胞生长,诱导其凋亡,并降低致瘤性。
在宫颈癌中,miR-107通过靶向MCL1基因激活ATR/Chk1途径,从而抑制宫颈癌细胞的侵袭能力[8];同时,miR-107作为肿瘤抑制因子,能够直接靶向CCR5并抑制其表达,进而抑制宫颈癌细胞的增殖和侵袭能力[18]。miR-103a和miR-107属于旁系同源物。miR-103通过直接靶向非小细胞肺癌及前列腺癌细胞中程序性细胞死亡因子10(programmed cell death 10, PDCD10)而起到抑制肿瘤的作用[19,20]。此外,miR-103a通过靶向调控c-Myb基因,可以抑制胃癌细胞增殖、迁移和侵袭的能力[21]。然而miR-103a在宫颈癌中是否有调控作用尚未明确。本研究探索了与miR-107高度同源的miR-103a在宫颈癌中的作用,并考察其对宫颈癌HeLa细胞增殖、迁移以及侵袭能力的影响。本实验结果证实,miR-103a过表达能够抑制HeLa细胞增殖、迁移和侵袭的能力。因此,miR-103a在宫颈癌中是一个潜在的抑癌因子,本研究将有助于更深层次了解肿瘤发生的分子机制,并为宫颈癌的治疗提供新思路。
参考文献:
[1] IARC.Globocan 2012:Estimated Cancer Incidence,Mortality and Prevalence Worldwide in 2012 [EB/OL]. http://globocan.iarc.fr/Default.aspx(2012-1).
[2] Cesario SK. Global inequalities in the care of women with cancer[J]. Nurs Womens Health, 2012, 16(5):372-385.
[3] Ferracin M, Veronese A, Negrini M. Micromarkers: miRNAs in cancer diagnosis and prognosis[J]. Expert Rev Mol Diagn, 2010, 10(3):297-308.
[4] Carthew RW, Sontheimer EJ. Origins and Mechanisms of miRNAs and siRNAs[J]. Cell, 2009, 136(4): 642-655.
[5] Li XY, Luo QF, Wei CK,etal. MiRNA-107 inhibits proliferation and migration by targeting CDK8 in breast cancer[J]. Int J Clin Exp Med, 2014, 7(1):32-40.
[6] Jharna D, Ashley S, Lang JC,etal. MicroRNA-107 functions as a candidate tumor-suppressor gene in head and neck squamous cell carcinoma by downregulation of protein kinase Cε[J]. Oncogene, 2012, 31(36):4045-4053.
[7] Feng L, Xie Y, Zhang H,etal. MiR-107 targets cyclin-dependent kinase 6 expression, induces cell cycle G1 arrest and inhibits invasion in gastric cancer cells[J]. Med Oncol, 2012, 29(2):856-863.
[8] Zhou C, Li G, Zhou J,etal. MiR-107 activates ATR/Chk1 pathway and suppress cervical cancer invasion by targeting MCL1[J]. PLoS One, 2014, 9(11): e111860.
[9] Yamakuchi M, Lotterman CD, Bao C,etal. P53-induced microRNA-107 inhibits HIF-1 and tumor angiogenesis[J]. Proc Natl Acad Sci U S A, 2010, 107(14):6334-6339.
[10] Yao Q, Xu H, Zhang QQ,etal. MicroRNA-21 promotes cell proliferation and down-regulates the expression of programmed cell death 4 (PDCD4) in HeLa cervical carcinoma cells[J]. Biochem Biophys Res Commun, 2009, 388(3):539-542.
[11] Xu XM, Wang XB, Chen MM,etal. MicroRNA-19a and-19b regulate cervical carcinoma cell proliferation and invasion by targeting CUL5[J]. Cancer Lett, 2012, 322(2):148-158.
[12] Kang HW, Wang F, Wei Q,etal. MiR-20a promotes migration and invasion by regulating TNKS2 in human cervical cancer cells[J]. FEBS Lett, 2012, 586(6):897-904.
[13] Qin W, Dong P, Ma C,etal. MicroRNA-133b is a key promoter of cervical carcinoma development through the activation of the ERK and AKT1 pathways[J]. Oncogene, 2012, 31(36):4067-4075.
[14] Chakrabarti M, Banik NL, Ray SK. MiR-138 overexpression is more powerful than hTERT knockdown to potentiate apigenin for apoptosis in neuroblastomainvitroandinvivo[J]. Exp Cell Res, 2013, 319(10):1575-1585.
[15] Liu S, Zhang P, Chen Z,etal. MicroRNA-7 downregulates XIAP expression to suppress cell growth and promote apoptosis in cervical cancer cells[J]. FEBS Lett, 2013, 587(14):2247-2253.
[16] Wei Q, Li YX, Liu M,etal. MiR-17-5p targets TP53INP1 and regulates cell proliferation and apoptosis of cervical cancer cells[J]. IUBMB Life, 2012, 64(8):697-704.
[17] Cui F, Li X, Zhu X,etal. MiR-125b inhibits tumor growth and promotes apoptosis of cervical cancer cells by targeting phosphoinositide 3-kinase catalytic subunit delta[J]. Cell Physiol Biochem, 2012, 30(5):1310-1318.
[18] Che LF, Shao SF, Wang LX. Downregulation of CCR5 inhibits the proliferation and invasion of cervical cancer cells and is regulated by microRNA-107[J]. Exp Ther Med, 2016, 11(2):503-509.
[19] Yang D, Wang JJ, Li JS,etal. MiR-103 functions as a tumor suppressor by directly targeting programmed cell death 10 in NSCLC[J].Oncol Res,2017:Epub ahead of print.
[20] Fu X, Zhang W, Su Y,etal. MicroRNA-103 suppresses tumor cell proliferation by targeting PDCD10 in prostate cancer[J]. Prostate, 2016, 76(6):543-551.
[21] Liang J, Liu X, Xue H,etal. MicroRNA-103a inhibits gastric cancer cell proliferation, migration and invasion by targeting c-Myb[J]. Cell Prolif, 2015, 48(1):78-85.

