缺血后适应对心肌缺血再灌注损伤大鼠p38丝裂原活化蛋白激酶和血小板-白细胞聚集体表达的影响
孙静,任法新,孙晓健,张传焕,李留东,牟楠,董梅
p38丝裂原活化蛋白激酶(MAPK)是近年来发现的一类新的MAPK通路,是重要的细胞内信号传导酶,在心肌缺血再灌注损伤信号传导通路中发挥重要作用[1],且p38MAPK与炎性反应调控机制关系密切[2]。血小板-白细胞聚集体(PLA)是反映体内炎症-血栓状态的新指标[3]。本课题组前期已经证实高水平的PLA与急性心肌梗死的发生呈正相关[4],且能够预测急诊经皮冠状动脉介入治疗(PCI)术后心肌无复流的发生[5]。缺血后适应是防治心肌缺血再灌注损伤的重要措施,能够减少心肌缺血再灌注损伤。缺血后适应保护机制是否与其调控PLA表达和p38MAPK信号通路有关,目前鲜有报道。本研究观察在心肌缺血再灌注损伤中缺血后适应对p38MAPK 蛋白表达及PLA水平的影响,观察其心肌保护作用机制。
1 材料与方法
材料与试剂:健康雄性SPF级SD大鼠60只,购于北京维通利华实验动物有限公司,动物合格证号 11400700221589。体重 200~250 g。p38MAPK 抑制剂SB203580和激活剂Anisomycin购于德国默克公司。肌酸激酶同工酶(CK-MB)试剂盒和肌钙蛋白I(TnI)试剂盒购于CUSABIO公司(中国,武汉)。红细胞裂解液购于美国BD Biosciences公司,CD45和CD41a购于美国eBioscience公司。兔抗小鼠磷酸化p38 MAPK多克隆抗体购于美国Santa Cruz公司,相应二抗购自瑞典Amersham公司。
心肌缺血再灌注模型:大鼠以1% 戊巴比妥钠(0. 23 ml /100 g)行腹腔注射麻醉,颈部正中切口,气管插管后行机械通气。分离右侧颈总动脉,将PE-50聚乙烯管插入颈静脉和颈动脉,手术稳定30 min后,在胸部左侧第4肋间水平打开胸腔, 钝性分离并剪开心包膜,采用6-0丝线阻断左前降支(LAD)30 min 再灌注180 min。在再灌注5 min时,通过右颈静脉根据分组注射不同药物。根据分组给予不同处理。后通过颈动脉插管抽取血3~4 ml,根据所测指标不同给予不同处理。
实验分组:完全随机化方法将实验大鼠随机分为6组(每组10只)。假手术组:开胸,分离左冠状动脉并穿线,但不结扎,旷置30 min,缺血25 min时通过右颈静脉注射10%二甲基亚砜(DMSO)0.8 ml;缺血再灌注(I/R)组:缺血25 min时通过右颈静脉注射10% DMSO 0.8 ml,缺血结束后恢复持续再灌注3 h;缺血后适应组:缺血25 min时通过右颈静脉注射10% DMSO 0.8 ml,缺血结束后、再灌注前通过结夹-松解LAD实现1 min再灌注和1 min缺血反复3次后,持续再灌注3 h;SB203580组:缺血25 min时通过右颈静脉注射SB203580(1 mg/kg,溶于10% DMSO 0.8 ml),缺血结束后持续再灌注3 h;Anisomycin+缺血后适应(Ani+缺血后适应)组:缺血25 min时通过右颈静脉注射Anisomycin(2 mg/kg,溶于10% DMSO 0.8 ml),缺血结束后再灌注前通过结夹-松解LAD实现1 min再灌注和1min缺血反复3次后,持续再灌注3 h;Ani组:缺血25 min时通过右颈静脉注射Anisomycin(2 mg/kg,溶于10% DMSO 0.8 ml),缺血结束后持续再灌注3 h。
心肌损伤标志物的测定:从颈总动脉抽血,3000 g离心15 min后分离上清,留取血清液氮冷冻后-80℃冰箱保存。利用试剂盒测定CK-MB和TnI水平。操作过程严格遵循说明书。
心肌梗死面积测定:再灌注3 h取出心脏置于-20℃冰箱约20 min,冷冻后按垂直于左心室长轴方向切片(厚度约2 mm)。将新鲜组织切片置装有1% 2,3,5-氯化三苯基四氮唑(TTC)溶液(pH 7.4,37℃)中被温孵15 min。TTC染色后,梗死区心肌呈现苍白色,而活性心肌呈现红色。心肌梗死面积以梗死区与总左心室体积的比值来表示。
血小板-白细胞聚集体的测定[6]:在基础状态、缺血30 min、再灌注30 min、60 min及3 h后利用流式细胞仪检测各组PLA水平。取血200 μl,加入柠檬酸钠抗凝,1000 g离心5 min,弃上清,加入6~10倍细胞体积的红细胞裂解液,轻轻吹打混匀,裂解1~2 min,在裂解过程中适当摇动以促进红细胞裂解,1000 g离心5 min,弃上清,如果发现裂解不完全,可以重复上述步骤,加入适量的磷酸缓冲盐溶液(PBS,含 135 mmol/L NaCl、2.7mmol/L KCl、1.5 mmol/L KH2PO4和 8 mmol/L K2HPO4,pH7.2),重悬沉淀,1000 g离心3 min,弃上清,加入200 μl 的2%多聚甲醛固定60 min,加入1600 μl PBS静置15min,1500 g离心15 min,PBS重悬3次,最后溶解于200 μl的PBS,每组两管,均加入CD45,对照组一管加入CD41-PE,另一管加入免疫球蛋白(IgG)设为同型对照,暗室30 min后离心,PBS悬浮在FC 500 MPC型流式细胞仪上检测。
蛋白免疫印迹法测定磷酸化p38MAPK水平:再灌注3 h后取出心脏- 80℃冰箱冷冻,提取心肌组织总蛋白,上述蛋白提取液上清进行聚丙烯酰胺凝胶电泳(SDS-PAGE,10%分离胶),将电泳分离后的蛋白质电转移至硝酸纤维素膜上,经封闭、 洗脱后分别加入磷酸化p38MAPK多克隆抗体。抗原抗体复合物用增强化学发光法(ECL)显示,暗室 X光胶片曝光,采用Image-ProPlus图像分析软件分析蛋白条带的积分光密度值(IOD),IOD=平均光密度值×面积,以靶蛋白IOD值/β-肌动蛋白(actin)IOD值的比值反映靶蛋白相对水平。
统计学分析:采用SPSS 20.0统计软件进行分析。计量资料以均数±标准差(±s)表示。多组间比较采用方差分析;均数间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组的CK-MB和TnI水平的比较(表1)
I/R组、缺血后适应组、SB203580组、Ani+缺血后适应组和Ani组的CK-MB水平(pg/ml)分别为 637.31±43.99、257.38±53.12、307.18±50.56、500.84±52.93和638.34±25.87。I/R组、缺血后适应组、SB203580组、Ani+缺血后适应组和Ani组TnI水平(pg/ml)分别为 19.67±0.66、10.05±0.81、13.34±0.90、17.32±0.77和19.96±0.72。与I/R组相比,缺血后适应组、SB203580组和Ani+缺血后适应组的CK-MB和TnI水平明显降低(P<0.05)。与缺血后适应组相比,SB203580组、Ani+缺血后适应组和Ani组的CK-MB和TnI水平明显升高(P<0.05),Ani组和I/R组之间差异没有统计学意义(P>0.05)。
2.2 各组的心肌梗死面积比较(表1、图1)
I/R组、缺血后适应组、SB203580组、Ani+缺血后适应组和Ani组梗死面积(%)为40.17±1.77、16.68±2.06、21.38±1.73、27.91±1.79 和40.62±1.59。与I/R组相比,缺血后适应组、SB203580组和Ani+缺血后适应组梗死面积明显降低(P<0.05)。与缺血后适应组相比,SB203580组、Ani+缺血后适应组和Ani组梗死面积明显升高(P<0.05),Ani组和I/R组之间差异没有统计学意义(P>0.05)。
表1 各组大鼠肌酸激酶同工酶、肌钙蛋白I及梗死面积表达(n=10,±s)
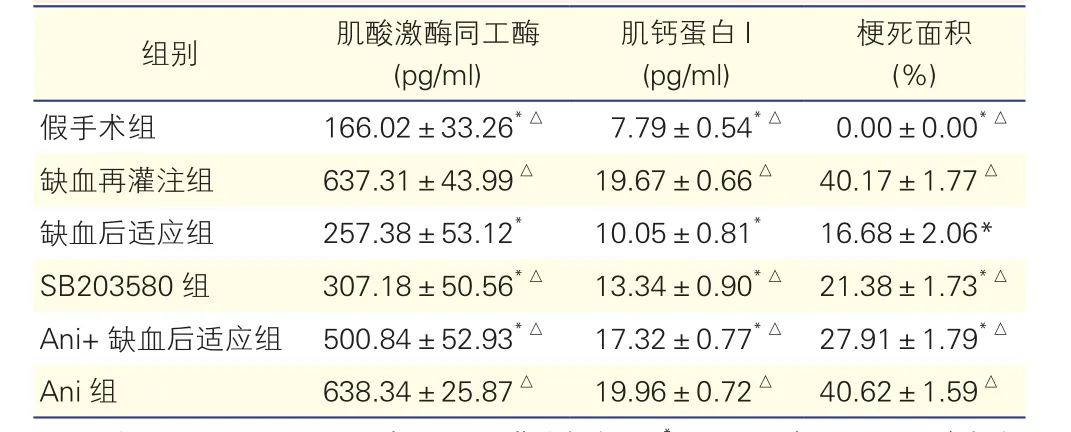
表1 各组大鼠肌酸激酶同工酶、肌钙蛋白I及梗死面积表达(n=10,±s)
注:Ani:Anisomycin。与缺血再灌注组相比 P<0.05;与缺血后适应组相比△P<0.05
梗死面积(%)假手术组 166.02±33.26*△ 7.79±0.54*△ 0.00±0.00*△缺血再灌注组 637.31±43.99△ 19.67±0.66△ 40.17±1.77△缺血后适应组 257.38±53.12* 10.05±0.81* 16.68±2.06*SB203580 组 307.18±50.56*△ 13.34±0.90*△ 21.38±1.73*△Ani+ 缺血后适应组 500.84±52.93*△ 17.32±0.77*△ 27.91±1.79*△Ani组 638.34±25.87△ 19.96±0.72△ 40.62±1.59△组别 肌酸激酶同工酶(pg/ml)肌钙蛋白I(pg/ml)

图1 各组大鼠心肌梗死面积的比较
2.3 各组血小板-白细胞聚集体表达的比较(表2)
在基础状态、缺血30 min和再灌注30 min时,I/R组与其他各组比较PLA表达水平无差异(P>0.05)。在再灌注60 min和3 h时,与I/R组相比,缺血后适应组和SB203580组PLA表达水平明显降低(P<0.05)。与缺血后适应组相比,SB203580组、Ani+缺血后适应组和Ani组PLA表达水平明显升高(P<0.05)。Ani组与I/R组之间差异没有统计学意义(P>0.05)。
表2 各组大鼠五个时间点的血浆血小板-白细胞聚集体表达水平比较(±s)

表2 各组大鼠五个时间点的血浆血小板-白细胞聚集体表达水平比较(±s)
注:Ani:Anisomycin。与缺血再灌注组相比 *P<0.05;与缺血后适应组相比△P<0.05
假手术组 (n=10) 7.96±0.30 23.70±2.79*△ 8.99±0.56*△ 8.80±0.36*△ 10.11±0.87*△Ani+ 缺血后适应组 (n=10) 9.30±0.29 22.20±2.82 32.69±2.14 45.26±0.94△ 53.85±1.45△
2.4 各组磷酸化p38MAPK的表达水平比较(图2)
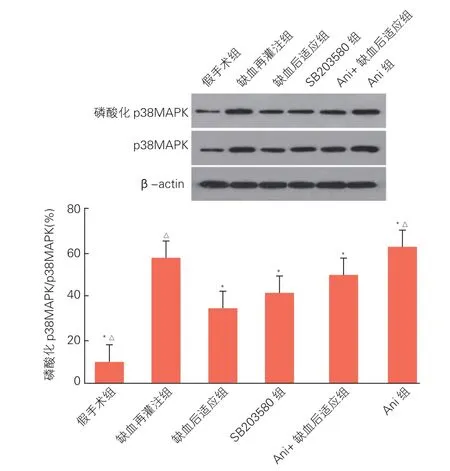
图2 免疫蛋白印迹法分析各组大鼠心肌磷酸化p38MAPK的表达水平
免疫蛋白印迹法检测结果提示,与I/R组相比,缺血后适应组、SB203580组和Ani+缺血后适应组的磷酸化p38MAPK的表达明显降低(P<0.05),Ani组的磷酸化p38MAPK表达水平明显升高(P<0.05)。与缺血后适应组相比,Ani+缺血后适应组和Ani组磷酸化p38MAPK表达水平明显升高(P<0.05)。
3 讨论
既往多项研究证实,缺血后适应能有效地减轻再灌注损伤,炎症机制是再灌注损伤的重要机制之一。本实验通过成功建立大鼠心肌缺血再灌注模型,初步探讨缺血后适应减少心肌缺血再灌注损伤的机制。实验结果提示:(1)心肌缺血再灌注能够抑制p38 MAPK蛋白的磷酸化;(2)PLA在缺血再灌注损伤中发挥重要作用;(3)通过抑制p38 MAPK磷酸化而减少PLA的表达可能是缺血后适应减少缺血再灌注损伤的新机制。
新近研究证实,PLA对于加深对急性心肌梗死发病机制的认识,指导疾病的诊断和治疗,监测疾病本身的进展等方面具有重要临床意义。在临床上,PLA已经成为急性冠状动脉综合征治疗中的新靶点[7]。血小板和白细胞活化后,其表面的黏附分子增加,黏附分子通过配体相互结合和(或)通过纤维蛋白原在黏附分子之间的桥接作用形成PLA。研究表明,PLA可以作为评价血小板活化和炎症反应的指标,是与P-选择素相比,更加敏感的指标[8,9]。炎症反应是心肌缺血再灌注过程中的常见表现[10],可加重心肌损伤,本实验在缺血再灌注不同时间点观察PLA表达水平,结果提示在大鼠心肌缺血30 min的PLA水平较基础状态明显升高。伴随再灌注时间从30 min~3 h的不断延长,PLA表达水平逐渐升高。由此可见,PLA参与了缺血再灌注损伤过程,并发挥了重要作用。SB203580单独或联合缺血后适应能够显著地降低PLA水平,提示缺血后适应可降低缺血再灌注中的炎症反应,降低PLA水平。
在心肌缺血再灌注时氧自由基和细胞因子的大量释放激活了p38 MAPK,控制多种转录因子的表达活性,但它们激活后是带来了益处还是起到相反的作用尚存在争论。p38MAPK加剧心肌细胞损伤的相关研究表明,心肌缺血时,此信号分子主要通过加重炎症及促进细胞凋亡发挥作用,心肌再灌注后由于氧自由基的大量释放、炎性反应、代谢紊乱等引起心肌新的损伤。心肌缺血和再灌注导致p38MAPK途径的激活,此途径可以使转录因子和胞质蛋白质磷酸化,中性粒细胞和血小板活化增加,加重心肌缺血再灌注损伤。以上提示降低p38MAPK信号途径活性可缓解缺血再灌注损伤,改善心功能。
本实验结果显示在缺血前,各组大鼠p38MAPK水平较低,且各组差异无统计学意义。再灌注后,I/R组和Ani组 p38MAPK的磷酸化水平升高,且再灌注60 min和3 h时,PLA的表达水平明显升高,PLA水平越高,梗死面积越大。SB203580单独或联合缺血后适应使用均有效地抑制了p38MAPK水平的升高,降低PLA水平。说明SB203580可以模拟缺血后适应的心脏保护作用,而p38MAPK激活剂Anisomycin则可部分抵消缺血后适应带来的保护效应;如果单纯给予Anisomycin而不进行缺血后适应干预,则其损伤作用与I/R组类似。这也从侧面证实了缺血再灌注损伤作为一种应激可以激活p38MAPK,进而促进PLA表达水平增加,而缺血后适应则可有效抑制这一过程而减轻缺血再灌注损伤。
综上所述,大鼠心肌缺血再灌注后,PLA表达水平明显升高,p38MAPK 被磷酸化激活,进一步加重了缺血再灌注损伤。给予缺血后适应干预后,心肌磷酸化p38MAPK蛋白的表达降低、PLA水平明显减少,有效地保护了缺血再灌注后的心肌组织,其机制可能与抑制p38MAPK磷酸化有关而减少PLA的表达水平,进而减轻缺血再灌注损伤。
[1]Ono K, Han J. The P38 signal transduction pathway: activation and function[J]. Cell Signal, 2000, 12(1): 1-13. DOI: 10. 1016/S0898-6568(99)00071-6.
[2]Roux PP, Blenis J. ERK and P38MAPK-activated protein kinases: a family of protein kinases with diverse biological functions[J]. Microbiol Mol Biol Rev, 2004, 68(2): 320-340. DOI: 10. 1128/MMBR. 68. 2.320-344. 2004.
[3]Schächinger V, Britten MB, Zeiher AM. Prognostic impact of coronary vasodilator dysfunction on adverse long-term outcome of coronary heart disease[J]. Circulation, 2000, 101 (16) : 1899-1906. DOI: 10.1161/01. CIR. 101. 16. 1899.
[4]董海秋, 董梅, 任法新. 血小板-中性粒细胞聚集体在急性 ST 段抬高型心肌梗死患者中表达的研究[J]. 中国循环杂志, 2017, 32(2):145-148. DOI: 10. 3969/j. issn. 1000-3614. 2017. 02. 008.
[5]谭金习, 董梅, 任法新. 术前血小板-白细胞聚集体水平与STEMI患者急诊PCI术后心肌无复流的相关性[J]. 临床心血管病杂志,2016, 32(5): 455-458. DOI: 10. 13201/j. issn. 1001-1439. 2016. 05.006.
[6]高峰, 刘瑞芳, 阎晓琳, 等. 血小板-白细胞聚集体在急性脑梗死患者及其短期预后的水平变化[J]. 国际检验医学杂, 2017, 38(13):1738-1742. DOI: 10. 3969/j. issn. 1673-4130. 2017. 13. 004.
[7]Michelson AD, Furman MI. Laboratory marker of platelet activation and their cilinical significance[J]. Curr Opin Hematol, 1999, 6(5):342-348. DOI: 10. 1097/00062752-199909000-00012.
[8]Klinkhardt U, Harder S. Flow cytometric measurement of plateletleukocyte aggregates: a possible target to monitor platelet function[J].Sem Thromb Hemost, 2005, 31(4): 400-403. DOI: 10. 1016/S0098-1354(00)00609-8.
[9]Michelson AD, Barnard MR, Krueger LA, et al. Circulating monocyteplatelet aggregates are a more sensitive marker of in vivo platelet activation than platelet surface P-selectin[J]. Circulation, 2001,104(13): 1533-1537. DOI: 10. 1161/hc3801. 095588.
[10]陈冰心, 任澎.心肌缺血再灌注损伤信号分子p38MAPK 的研究进展[J]. 心肺血管病杂志, 2010, 29(1) : 68-70. DOI: 10. 3969/j.issn. 1007-5062. 2010. 01. 021.

