欧李仁提取物体外降糖作用研究
张 玲,张江宁,丁卫英,杨 春,王宇婷
(山西省农业科学院农产品加工研究所,山西太原 030031)
0 引言
α-淀粉酶和α-葡萄糖苷酶是影响体内对碳水化合物消化和吸收的2种关键酶,抑制这2种酶的活性,可以限制胃肠道对碳水化合物的降解和对葡萄糖的吸收,从而可以有效地抑制餐后血糖的快速升高[1-2]。不仅能够调节糖类代谢,又能延缓糖尿病的发生和发展。目前,糖尿病尚无理想的治疗方法,传统的降糖药长期服用会有一定的毒副作用,所以从天然产物中提取高效的α-淀粉酶和α-葡萄糖苷酶抑制剂成为近年来的研究热点[3]。研究表明,具有抑制这2种酶的天然产物中大多都富含黄酮、多酚、多糖等,如杨梅果实酚类物质[4]、海藻多糖[5]、花粉黄酮[6]等。
欧李(Cerasus humilis(Bge.)kernel)为蔷薇科樱桃属,是我国特有的一个古老野生灌木果树树种,其果实富含矿质营养,其中钙含量为当今水果之冠,故又名钙果。欧李果实近年来的开发应用及深加工多集中于果汁、果脯、果酒、果醋等的制备中[7]。果实加工后会产生大量的果仁,而果仁也具有很高的营养和药用价值[8-10]。欧李仁也是我国医书中记载的一种常用药(郁李仁),可治疗津枯肠燥、食积气滞、腹胀便秘、水肿、脚气、小便不利等[11]。对欧李仁提取物降糖作用进行初步研究可为欧李资源的综合利用,以及从天然产物中提取高效的α-淀粉酶和α-葡萄糖苷酶抑制剂的开发与应用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
欧李仁,采自山西农业大学园艺果园;苦杏仁苷、α-淀粉酶、α-葡萄糖苷酶、pNPG(4-硝基苯基-B-D-吡喃葡萄糖苷)阿卡波糖,Sigma公司提供;DNS显色剂和其他试剂均为分析纯。
粉碎机、离心机、756型紫外-可见分光光度计、磁力搅拌器、旋转蒸发仪等。
1.2 试验方法
1.2.1 乙醇和水提取液的制备
称取样粉10 g,分别用200 mL 75%乙醇和水在45℃下磁力搅拌提取3 h,超声波提取20 min,以转速4 800 r/min离心10 min;收集上清液、浓缩并定容至100 mL。
1.2.2 乙醇和水提取液活性成分含量测定
主要包括苦杏仁苷的测定[12]、粗多糖的测定[13]和总黄酮的测定[14]。
1.2.3 对α-葡萄糖苷酶活性抑制能力的测定
参考文献[15]并稍作改动。依次在试管中加入400 μL pH值6.8的磷酸缓冲液,200 μL样品溶液和200 μL α-葡萄糖苷酶溶液(0.13U/L),混匀,于37℃条件下水浴反应15 min,而后加入2.5 mmol/L的pNPG溶液400 μL,继续在37℃条件下水浴反应15 min,最后加入5 mL 0.1 mol/L的碳酸钠溶液终止反应。于波长405 nm处测定其吸光度。以阿卡波糖作为阳性对照,制作标准曲线。
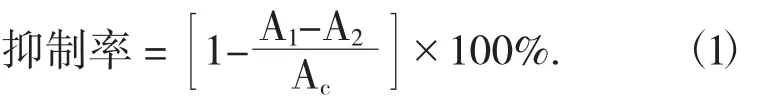
式中:A1——缓冲溶液+α-葡萄糖苷酶溶液+样品溶液+pNPG溶液+Na2CO3溶液;
A2——缓冲溶液+样品溶液+pNPG溶液+Na2CO3溶液;
Ac——缓冲溶液+α-葡萄糖苷酶溶液+
pNPG溶液+Na2CO3溶液。
1.2.4 对α-淀粉酶活性抑制能力的测定
参考文献[16]并稍作改动。将0.5 mL待测样品与0.5 mL的α-淀粉酶溶液加入试管中,在37℃条件下水浴反应30 min,加入1%的淀粉溶液1 mL,继续在37℃条件下水浴反应15 min,水浴反应结束后,立即加入1 mL DNS显色剂,沸水浴5 min后冷却至室温。加入10 mL蒸馏水稀释混匀,于波长540 nm处测定其吸光度。以阿卡波糖作为阳性对照,制作标准曲线。

式中:B1——α-淀粉酶溶液+样品+淀粉溶液+DNS显色剂;
B2——α-淀粉酶溶液+样品+DNS显色剂;
Bc——α-淀粉酶溶液+淀粉溶液+DNS显色剂。
2 结果与分析
2.1 欧李仁提取物活性成分测定
欧李仁提取液活性成分见表1。

表1 欧李仁提取液活性成分/mg·100 mL-1
从表1可以得知,欧李仁乙醇提取液的总黄酮、粗多糖和苦杏仁苷均高于水提取液,尤其是苦杏仁苷含量,乙醇提取液其含量可达62.6 mg/100 mL。
2.2 阿卡波糖对α-淀粉酶和α-葡萄糖苷酶抑制能力的分析
阿卡波糖对α-葡萄糖苷酶抑制率的影响见图1,阿卡波糖对α-淀粉酶抑制率的影响见图2。
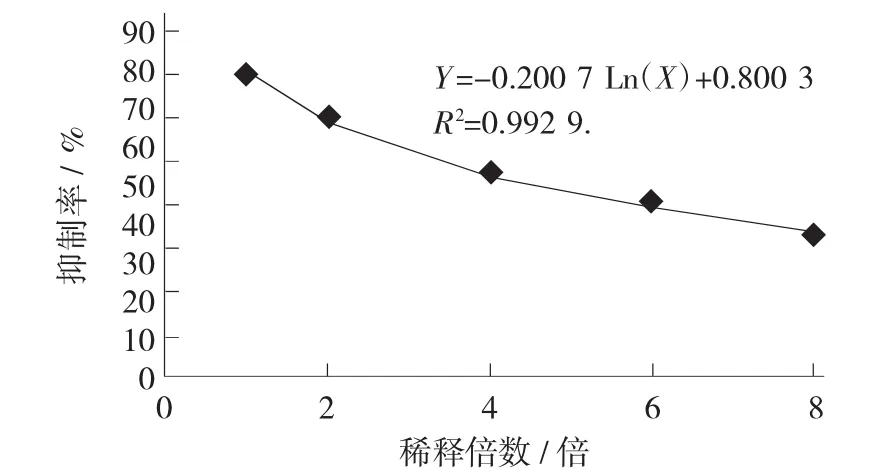
图1 阿卡波糖对α-葡萄糖苷酶抑制率的影响

图2 阿卡波糖对α-淀粉酶抑制率的影响
从图1可知,质量浓度为10 mg/mL的阿卡波糖对0.132 U/mL的α-葡萄糖苷酶抑制率可达到78.89%,随着质量浓度降低,其抑制率也逐渐下降,8倍稀释后其抑制率下降为36.39%。
从图2可知,质量浓度为1 mg/mL的阿卡波糖对1 U/mL的 α-淀粉酶的抑制率可高达93.52%;同样随着稀释倍数的增加,其抑制率也逐渐下降,8倍稀释后其抑制率下降为54.78%。
从图1和图2可以看出,阿卡波糖对α-淀粉酶的抑制率明显高于对α-葡萄糖苷酶的抑制率,此结论与文献[17]的研究结果相同。
2.3 欧李仁提取物对α-葡萄糖苷酶抑制能力的分析
欧李仁不同提取物对α-葡萄糖苷酶抑制率的影响见图3。
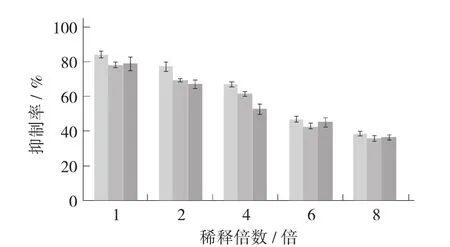
图3 欧李仁不同提取物对α-葡萄糖苷酶抑制率的影响
从图3得知,欧李仁乙醇提取物对α-葡萄糖苷酶的抑制率高于水提物和10 mg/mL的阿卡波糖的抑制率。同样质量浓度下,未经稀释的乙醇提取物对α-葡萄糖苷酶的抑制率可达到80%以上,而水提取物对α-葡萄糖苷酶的抑制率则小于80%,与质量浓度10 mg/mL的阿卡波糖对0.132 U/mL的α-葡萄糖苷酶抑制率相近。随着质量浓度下降,乙醇提取物、水提取物和阿卡波糖对α-葡萄糖苷酶的抑制率也逐渐降低。
2.4 欧李仁提取物对α-淀粉酶抑制能力分析
欧李仁不同提取物对α-淀粉酶抑制率的影响见图4。
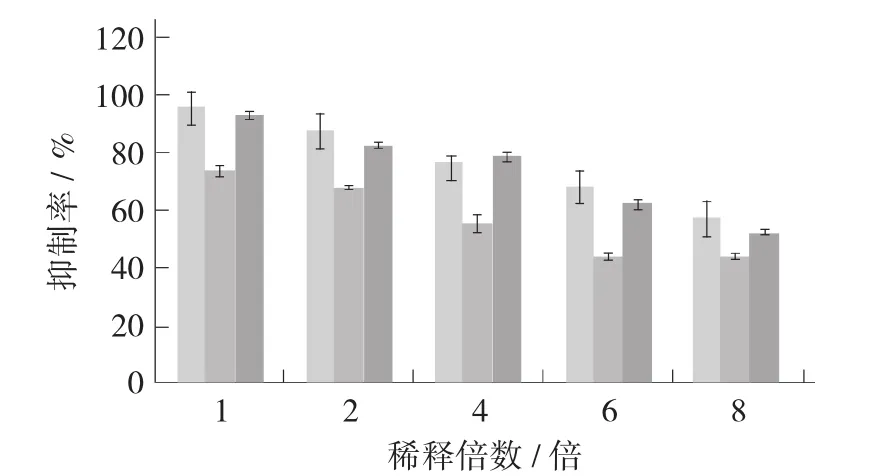
图4 欧李仁不同提取物对α-淀粉酶抑制率的影响
从图4可知,欧李仁乙醇提取物对α-淀粉酶的抑制率明显高于水提物的抑制率。同样质量浓度下,未经稀释的乙醇提取物对α-淀粉酶的抑制率可高达95%以上,而水提取物对α-淀粉酶的抑制率为74%左右,乙醇提取物质量浓度经8倍稀释后,其抑制率还可达到58%左右,相当于0.14 mg/mL左右的阿卡波糖对α-淀粉酶的抑制率,而水提取物同质量浓度下,其抑制率已下降为37%左右。同样,随着质量浓度下降,乙醇提取物、水提取物和阿卡波糖三者对α-淀粉酶的抑制率也逐渐降低。
3 结论
以欧李仁为原料,α-淀粉酶和α-葡萄糖苷酶的抑制率为指标,并以阿卡波糖作为阳性对照,研究其醇提物和水提物的降糖作用。欧李仁活性提取物对α-葡萄糖苷酶和α-淀粉酶都有一定的抑制作用,欧李仁乙醇提取物对这2种酶的抑制率高于水提物,这可能是因为其醇提物中总黄酮、粗多糖、苦杏仁苷等活性成分的含量高于水提物。另外,欧李仁乙醇提取物原质量浓度下对α-葡萄糖苷酶和α-淀粉酶的抑制率为84.05%和95.95%,分别相当于对12 mg/mL左右的阿卡波糖对α-葡萄糖苷酶的抑制率和1 mg/mL左右的阿卡波糖对α-淀粉酶的抑制率,表明欧李仁提取物有一定的降糖作用,其体内降糖机理还有待进一步研究。
[1]Lee B H,Eskandari R,Jones K,et al.Modulation of starch digestion for slow glucose release through“toggling”of activities of mucosala-glucosidasea[J].Journal of Biological Chemistry,2012(38):31 929-31 938.
[2]吕凤霞,陆兆新.α-淀粉酶抑制剂的研究进展 [J].食品科学,2002,23(3):152-155.
[3]屠洁,李前龙.天然产物中α-葡萄糖苷酶抑制剂的筛选研究进展 [J].食品研究与开发,2010,31(9):206-210.
[4]张夏南.杨梅果实酚类物质提取物降糖活性及其相关机理研究 [D].杭州:浙江大学,2015.
[5]宋彦显,闵玉涛,陶敬,等.醇提法提取海藻多糖及其α-淀粉酶的抑制活性研究 [J].食品科技,2014,39(10):232-234.
[6]孙岩,童群义,郭庆兴.油菜蜂花粉黄酮体外降糖活性研究 [J].食品工业科技,2015,36(12):122-126.
[7]刘淑琴,常虹,周家华,等.我国欧李的开发应用研究现状 [J].食品研究与开发,2009,30(12):167-170.
[8]杜俊杰,杨怀毅.山西省欧李资源的分布及类群 [J].作物品种资源,1993(2):6-7.
[9]张美莉,邓秋才,杨海霞,等.内蒙古欧李果肉和果仁中营养成分分析 [J].氨基酸和生物资源,2007,29(4):18-20.
[10]张英,郭宝禹,张玲,等.欧李仁多肽的制备及其对DPPH自由基清除作用的研究 [J].农产品加工,2017(3):6-8.
[11]阴健.中药现代研究与临床应用 [M].北京:中医古籍出版社,1993:253-256.
[12]邬晓勇,孙雁霞,何钢,等.欧李种仁中苦杏仁苷的提取及其抗氧化活性 [J].湖北农业科学,2013,52(19):4 764-4 767.
[13]刘璐,乔宇,汪兰,等.山药多糖的抗氧化作用研究 [J].食品科技,2014,39(12):212-216.
[14]Kelly Wolfe,Xianzhong Wu,Ruihai Liu.Antioxidant activity of Apple Peels[J].Journal of Biological J.Agric.Food Chem,2003(5):609-614.
[15]苏尧尧.垂柳叶α-葡萄糖苷酶抑制剂的分离及活性研究 [D].无锡:江南大学,2014.
[16]叶琼仙,刘静,苗爱清,等.白叶单枞黑茶抗氧化及体外降血糖活性研究 [J].食品工业科技,2014,35(16):153-157.
[17]张煜.扁枝槲寄生提取物体外抗氧化、降糖、降脂效应研究 [D].昆明:云南农业大学,2016.◇

