一种鸭病毒的分离及鉴定
孙 心,梁宛楠,姜 宇
(哈药集团生物疫苗有限公司,哈尔滨 150069)
鸭病毒性肝炎(DVH)是幼龄雏鸭的一种高度致死性急性传染病,特征是发病急、传播快、死亡率高,临诊表现角弓反张,病理变化为肝炎和出血[1]。该病常给养鸭场造成严重的经济损失。鸭肝炎病毒共分为3个血清型,分别是血清型Ⅰ、Ⅱ和Ⅲ型,3个型相互之间无抗原相关性[2]。本试验通过对江苏省某发病的养鸭场进行病料采集,分离病毒并通过中和试验,RT-PCR试验等试验进行鉴定。
1 试验材料
SPF鸭胚及SPF鸭(哈尔滨兽医研究所);Ⅰ型鸭肝炎病毒阳性血清、Ⅲ型鸭肝炎病毒阳性血清;焦碳酸二乙酯(DEPC)、dNTP、rTaq酶、胶回收试剂盒、质粒提取试剂盒以上均为宝生物有限公司;PMD18-T载体、感受态细胞(DH5ɑ)(Pro⁃mega公司);注射用青霉素钠(哈药总厂);注射用硫酸链霉素(山东鲁抗限公司)。
2 试验方法
2.1 病料采集及其处理
无菌采集江苏省某鸭场病死雏鸭的肝、脾组织,剪碎磨细,用灭菌生理盐水按1∶5稀释成混悬液,过滤后收取滤液,加入氯仿(终浓度为5%),振荡15 min后,3 000 r·min-1离心20 min,收集上清液,加入双抗,做为分离接种样品,并保存于-70℃冰箱备用。
2.2 病毒分离培养
取分离的样品进行培养。用灭菌生理盐水做100倍稀释,经尿囊腔接种10日龄鸭胚,每胚0.2 mL,置37℃孵化,观察至168 h。弃去24 h以前死亡的鸭胚,收集24~72 h死亡的鸭胚,无菌吸取鸭胚液,-20℃保存备用,并观察鸭胚的病变。
2.3 病毒鉴定
2.3.1 鸭胚中和试验
将病毒液用生理盐水稀释至200ELD50/0.2mL,与等量抗鸭肝炎病毒血清Ⅰ型特异性血清混合,置37℃水浴中和1 h。同时设病毒对照(病毒液与等量生理盐水混合)。中和组和对照组经尿囊腔各接种10日龄SPF鸭胚5枚,每胚0.2 mL,在37℃孵育观察168 h,记录鸭胚死亡情况。
2.3.2 病毒PCR法检测
病毒核酸的提取采用SDS-蛋白酶K方法提取鸭胚液中的病毒核酸,然后用TE液悬浮,-20℃保存备用。参考有关资料进行设计引物,扩增VP1-VP3区段蛋白基因,大小为7 144 bp;上游引物P1: 5'-GGTGATTCTAACCAGTTGGG-3'; 下 游 引物 P2:5'-TTCAATTTCCAGATTGAGTTC-3';引物由生工生物工程(上海)股份有限公司合成,用灭菌去离子水将引物溶解并稀释至20 pmol·μL-1。PCR扩增反应体系(50.0 μL)为 10×PCR buffer 5.0 μL;dNTP 4.0 μL;上游引物 1.0 μL;下游引物 1.0 μL;灭菌去离子水35.0 μL;DNA模板 3.0 μL;rTaq酶1.0 μL。PCR扩增反应条为95℃预变性5 min,94℃变性1 min,55℃退火1 min,72℃延伸1 min,30个循环后,72℃延伸10 min,4℃终止循环,将扩增得到的产物于1%琼脂糖凝胶中电泳,电流30 mA,电压100 V,25 min,同时与DNA Marker DL2 000进行比较,即可得出试验结果[3]。
2.3.3 VP3基因序列分析
将PCR扩增的病毒VP1基因在16℃下连接到PMD18-T载体上,连接体系为:PMD18-T载体0.5 μL、SolutionⅠ15 μL、目的片段4.5 μL。连接时间为15 h,再将获得的产物10 μL全部加入100 μL的感受态细胞DH5α中,于37℃摇床培养1 h,涂布于AMP+LB固体培养基上,37℃培养6~18 h,挑取白色菌落于LB液体培养基中,37℃扩增培养12 h,用试剂盒提取质粒,鉴定阳性后,将含有阳性重组子的菌液寄送生工生物工程(上海)有限公司进行测序,应用DNAStar和MEGA4.0软件进行核苷酸序列分析。获得的序列与标准株及genebank上公布的部分分离株进行比对。参考序列见表1。
2.3.4 动物回归实验
取分离样品,做10倍稀释,取4日龄SPF雏鸭20只,分成两组,第1组每只颈部皮下注射江苏株病毒液0.2 mL;第2组不接种病毒作为对照,观察并记录雏鸭临床表现及死亡情况。
3 试验结果
3.1 鸭胚分离培养结果
鸭胚分离培养结果见表2。鸭胚病变情况见图1~2。
由表2可知,分离的病毒经鸭胚传代培养F2代以后,全部鸭胚于30~72 h死亡,对照组无死亡。剖检鸭胚可见鸭胚全身出血见图1,肝脏变性见图2,对照组鸭胚无明显变化。
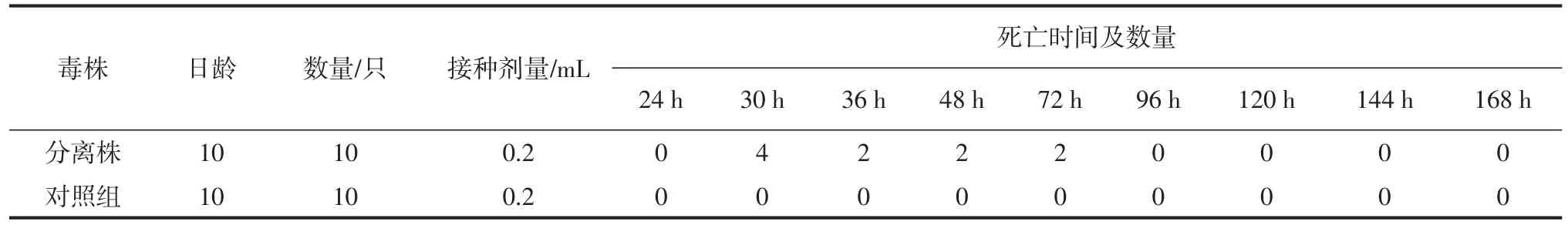
表2 鸭胚死亡结果
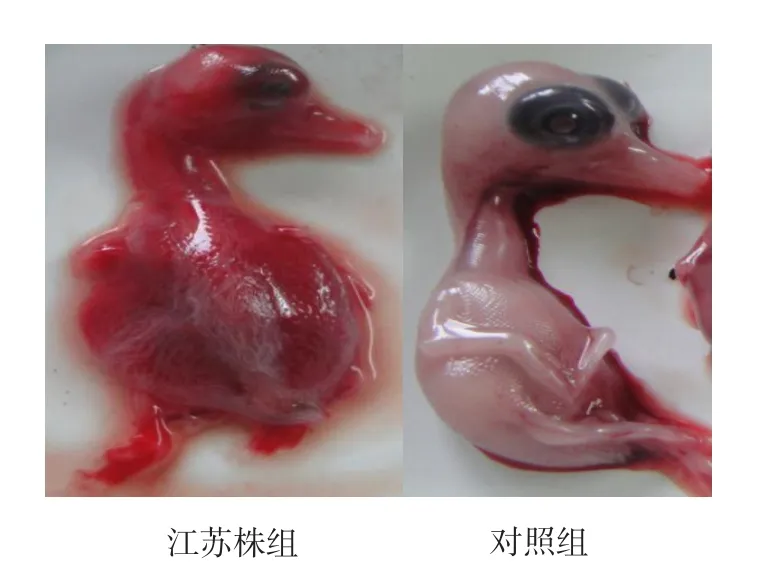
图1 接种后鸭胚死亡情况
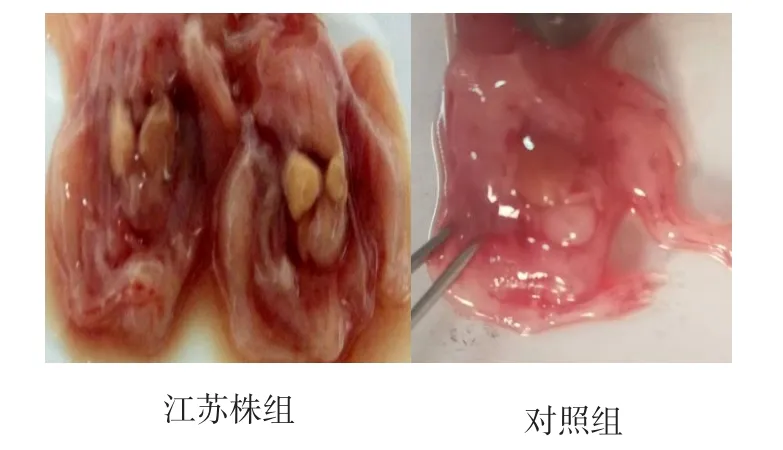
图2 鸭胚肝脏病变
2.2 鸭胚中和试验结果
交叉中和试验结果见表3。
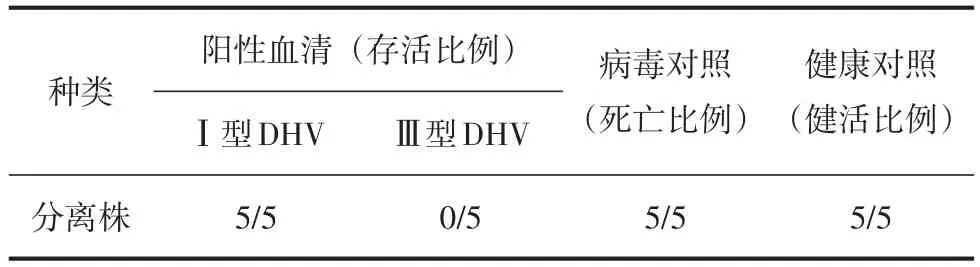
表3 标准血清交叉中和试验结果
由表3可知,分离株可被Ⅰ型DHV标准阳性血清完全中和,Ⅲ型DHV阳性血清对分离株无中和作用。剖检死亡鸭胚均呈胚体水肿、出血,肝脏出血等典型病变,存活鸭胚均无病变。
2.3 分离病毒的PCR检测
分离病毒的PCR检测见图3。
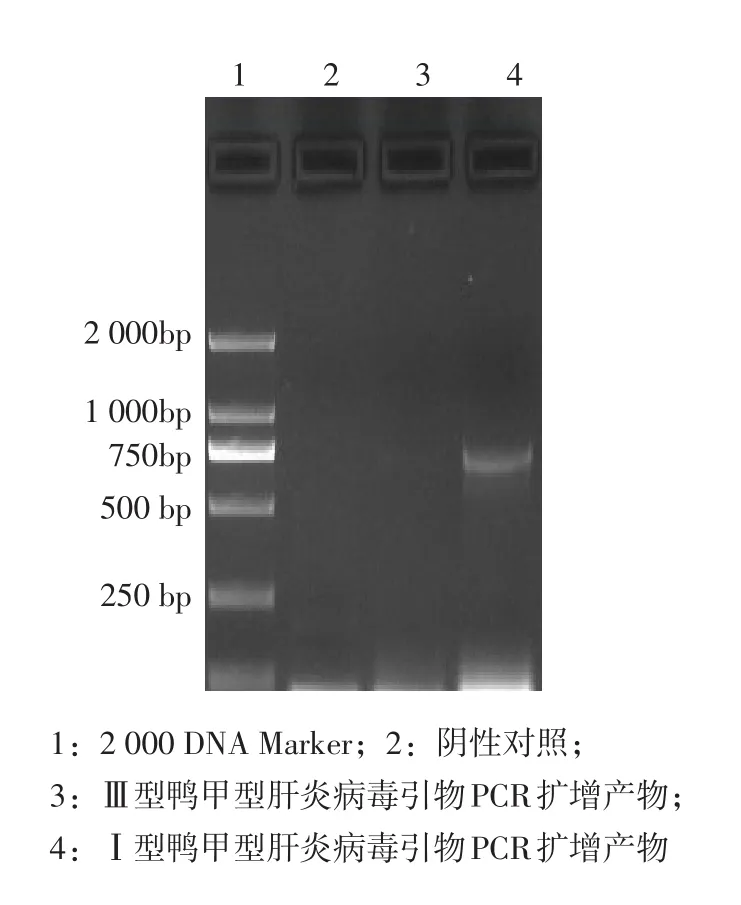
图3 PCR检测图
由图3可知,通过Ⅰ型鸭肝炎病毒特异性引物和相应的RT-PCR试验,经1%琼脂糖凝胶电泳,约在714 bp处出现了特异性的DNA条带。
将特异性条带链接T载体后送到上海生工进行测学,所得到的结果在GenBank进行比较,发现与DRL-62同源性高达97.1%。可判定分离毒为Ⅰ型鸭甲型肝炎病毒。
2.4 动物回归实验
2.4.1 雏鸭死亡情况
雏鸭死亡情况见表4。
由表4可知,分离株10倍稀释的病毒液,每只0.2 mL,接种4日龄SPF雏鸭10只,观察期内雏鸭90%死亡。
2.4.2 雏鸭临床表现
雏鸭临床表现见图4。
由图4可知,接种分离株的死亡雏鸭呈现DVH典型症状角弓反张,雏鸭剖检可见肝脏出血、肿大和变性,对照组雏鸭健康。
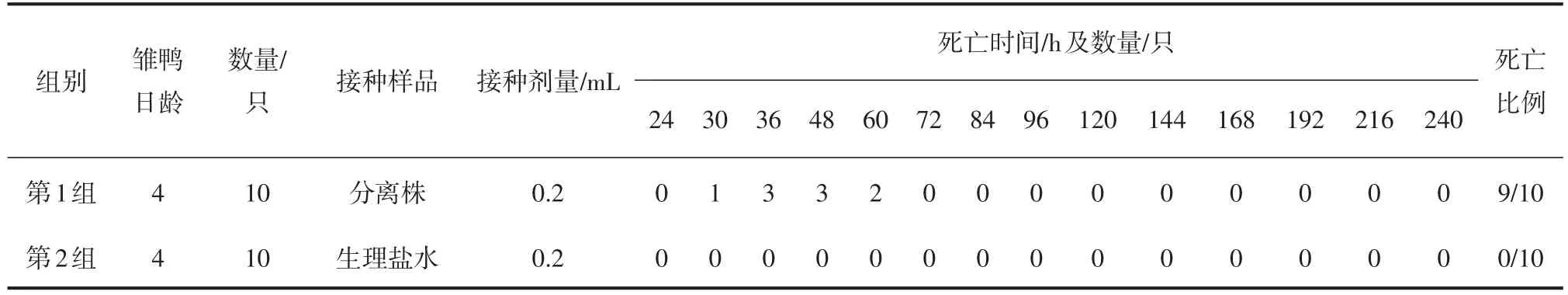
表4 雏鸭死亡情况
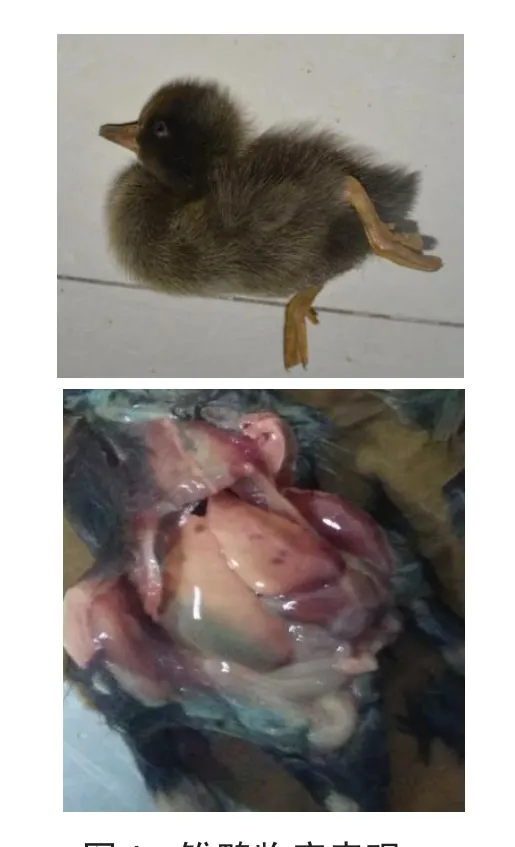
图4 雏鸭临床表现
4 讨论
病毒的分离首先将疑似带有病毒而待分离的标本,例如发生病变的组织经过处理后接种于细胞或敏感的试验宿主进行培养,培养一段时间后,通过检查病毒特异性病理表现或用其他方法来肯定病毒的存在。不同病毒的繁殖方式不同,DHV通过在鸭胚内培养增殖后,鸭胚死亡,剖检鸭胚发现肝脏肿大并有出血点、肝上有坏死病灶,因此可以进行初步的判断。其次通过动物回归试验进行鉴定,DHV多易感染雏鸭,特别是1~2周龄,死亡快,并且病鸭呈现角弓反张等症状,因此临床上对该病的判断十分容易。初步确定病毒种属后,鉴别DHV的血清型。虽然国内外已设计了多种不同的方法检测DHV抗原或抗体,不过截止到目前,中和试验依旧是鉴定DHV的主流方法;使用DHV抗血清免疫雏鸭后再通过待检毒株攻毒,也能够达到鉴定待检病毒的效果。然而,如果待检病毒中存在多种血清型,那么中和试验依旧是首选之法。最后运用分子生物学实验,将分离得病毒用试剂盒提取RNA并反转录成cDNA,通过设计特异性引物进行RT-PCR,核酸电泳观察电泳结果,判断分离病毒与已知病毒之间的同源性,得出结论,再进行基因序列分析,构建进化树进行系统鉴定[4]。RT-PCR检测技术具有灵敏度高、简便、快速、安全等特点,易于推广,对标本的纯度要求较低,无需分离病毒即可检测[5]。
本试验通过接种鸭胚,病料经尿囊腔连续传代死亡率均达100%,其死亡时间主要集中在72~90 h,接种的鸭胚均能呈现鸭病毒性肝炎的典型症状。同时将分离毒株F2含毒尿囊液接种4日龄雏鸭,引起雏鸭发病并在3 d内全部死亡,临床症状表现为角弓反张剖检发现肝脏出血肿大,与陈溥言研究结果大体一致[1]。因此可以初步判定分离的流行株属于鸭肝炎病毒。通过中和试验发现分离株与Ⅰ型特异性血清混合后接种鸭胚不死亡,与Ⅲ型特异性血清混合后接种鸭胚全部死亡,通过实验可以表明江苏病毒株为Ⅰ型DHV,对血清型也得到初步的结论。为了更有效的验证,本试验进行分子生物学检测,分析每种类型毒株的VP1碱基序列或者aa序列的相似程度,就可以对DHV所属的血清型进行判断[6]。Chen等研究表明,按照检测到的DHV-1对应的RNA碱基分布,借助Rre⁃mier5.0制备出相应的上下游引物,公布了用于检测DHV的RT-PCR技术[7]。通过提取病毒培养液中的RNA,根据GenBank中收录的DHV基因序列,针对保守区域设计一对引物,经过一系列反应扩增出预期的特异性条带。利用DNAStar软件与标准毒株及genebank上公布的部分与分离株进行对比分析并构建进化树,表明分离株为Ⅰ型DHV。本试验通过从当地疫情分离出病毒进行鉴定,为以后开展该病的防控提供依据。
[1] 陈溥言.兽医传染病学(第五版)[M].北京:中国农业出版社,2006.
[2] 冯永胜,衣服德,陈正平.鸭病毒性肝炎病毒的分离与鉴定[J].山东畜牧兽医,2014,35(6):54-55.
[3] 耿昕颖,刘艳萍,张福君,等.鸭肝炎病毒PCR-ELISA检测方法的建立[J].中国兽医科学,2016,46(2):161-166.
[4] 于新友,李天芝,沈志强.分子生物学技术在鸭肝炎病毒检测中应用研究进展[J].家禽科学,2015(9):51-54.
[5] 胡成,朱善元,左伟勇,等.鸭Ⅰ型肝炎病毒一步法RT-LAMP可视化快速检测方法的建立[J].江苏农业学报,2015(3):613-618.
[6] 张建坡.新型鸭肝炎病毒的分离鉴定及生物学特性分析[D].杨凌:西北农林科技大学,2014.
[7] Chen L L,Xu Q,Zhang R H,et al.Improved duplex RT-PCR as⁃say for differential diagnosis of mixed infection of duck hepatitis A virus type 1 and type 3 in ducklings[J].Journal of Virological Methods,2013,192(1-2):12-17.

