流式荧光发光法及其改进技术的临床多肿瘤标志物样本结果对比分析及评价
赵 虹,姚 华,张海山
(吉林大学中日联谊医院,吉林 长春130033)
肿瘤标志物(Tumor Marker,TM)是一种由肿瘤细胞产生和释放,以抗原、酶或激素等代谢产物的形式存在于肿瘤细胞内或体液中的物质[1]。由于肿瘤细胞的生化性质及代谢情况与健康细胞相比表现异常,因此在人的体液、排除物及组织中,肿瘤标志物会出现质或量上改变的,故根据其生化或免疫特性可以识别或诊断肿瘤的状况。临床上肿瘤标志物检测主要应用于对正常人群健康查体与原发肿瘤的及时发现、肿瘤高危人群的筛选、良性和恶性肿瘤的鉴别诊断、肿瘤发展程度判断、肿瘤治疗效果观察评价、肿瘤复发和预后监测等[2,3]。
肿瘤标志物可分为肿瘤细胞分泌物和肿瘤细胞表达物两类[4]。前者是肿瘤细胞在发生发展中产生的物质,与肿瘤发展程度正相关;后者则是肿瘤细胞膜或细胞内结构上的某些特殊结构点,在肿瘤细胞表面表达多、正常细胞表面表达少,同时与某些药物能进行特异性识别与结合,是可作为药物靶点的一类标志物[5]。肿瘤细胞分泌物由于能分布在外周血清中,样本容易获得,检测方法相对成熟简单,因此临床上主要对肿瘤细胞分泌物进行检测。而由于大部分单个标志物敏感性或特异性偏低,不能满足临床上的需求,因此理论上和实践上都提倡对患者进行多项标志物的联合筛查。多肿瘤标志物联合应用可提高检测结果的特异性与准确性及敏感性,更有助于亚临床肿瘤患者的发现及预后分析。表1中介绍了常见肿瘤疾病与相关肿瘤标志物的关系。

表1 肿瘤与其主要相关的肿瘤标志物
现常用的肿瘤标志物检测方法有酶免疫分析法、时间分辨荧光法、化学发光法、放射免疫法、电化学发光法、液态芯片法等[6-8]。流式荧光发光法,又称液态芯片技术,是美国Luminex公司于本世纪初研制出的后基因组时代技术平台,基于多功能流式点阵仪的悬浮阵列技术,使其成为一个多功能、多指标并行的分析系统[9]。它有机地整和了编码微球(color-coded beads)、激光技术、应用流体学、高速数字信号处理与计算机运算法则,造就了高度的检测特异性和灵敏度,可广泛应用于免疫分析、核酸研究、酶学分析、受体和配体识别分析等研究。是目前美国食品与药品管理局(FDA)批准,唯一得到权威机构和医学界共同认可用于临床检验诊断的生物芯片平台。
该技术的检验原理为双抗体夹心流式荧光免疫检测法[10,11]。将针对各种抗原的捕获抗体通过共价交联的方式包被在荧光编码微球上,制成微球悬液,,当血清中样本在37℃反应后,加入经藻红蛋白(R-phycoerythrin,PE)的检测抗体溶液,再次经37℃孵育后,最终形成(微球-捕获抗体)-抗原-(检测抗体-PE)的复合物。检测时,使单个的微球通过检测通道,并使用双色激光同时对微球上的两种荧光信号进行检测。一束激光判定微球的编码,从而决定被测物质的种类;另一束激光测定微球上PE的荧光强度,从而反映被测物质的含量。该技术所需样本量少,并实现了高通量、高速检测多项肿瘤标志物的目的,且具有灵敏度高、线性范围广、重复性好、成本低、操作方便等特点,已逐渐在临床中广泛应用。
通常检测微球采用聚苯乙烯(polystyrene)制作,粒径为5.6 μm,且仪器需至少捕获100微球才能准确测定相关项目。经过技术改进后,应用于Tesmi F3999的全自动检测试剂盒中的编码微球采用磁性材料,能够使编码微球更顺利通过检测仪器,只需30微球数即可进行检测,使试剂盒中的每项检测指标的读数时间可控制在30s以内,进一步缩短了检测时间。仪器设置全封闭试剂槽,并具有实时涡旋混匀系统,使微球悬液组成更加均一稳定;增设密封胶垫防试剂挥发同时可以隔绝外源物质对试剂可能造成的污染,可进一步保证检测数值的稳定性与准确性。且仪器在检测过程中增加了实时清洗步骤,可进一步减少血清学检测中的干扰项目,如甘油三脂、高胆红素血症、溶血(血红蛋白)等的影响,延长检测仪器的使用寿命同时扩大了样本的适用检测范围。通过改进技术升级后,流式荧光发光法将能够更加广泛的应用到临床检测当中。
本文采用国家卫生计生委临床检验中心批号为201712和201723的临床室间质控样品,分别用Luminex 200半自动检测仪器及对应试剂盒与Tesmi F3999全自动检测仪器及对应试剂盒分别进11种多肿瘤标志物检测,评价两种检测方式的准确性。用同一混合血清样本进行连续10次测定,评价检测稳定性。同时对临床样本42例,其中男性22例,女性20例。用配置Q-Hand智能加样臂的Luminex 200 半自动检测仪器和改进技术后的Tesmi F3999的全自动检测仪器,分别进行12项(男性)和10项(女性)的多肿瘤标志物联合检测,包括鳞状细胞癌抗原 SCCA,糖类抗原 CA19-9,糖类抗原 CA15-3,游离/总前列腺特异抗原 T-PSA/F-PSA,甲胎蛋白AFP,肿瘤相关糖类抗原 CA24-2,血清癌胚抗原CEA,神经元特异性烯醇化酶 NSE,游离β亚单位人绒毛膜促性腺激素 Free-β-HCG,细胞角蛋白19片段CYFRA21-1,癌抗原CA125,本文重点对两种实验的稳定性与结果进行分析评价。结合临床信息,讨论临床意义及推广可行性。
1 材料与方法
1.1 实验仪器及试剂
使用仪器为Luminex 200多功能流式点阵仪(Luminex公司,美国)配置Q-Hand半自动加样系统,以及Tesmi F3999全自动检测系统(上海透景生命科技股份有限公司)。使用检测试剂盒为两种仪器相应配套试剂,均为上海透景公司生产(批号:半自动仪器检测试剂批号/全自动仪器检测试剂批号):多肿瘤标志物(7种)检测试剂盒(国食药监械(准)字2016第3400541批号:LP110280Z-160901/LP120280-170102)糖类抗原19-9定量检测试剂盒(国食药监械(准)字2013第3400427批号:LP110530G-160901/ LP121110-161101)鳞状细胞癌抗原检测试剂盒(国食药监械(准)字2013第3400430批号:LP110530G-160901/LP121160-170101)游离/总前列腺特异抗原检测试剂盒(国食药监械(准)字2016第3400544批号:LP110530G-160901/LP120050-161002)糖类抗原15-3定量检测试剂盒(国食药监械(准)字2013第3400428批号:LP111020A-160901/ LP121020-161201)。
1.2 实验样本
本文临床样本来源为吉林大学中日联谊医院。选取42例临床样本,其中男性22例,女性20例。男性样本平均年龄70.8岁;女性样本平均年龄66.3岁。
男性患者样本进行12项多肿瘤标志物联合检测,女性患者样本进行10项多肿瘤标志物联合检测,另外选取一份混合样本进行实验稳定性测试。用卫生计生委临床室间质控品201712,201723对两种方法的准确性进行评价。
1.3 检测方法
Luminex 200半自动检测方法:使用前充分混匀各种试剂,在96孔反应板中每孔依次加入反应缓冲液(A)25 μl及血清样本10 μl,其中糖类抗原15-3(CA15-3)检测需用抗原稀释液(E)将血清样本稀释20倍后加入10 μl;震荡混合20 s后,加入PE标记的二抗溶液(B)25 μl;震荡20 s后反应5 min,即加入微球悬液(C)25 μl,再次震荡20 s混匀,随后37℃反应1 h;反应结束后加入终止液(D)100 μl,充分混匀后于2 h以内以Luminex 200流式点阵仪进行检测。
Tesmi F3999全自动检测方法:在反应杯中依次加入反应缓冲液(A)20 μl,血清样本20 μl,其中糖类抗原15-3(CA15-3)检测需用抗原稀释液(E)将血清样本稀释40倍后,按20 μl加入;随后加入微球悬液(B)20 μl,加样结束后充分混匀,置于37℃后避光反应25 min;加入荧光标记的二抗溶液(C)20 μl于37℃继续反应15 min,反应结束后加终止液(D)80 μl,由检测仪器Tesmi F3999检测并计算实验结果。
2 结果
检测微球通过鞘流液携带至检测区,微球混悬液从毛细管喷出,同时与四周流出的鞘液一起流过检测区,微球混悬液在中间形成单个排列的微球流束,四周被鞘液围绕。通过激光识别至不同的白色斑点区域,当仪器捕获足够数量编码微球后,将进行荧光定量分析,获得定量检测结果。
2.1 多项肿瘤标志物检测标准曲线
两种检测仪器获得的12项肿瘤标志物的标准曲线及线性相关系数(R)如表2所示,结果可以看出,改进技术后的Tesmi F3999全自动分析系统,其获得的标准曲线的线性相关性更为优良。

表2 流式荧光发光法获得标准曲线
2.2 稳定性实验
选取同一混合血清样本,分别用Luminex 200 和Tesmi F3999进行半自动与全自动加样检测。连续测定10天,实验结果如表3所示。两种实验结果的相对标准偏差RSD <10%,稳定性符合检测相关标准,技术改进的Tesmi F3999全自动流式荧光检测方法的相对标准偏差更低,说明其检验结果的稳定性更好。
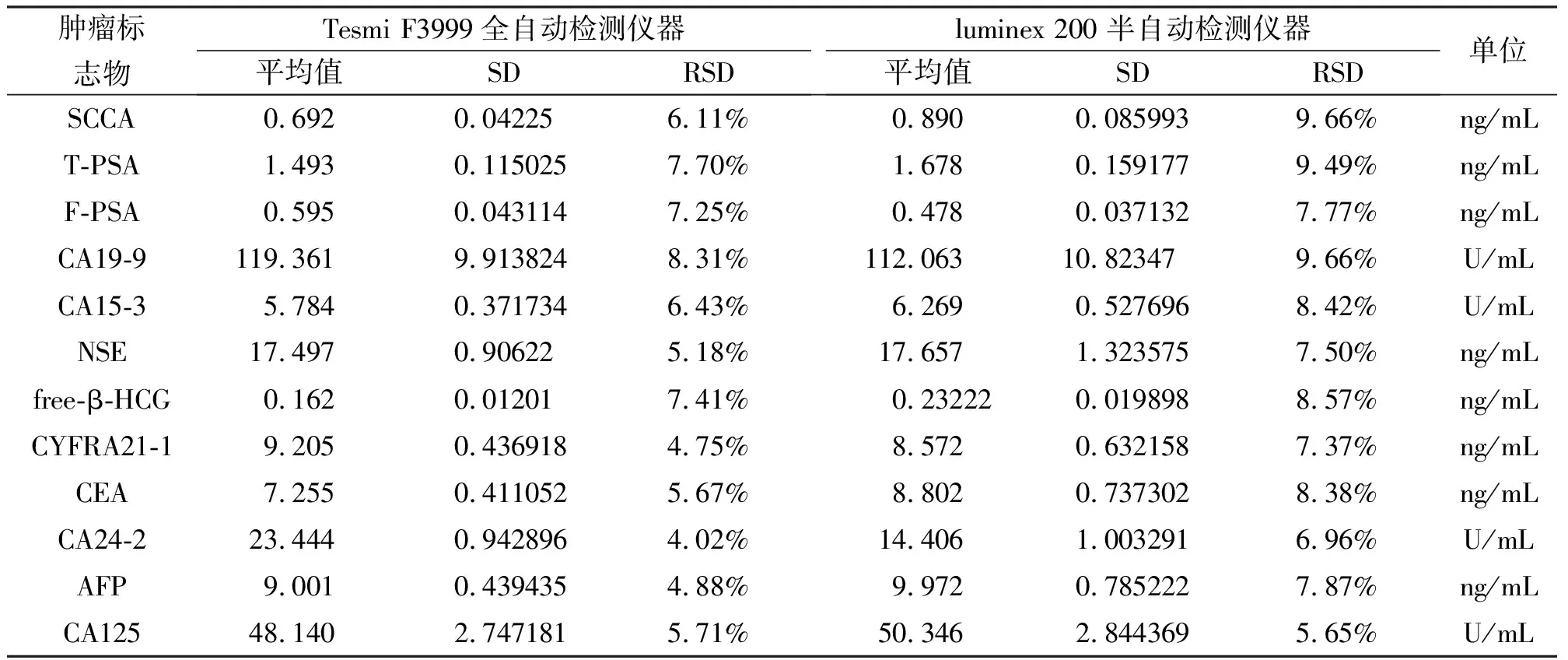
表3 两种仪器流式荧光发光法稳定性分析
2.3 准确性实验
质控样本为国家卫生计生委临床检验中心2017室间质评样本201712和201723。质控样本为高低两种浓度,分别用Luminex 200 和Tesmi F3999,共进行11项肿瘤标志物检测,实验重复3次。结果如表4所示。两种实验仪器的流式荧光发光法结果皆能保证测定结果相对标准偏差RSD<10%,与半自动检测的Luminex 200检测结果相比,改进技术后的Tesmi F3999检测结果相对标准偏差更小,说明准确度有所提升。
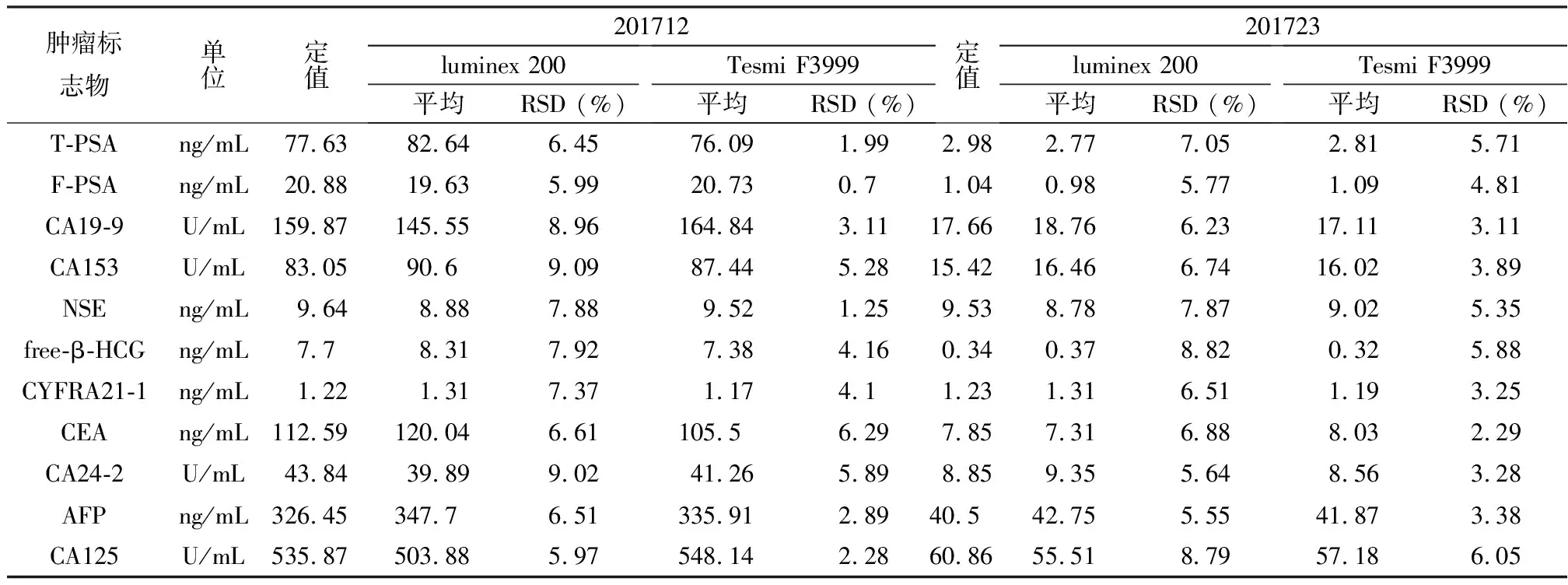
表4 两种仪器检测方法准确性实验结果
2.4 临床样本检测结果分析
对所有42例临床样本分别进行的Luminex 200(原技术)和Tesmi F3999(改进技术)两种方式流式荧光发光法检测。阳性检出项的实验结果如表5所示。42例样本中男性样本22例,女性样本20例;消化系统肿瘤及相关疾病样本17例,呼吸系统肿瘤及相关疾病14例,肾病及相关肿瘤6例;其他样本数。从12项(男性)和10项(女性)多肿瘤标志物联合检测结果上看,两种方式的阳性检出项基本相同。两种流式荧光检测技术对临床样本表现了优良的特异性,证明了肿瘤标志物在实际临床应用上能够发挥其重要意义,辅助肿瘤的判断和相关治疗。

表5 临床样本流式荧光法检测结果分析(阳性检出项)
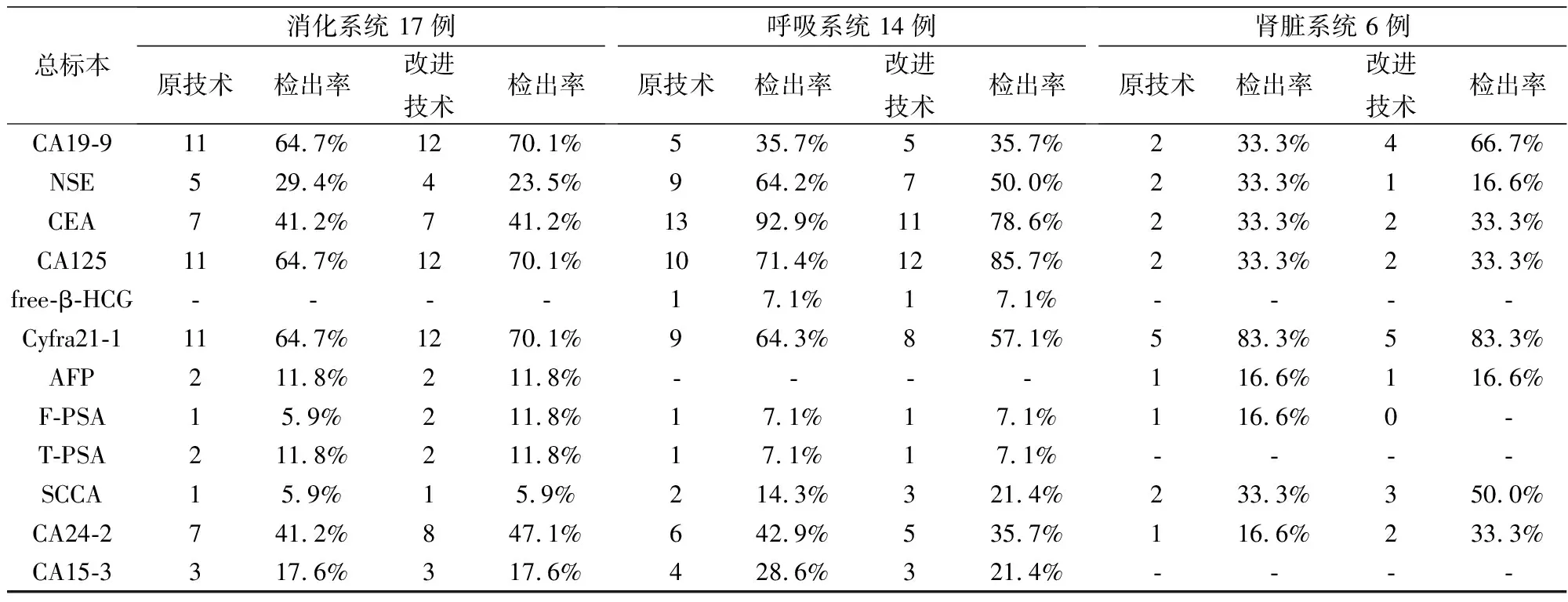
总标本消化系统 17例原技术检出率改进技术检出率呼吸系统 14例原技术检出率改进技术检出率肾脏系统 6例原技术检出率改进技术检出率CA19-91164.7%1270.1%535.7%535.7%233.3%466.7%NSE529.4%423.5%964.2%750.0%233.3%116.6%CEA741.2%741.2%1392.9%1178.6%233.3%233.3%CA1251164.7%1270.1%1071.4%1285.7%233.3%233.3%free-β-HCG----17.1%17.1%----Cyfra21-11164.7%1270.1%964.3%857.1%583.3%583.3%AFP211.8%211.8%----116.6%116.6%F-PSA15.9%211.8%17.1%17.1%116.6%0-T-PSA211.8%211.8%17.1%17.1%----SCCA15.9%15.9%214.3%321.4%233.3%350.0%CA24-2741.2%847.1%642.9%535.7%116.6%233.3%CA15-3317.6%317.6%428.6%321.4%----
3 讨论
本文通过流式荧光发光法对42例临床样本进行多肿瘤标志物的实验检测,分别使用Luminex 200及Tesmi F3999两种检测仪器及配套试剂盒。实验结果说明,改进技术的全自动Tesmi F3999检测方法所获得的实验结果,获得的实验数据稳定性更强,准确度更高,能够更好的应用于临床检测。另外Tesmi F3999配套的检测试剂中的编码微球由聚乙烯微球改进为磁性微球,;全密封试剂仓除有效保证试剂不会被外源物质污染之外,还能对检测试剂进行实时涡旋混匀,保证微球悬液的稳定性,从而提高微球识别及检测速度,降低检测误差。另外,Tesmi F3999全自动检测方法对检测速度大幅的提高,最高可达到120样本/h,检测效率几乎是目前传统化学发光仪器的10倍以上。临床42项实例反应出的结果也说明,流式荧光发光法,即液态芯片及其改进技术,具备阳性指标检出灵敏性,有利于临床进行高通量的多项肿瘤标志物联合筛查,有助于正常人群健康查体与原发肿瘤的及时发现、肿瘤高危人群的筛选、良性和恶性肿瘤的鉴别诊断,是肿瘤发展程度判断、肿瘤治疗效果观察评价、肿瘤复发和预后监测的有效手段。
参考文献:
[1]赵士艳,聂秀利,杨 莉,等.肿瘤标志物研究进展[J].标记免疫分析与临床,2011,18(1):59.
[2]马 玉,马雅静,李旭哲,等.健康体检人群肿瘤标志物的异常状态:分子水平肿瘤早期筛查的临床意义[J].临床与实验病理学杂志,2017,33(1):12.
[3]张红军,顾 兴,刘 伟,等.肿瘤标志物动态变化在肺癌疗效判断与随访中的意义[J].中华肺部疾病杂志电子版,2016,1:26.
[4]Nagpal M,Singh S,Singh P,et al.Tumor markers:A diagnostic tool [J].Natl J Maxillofac Surg,2016,7(1):17.
[5]Sahibzada HA,Khurshid Z,Khan RS,Naseem M,Siddique KM,Mali M,Zafar MS.Salivary IL-8,IL-6 and TNF-α as Potential Diagnostic Biomarkers for Oral Cancer [J].Diagnostics (Basel),2017,7(2):pii:E21.
[6]顾克东,张雅青.肿瘤标志物的最新研究技术及其临床检测方法[J].西北民族大学学报(自然科学版),2005,26(3):85.
[7]黄 琛,汤汉红,王敏民.蛋白质芯片技术与电化学发光技术检测多肿瘤标志物结果的评价[J].天津医药,2008,36 (12):942.
[8]王桂莲,朱利国,黄 飚,等.甲胎蛋白、癌胚抗原时间分辨荧光法与化学发光法比较[J].南通大学学报(医学版),2000,20 (2):159.
[9]张保强,张 晓.Luminex液态芯片在临床及科研中的应用[J].当代医学,2012,18(4):18.
[10]Biagini RE,Sammons DL,Smith JP,MacKenzie BA,Striley CA,Semenova V,Steward-Clark E,Stamey K,Freeman AE,Quinn CP,Snawder JE.Comparison of a multiplexed fluorescent covalent microsphere immunoassay and an enzyme-linked immunosorbent assay for measurement of human immunoglobulin G antibodies to anthrax toxins[J].Clin Diagn Lab Immunol,2004,11(1):50.
[11]王美瑶,张 琪,佘金雄.流式荧光免疫技术在血清蛋白质分析中的应用[J].临床检验杂志,2010,28(4):255.

