HIF-1α、TGF-β表达与尿路移行上皮癌进展的相关性分析
王民增,徐俊楠,韩 勇,白雪娟,李聪然,李 响*
(1.玉田县人民医院 泌尿外科,河北 玉田064100;2.解放军第309医院 泌尿外科,北京100091;3.解放军第309医院 病理科,北京100091)
细胞代谢旺盛的肿瘤细胞经常面临细胞微环境的缺氧,后者诱导HIF-1α上调,通过改变代谢方式、诱导血管新生,增加血管通透性等环节克服缺氧环境;同时缺氧上调转换生长因子(transforming growth factor,TGF-β)的表达,诱导肿瘤细胞发生上皮间质转换(epithelial-mesenchymal transition,EMT),在间质浸润、远处转移和肿瘤耐药基因蛋白的表达等方面发挥重要的调控作用。新近研究显示TGF-β是该信号途径的重要因子,但是在尿路移行上皮癌中的表达以及与上皮间质转换的关系少见报道。因此本实验选择不同病变阶段的尿路移行细胞肿瘤,利用组织芯片和免疫组化技术检测组织中HIF-1α、TGF-β的表达,为尿路移行上皮癌研究和临床治疗提供新的分子靶点。
1 材料与方法
1.1临床资料收集解放军第309医院2011年1月-2016 年12月间经尿道膀胱肿瘤电切术和腹腔镜膀胱癌根治性切除术切除的尿路移行上皮癌标本90例,其中,男51例,女39例,平均年龄63(45-74)岁。低级别移行上皮癌30例(浸润浅肌层24例,深肌层6例)、高级别移行上皮癌浸润浅肌层和深肌层各30例;外生型肿瘤64例,内生型肿瘤26例;肿瘤直径≤4 cm 65例,大于4 cm共25例; TNM分期Ⅰ+Ⅱ期56例,Ⅲ、Ⅳ期34例;淋巴结转移31例,无淋巴结转移59例;脉管内癌栓阳性40例,无脉管内癌栓50例。
1.2尿路移行上皮癌组织芯片的构建复习HE切片并再次确诊具体切片,在相应蜡块上打点标记目标组织 1-2处,解放军第 309医院病理科制作组织芯片:用组织芯片点样仪在空白蜡块上打孔,每个组织芯片孔柱直径2.0 mm,在做标记的肿瘤蜡块上钻取目标组织植入空白蜡块相对应的孔内,设计组织陈列点数共60个,待全部目标组织植入后,将蜡块置55 ℃烘烤2 h,使目标组织与受体蜡块完全融合。冷却至室温后,冻存30 min,作3 μm连续切片,62 ℃烘烤3 h,备用。
1.3试剂和免疫组织化学染色
HIF-1α、TGF-β鼠抗人单克隆抗体购自武汉博士德试剂公司,进口分装型,包装0.1 ml,浓缩液,建议工作浓度1∶100。二抗、三抗及封闭血清购自北京中山金桥试剂公司。主要免疫组化步骤:二甲苯脱蜡、梯度酒精至水,3%双氧水灭活内源性过氧化酶,PBS缓冲液振洗,微波炉进行抗原热修复,正常山羊血清封闭、一抗冰箱过夜,二抗 、三抗各1 h,DAB显色10-15 min,复染核脱水透明,中性树胶封片。结果判断:着色细胞<30%为阴性,≥30%为阳性。HIF-1α、TGF-β阳性物质均定位在细胞浆。PBS代替一抗作阴性对照,公司提供的阳性片作阳性对照。
1.4HIF-1α、TGF-β表达水平的定量分析选取阳性切片,采用HIPAS100图象分析软件对所有切片进行图象分析,先在切片的阴性区域设置视场底色灰度,然后利用低倍镜寻找每张切片着色均匀的典型区域,每张切片随机选取10个着色典型区域且不重复的视场,放大400倍镜下测量每个视场中阳性灰度单位,取其均数即为该切片的着色强度(即灰度单位)。
1.5统计学方法
应用SPSS13.0统计软件进行统计学分析。计数资料采用卡方检验,不同组间表达率的比较采用Fisher精确概率法,计量资料采用t检验,各指标表达水平与临床病理参数间的关系作直线回归相关分析。以α=0.05作为具有统计学意义。
2 结果
2.1HIF-1α、TGF-β在移行细胞癌发展不同阶段中阳性率的比较
低级别和高级别尿路上皮癌中均存在HIF-1α的表达,阳性率分别为33%(10/30)和67%(40/60),差别具有统计学意义(P<0.05);TGF-β在低级别和高级别尿路上皮癌中的阳性率分别为30%(9/30)和70%(42/60),差别具有统计学意义(P<0.05)。
2.2HIF-1α、TGF-β阳性表达水平与移行细胞癌临床病理参数关系的相关性
HIF-1α表达水平与组织学类型、浸润深度、淋巴结转移密切正相关(P<0.05),与肿瘤体积、脉管内癌栓、TNM分期无关(P>0.05);TGF-β表达水平与肿瘤体积、脉管内癌栓、组织学类型密切相关(P<0.05),与淋巴结转移、TNM分期、浸润深度无关(P>0.05)。见表1。
2.3HIF-1α、TGF-β在移行细胞癌不同病变中的表达水平的相关性分析
HIF-1α、TGF-β表达水平在低级别移行上皮癌中不存在明显相关(r=0.2802P>0.05);在高级别移行上皮癌中存在明显正相关(r=0.7803P<0.05)。
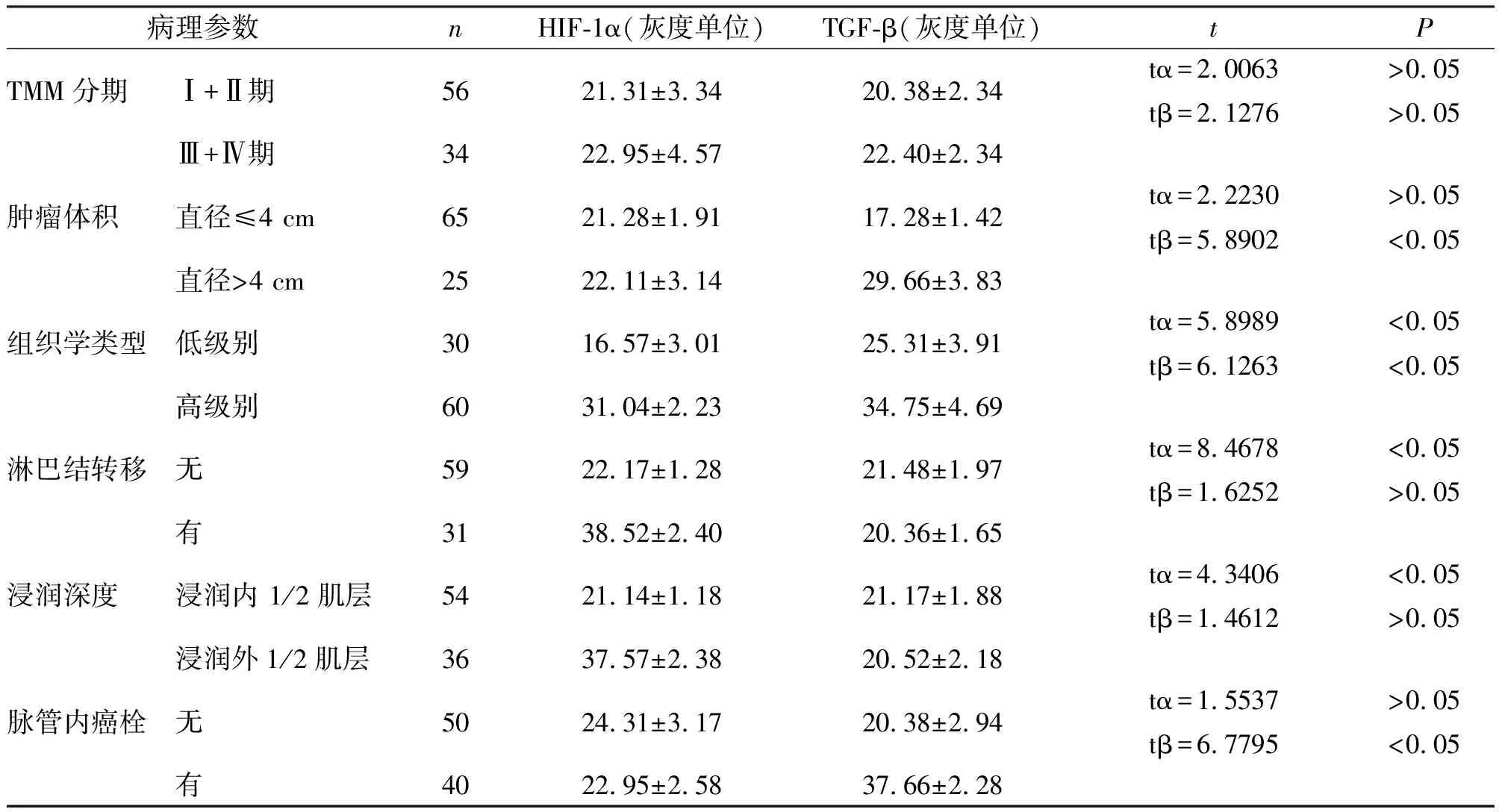
表1 HIF-1α、TGF-β在移行细胞癌的表达水平与临床病理参数的关系
注:tα代表HIF-1α;tβ代表TGF-β。
3 讨论
移行细胞癌包括低级别和高级别移行上皮癌,一般规律是低级别尿路上皮癌出现肌层浸润和淋巴结转移的机率低,而高级别尿路上皮癌极易出现肌层的浸润,在随访中出现复发和癌症进展的机率明显增加,肿瘤浸润程度、组织学类型、肿瘤数目、复发等是移行细胞癌恶性进展的重要影响因素[1]。恶性肿瘤细胞在生长过程中出现的局部乏氧导致细胞外微环境条件的改变,诱导HIF-1的高表达,后者不仅通过改变恶性肿瘤细胞的代谢方式为细胞供能,同时启动血管新生增加局部微血管密度,且研究发现高表达HIF-1的肿瘤细胞局部出现放化疗的耐受,因此缺氧环节的启动是肿瘤恶性变的关键环节。另有新近研究发现乏氧还通过TGF-β、Notch、miRNAS、Wnt等信号途径导致细胞的EMT过程,进一步促进肿瘤细胞耐药的发生,导致肿瘤恶性进展[2]。
HIF-1是一种转录因子,主要以异源二聚体的形式存在,由α亚基(HIF-1α)和β亚基(HIF-1β)组成,氧对HIF-1活性的调节主要通过HIF-1α。HIF-1α在正常氧分压时极不稳定,易被泛素依赖的蛋白水解酶降解;但在细胞外微环境缺氧、生长因子作用等因素的刺激下,细胞中的HIF-1α性质稳定下来,与另一亚单位HIF-1β紧密结合,作用于结构基因的调控序列,促进下游基因的转录,如VEGF、红细胞生成素(EPO)、NOS和糖酵解酶等,使组织细胞对缺氧产生适应性调节[3,4]。另有研究发现作为细胞外基质降解主要酶类的MMP-2在大鼠肝星状细胞中的表达及活性与HIF-1α表达密切相关,且通过对大鼠MMP-2基因序列的研究发现其5′端基因序列带有典型的HIF-1结合位点,认为MMP-2 是HIF-1的下游分子,HIF-1α通过上述多种途径诱导细胞的血管新生和代谢方式改变[5]。本研究低级别和高级别尿路上皮癌中均存在HIF-1α的表达,阳性率分别为33%(10/30)和67%(40/60),差别具有统计学意义(P<0.05);HIF-1α表达水平与组织学类型、浸润深度、淋巴结转移呈正相关(P<0.05),与肿瘤体积、脉管内癌栓、TNM分期无关(P>0.05)。提示随移行上皮癌恶性进展,缺氧诱导因子明显表达上调,从而可能通过促进血管新生、代谢趋向无氧酵解、细胞外基质浸润等方式使肿瘤细胞克服不利生存环境,从而促进肿瘤的进展。
TGF-β通过TGFβ-TβR-P21-ras-MEK-ERK通路参与MAPK通路的信号传导[6,7]。当活性的TGF-β1与细胞膜表面的TGF-βRⅠ、Ⅱ结合后,活化P21-ras-raf-MEK1/2-ERK1/2通路,MEK1/2(MAPKK)磷酸化ERK1/2(MAPK),进而由磷酸化的ERK1/2进入细胞核,在各种转录因子如Elk1、SRF、SAP-1a、c-Myc、STAT等参与下,改变靶基因转录。但由于不同的细胞有不同的转录因子,从而出现完全不同的生物学效应。对上皮来源的细胞表现为生长抑制,而对间充质来源的细胞却表现为明确的生长促进作用,两者作用完全相反。在乳腺癌研究结果显示TGF-β1表达水平越高,癌细胞浸润转移的能力越强,癌症相关的死亡率越高.这种联系与患者年龄、肿瘤大小和雌激素受体水平无关; 对结肠癌、肝癌、胃癌、肺癌和前列腺癌的体外和体内研究也得到类似的结果。有研究发现阻断TGF-β信号传导通路能够减少肿瘤的转移,运用截短的Smads2/3显负性突变体抑制乳腺肿瘤细胞系的TGF-β信号通路,结果发现肿瘤细胞的转移能力被抑制。结肠癌的微卫星不稳定性研究发现,TβRⅡ无活性的突变,使转移减少,增加了患者术后的存活率,将TβRⅡ基因的cDNA转染到TβR表达缺失的大肠癌细胞中,这些细胞生长率降低,但强刺激了细胞的浸润和转移能力[8]。 最近通过对TGF-β在MMTV/neu转基因鼠乳腺癌发生和肺转移中的作用的研究,发现持续激活TGF-β信号传导能够延长乳腺肿瘤形成的潜伏期,但同时增加了血管外的肺转移[9]。本研究发现TGF-β在低级别和高级别尿路上皮癌中的阳性率分别为30%(9/30)和70%(42/60),差别具有统计学意义(P<0.05);同时TGF-β表达水平与肿瘤体积、脉管内癌栓、组织学类型密切相关(P<0.05),与淋巴结转移、TNM分期、浸润深度无关(P>0.05)。本研究提示TGF-β对移行上皮癌的恶性进展起促进作用,利于肿瘤细胞间质浸润和脉管内转移。
采用直线回归分析显示低级别移行上皮癌中HIF-1α、TGF-β表达水平间不存在明显相关,而在高级别移行上皮癌中存在明显正相关。提示HIF-1α、TGF-β表达与移行上皮癌恶性进展密切相关,可参与血管新生、上皮间质转换等多个环节,但在低级别肿瘤中两者的协同作用并不明显。
参考文献:
[1]Ide H,Kikuchi E,Hasegawa M,et al.Therapeutic enhancement of S-1 with CPT-11 through down-regulation of thymidylate synthase in bladder cancer[J].Cancer Med,2013,2(4):488.
[2]Badr S,Salem A,Yuosif AH,Awadallah H,Awed N,Bakr A.Hypoxia inducible factor-1alpha and microvessel density as angiogenic factors in bilharzial and non-bilharzial bladder cancer[J].Clin Lab,2013,59(7-8):805.
[3]Ito K,Stannard K,Gabutero E,et al.Galectin-1 as a potent target for cancer therapy:role in the tumor microenvironment[J].Cancer Metastasis Rev,2012,31(3-4):763.
[4]Shen C,Kaelin WG Jr.The VHL/HIF axis in clear cell renal carcinoma[J].Semin Cancer Biol,2013,23(1):18.
[5]Girdhani S,Lamont C,Hahnfeldt P,et al.Proton irradiation suppresses angiogenic genes and impairs cell invasion and tumor growth[J].Radiat Res,2012,178(1):33.
[6]Charerntantanakul W,Kasinrerk W.Plasmids expressing interleukin-10 short hairpin RNA mediate IL-10 knockdown and enhance tumor necrosis factor alpha and interferon gamma expressions in response to porcine reproductive and respiratory syndrome virus[J].Vet Immunol Immunopathol,2012,146(2):159.
[7]Lisak RP,Benjamins JA,Nedelkoska L,et al.Secretory products of multiple sclerosis B cells are cytotoxic to oligodendroglia in vitro[J].J Neuroimmunol,2012,246(1-2):85.
[8]Chen Z,Zhang D,Yue F,et al.The iron chelators Dp44mT and DFO inhibit TGF-β-induced epithelial-mesenchymal transition via up-regulation of N-Myc downstream-regulated gene 1 (NDRG1)[J].J Biol Chem,2012,287(21):17016.
[9]Touil Y,Zuliani T,Wolowczuk I,et al.The PI3K/AKT signaling pathway controls the quiescence of the low-Rhodamine123-retention cell compartment enriched for melanoma stem cell activity[J].Stem Cells,2013,31(4):641.

