组蛋白去乙酰化酶突变体水解酰基底物的研究
宫艳超,褚文玮,赵伟伟
(天津渤海职业技术学院生物与环境工程系,天津300402)
蛋白质的翻译后修饰与基因转录有着密切的关系,其中,蛋白质的乙酰化与去乙酰化修饰是由组蛋白去乙酰化酶(HDACs)和组蛋白乙酰化酶(HAT)协同调控的[1]。它们通过调节赖氨酸残基末端的电荷状态,改变蛋白质的结构与功能[2]。
蛋白质的翻译后修饰,在生物体内具有重要的生理功能。目前,体内已经发现了200多种翻译后修饰[3]。除了组蛋白的N-乙酰化修饰,超过1700个人源蛋白被发现是N-乙酰化修饰的底物蛋白[4],蛋白的酰基化修饰最常见的就是赖氨酸残基末端的乙酰化修饰,除了常见的蛋白质赖氨酸的乙酰化修饰,最近还发现了丙酰化修饰、丁酰化修饰、丙二酰修饰以及巴豆酰化修饰等[5],但是这些修饰的生理功能以及如何影响基因的调控过程并不清楚[6]。
HDAC家族的蛋白结构分析可以得出,其酶活中心由两个loop组成,组成水解醋酸根的逃逸通道,loop1(蓝色),具有高度保守的GG序列,loop2(粉红色),具有核心保守序列HH,家族1和家族3,在该酶活中心是GGX-,其中,X是较大的残基,酪氨酸(Tyr)、亮氨酸(Leu)、苯丙氨酸(Phe),家族2在该酶活中心的序列为PPX-,X位置为较小的甘氨酸(Gly)。以野生型组蛋白去乙酰化酶(HDAC8)为例,GGXHH motif X的位置是色氨酸(Trp),141位的色氨酸位于醋酸根逃逸通道的和酶活中心位置,距离乙酰基只有4 Å左右。
因此,本实验以141位色氨酸为突变位点,分别突变为丙氨酸(Ala)、Gly、组氨酸(His)和 Phe,发现其对酰基底物(A0=Ac-Arg-His-Lys-Lys(Z)-AMC,Z为乙酰)的水解能力较野生型变弱,得出HDAC8的141氨基酸所占空间位置的大小,影响其酶活性。
1 实验部分
1.1 实验材料
实验室保存的pET-22b-hHDAC8为实验中所用HDAC8质粒,用于质粒扩增的菌株E.coli trans 5α(DH 5α)感受态细胞和用于表达蛋白的菌株BL21(DE3)感受态细胞购买于全式金生物技术有限公司,所用细胞株Hela细胞由实验室冻存。
1.2 仪器与试剂
Millipore型纯水仪(苏州赛恩斯仪器有限公司)、BS124S天平(德国 Sartorius)、YC-2层析实验冷柜(北京博医康实验仪器有限公司)、AKTA蛋白纯化仪(通用医疗生命科学上海有限公司)、Hitrap Q离子交换柱(通用医疗生命科学上海有限公司)、Superdex 200分子筛柱(通用医疗生命科学上海有限公司)、还原型谷胱甘肽(上海生工生物工程有限公司)、氯化钠(上海生工生物工程有限公司)、胰蛋白胨(上海生工生物工程有限公司)、酵母粉(上海生工生物工程有限公司)。
1.3 实验方法
1.3.1 pET-22b-hHDAC8质粒的定点突变
将pET-22b-hHDAC8的141位Trp定点突变为为 Gly,Ala,Phe,His,并设计其引物,进行突变。
1.3.2 pET-22b-hHDAC8的表达纯化
pET-22b-hHDAC8及其突变体的表达,目的质粒转化到表达菌株BL-21中,取1 μL测序正确的目的质粒加入50 μL感受态细胞BL-21中,冰浴30 min,42℃热激90 s,冰浴5 min,加入850 μL LB培养基,37℃ 220 rpm振荡 90 min,4000 rpm离心6 min,弃去部分上清,重悬涂于含氨苄100 mg/L LB固体培养基上,37℃过夜培养。挑取阳性单克隆加入含氨苄的LB液体培养基中37℃振荡,过夜培养12 h左右。次日将过夜培养菌液加入1 LLB液体培养基(含氨苄100 mg/L)中,于37℃振荡培养,4~6 h后加入0.4 mM IPTG诱导表达,继续16℃培养18 h后收取菌体。
离子交换层析(Hitrap Q柱),按系统操作执行进行洗泵,结束后将泵头A、B分别放入到抽滤过的His-HDAC8离子交换低盐缓冲液和His-HDAC8离子交换高盐缓冲液中,设置流速,接离子柱,高低盐各处理离子柱三次,最后用5%的His-HDAC8离子交换高盐缓冲液平衡离子柱,上样,待样品进入系统内后,将模式由Inject改为Load,将盐浓度改为15%的His-HDAC8离子交换高盐缓冲液,用15%~35%质量分数的His-HDAC8离子交换高盐缓冲液进行梯度洗脱,1 mL/tube进行适当收集,SDS-PAGE跑胶鉴定。
凝胶过滤层析(Superdex 200),按系统操作执行进行洗泵,结束后将泵头A、B放入到抽滤过的His-HDAC8分子筛缓冲液中,设置流速,接柱,用His-HDAC8分子筛缓冲液平衡Superdex 200,上样,切换模式,并开始收集0.5 mL/tube,SDSPAGE跑胶鉴定。
1.3.3 人源HDAC8蛋白及突变体与酰基底物的酶活测试
纯化的蛋白用紫外分光光度计测定浓度使其浓度2 mg/mL,在黑色96孔荧光板中分别加入40μL浓度为 150μM的 AMC荧光多肽底物,10 μL四种不同突变型的HDAC8酶液和50μL Assay buffer,于37℃恒温振荡反应30 min,注意避光,加入 100μL含10 mg/mL胰酶和200μM SAHA的Trypsin solution终止上述反应,并在37℃恒温振荡器中振荡反应30 min后,在酶标仪中于390 nm/460 nm荧光波长下测定荧光强度,分析数据。
2 结果与讨论
2.1 pET-22b-hHDAC8质粒的定点突变
以pET-22b-hHDAC8为模板,将HDAC8突变成 pET-22b-hHDAC8-W141G、pET-22b-hHDAC8-W141A、pET-22b-hHDAC8-W141F、pET-22b-hHDAC8-W141H,突变后测序结果如下,由测序结果可以看出,本实验需要的位点都实现了定点突变,可以将质粒转化到表达型的菌株,实现后续的表达纯化。
2.2 pET-22b-hHDAC8及其突变体的表达纯化
2.2.1 pET-22b-hHDAC8的表达纯化
本实验将人源的HDAC8蛋白,经超声破碎前,取平衡缓冲液内全菌的样,确定目的蛋白是否在大肠杆菌内表达,超声破碎后,取高速离心后的上清和沉淀的样,上清液挂住,分别取穿透、洗杂、洗杂后的柱料、洗脱、洗脱后的柱料,洗脱步骤可以完全洗脱下目的蛋白,只有少量目的蛋白残留于柱料上,HDAC8蛋白的亲和层析各步骤的结果如图1。
由图1所见,由于HDAC8蛋白的相对分子质量量约43,所以由亲和层析图可以看出:HDAC8蛋白出现在洗脱样品中,可以进行下一步实验。
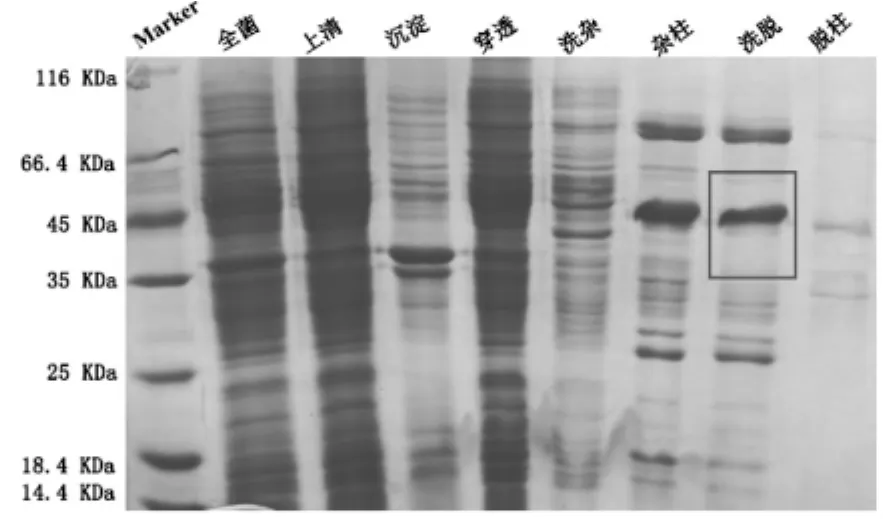
图1 pET-22b-hHDAC8镍柱亲和纯化SDS-PAGE结果
用10mL KD的浓缩管将HDAC8蛋白的洗脱液浓缩到小体积,由于洗脱buffer含有200 mM的咪唑,300 mM KCl,所以离子交换层析之前,利用buffer,将咪唑换到1 mM以下,300 mM KCl换到50 mM KCl,如图2。
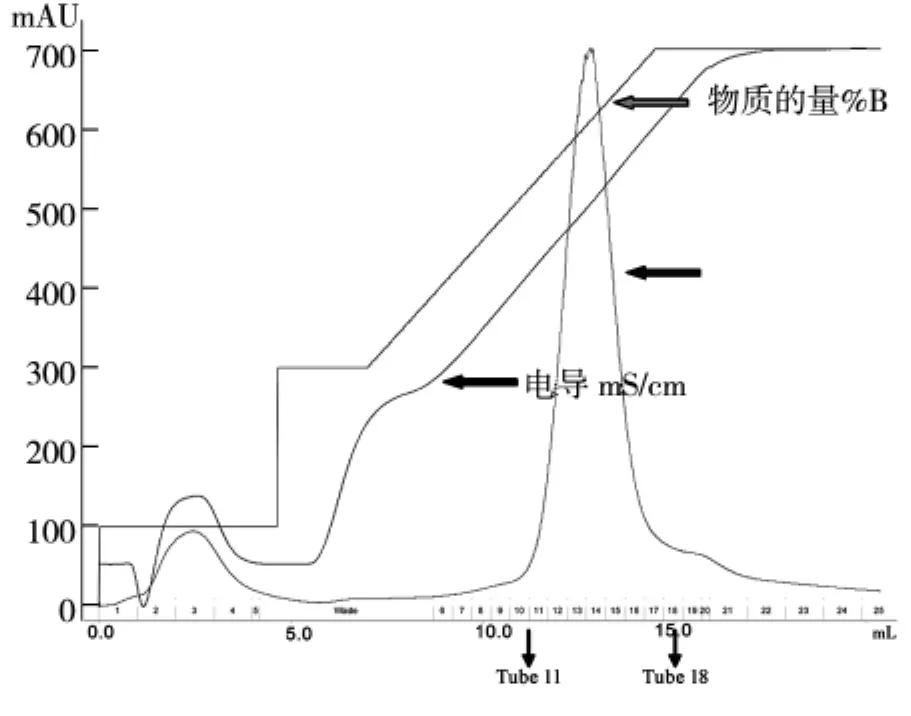
图2 pET-22b-hHDAC8 HitrapQ离子交换纯化峰图
我们将洗脱液经过换buffer之后浓缩到1.5 mL,采用阴离子交换柱Hitrap Q进行纯化,平衡离子柱的浓度为50 mM KCl,蛋白洗脱之前将盐浓度拉至150 mM KCl,洗脱目的蛋白的梯度是150 mM KCl到300 mM KCl,初期的上样过程蛋白有穿透峰,当电导为24 mS/cm左右时,即开始出现目的蛋白峰,SDS-PAGE结果显示11管-18管均为目的蛋白,取11-18管进行下一步纯化,如图3。
取第11-18管用10 mL KD浓缩管进行浓缩,浓缩到500 μL左右的时候,使用Superdex 200进行纯化,平衡Superdex 200,保持离子浓度在150 mM KCl,上样,洗脱,从10 mL左右出现了杂峰,14 mL左右开始出现目的蛋白峰,峰形单一对称,按照峰宽收集蛋白跑胶,SDS-PAGE结果显示19~24 管均为目的蛋白 HDAC8(43 KD),取第 19~24管进行浓缩,-80℃备用,如图4。
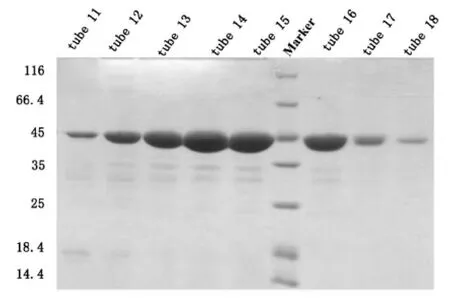
图3 pET-22b-hHDAC8 Hitrap Q阴离子交换SDSPAGE结果
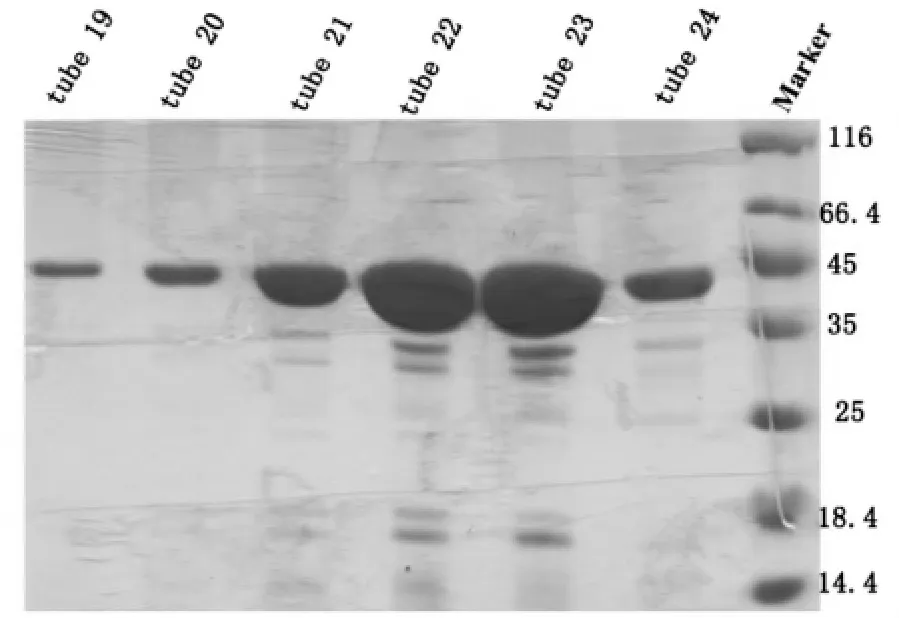
图4 pET-22b-hHDAC8 Superdex 200分子筛SDS-PAGE结果
2.2.2 pET-22b-hHDAC8-W141G的表达纯化
本实验纯化四种突变体蛋白,以甘氨酸突变体为例,将HDAC8-W141G蛋白,经超声破碎前后,分别取全菌、上清、沉淀、穿透、洗杂、洗杂后的柱料、洗脱、洗脱后的柱料的样,洗脱步骤可以完全洗脱下目的蛋白,几乎无目的蛋白残留于柱料上,HDAC8-W141G蛋白的亲和层析各步骤的结果如图5。
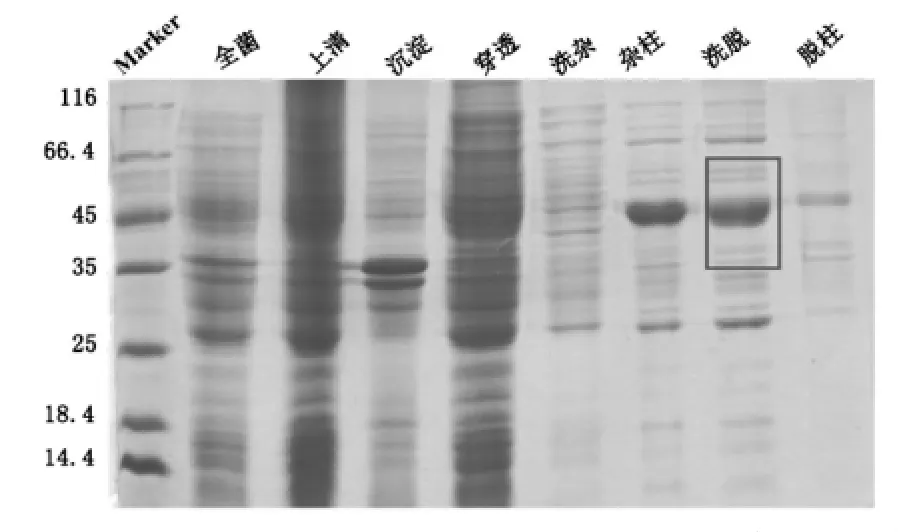
图5 pET-22b-hHDAC8-W141G镍柱亲和纯化SDS-PAGE结果
由图5可见:由于HDAC8蛋白的相对分子质量约43左右,所以由亲和层析图可以看出,HDAC8蛋白出现在洗脱样品中,可以进行下一步的实验。
我们将洗脱液经过换buffer之后浓缩到1.5 mL,采用阴离子交换柱Hitrap Q进行纯化,平衡离子柱的浓度为50 mM KCl,蛋白洗脱之前将盐浓度拉至150 mM KCl,洗脱目的蛋白的梯度是150 mM KCl到300 mM KCl,初期的上样过程蛋白有穿透峰,当电导为24 mS/cm左右时,即开始出现目的蛋白峰。SDS-PAGE结果显示13管-23管均为目的蛋白,取13-23管进行下一步纯化,如图6。
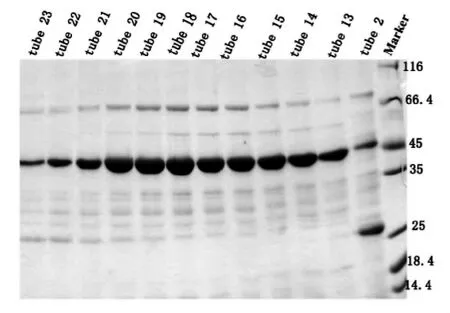
图6 pET-22b-hHDAC8-W141G Hitrap Q阴离子交换SDS-PAGE结果
取第 13~23管用10 mL KD浓缩管进行浓缩,浓缩到500 μL左右的时候,使用Superdex 200进行进一步的纯化,平衡Superdex 200,保持离子浓度在150 mM KCl,上样,洗脱,从 10 mL到 13 mL出现了杂峰,13 mL左右开始出现目的蛋白峰,峰形单一对称,按照峰宽收集蛋白跑胶,SDSPAGE结果显示20~24管均为目的蛋白HDAC8(43),取第 20~24管进行浓缩,-80℃备用,如图7。

图7 pET-22b-hHDAC8-W141G Superdex 200分子筛SDS-PAGE结果
2.3 野生型及突变型hHDAC8蛋白对AMC荧光多肽底物的水解效果
本实验的实验思路是通过酶学测试,观察野生型HDAC8蛋白及四种突变体对荧光底物的水解能力差异,验证HDAC8的141位与酰基的结合关键点,纯化的HDAC8蛋白及其突变体用紫外分光光度计测定蛋白浓度,使蛋白终浓度为0.2 mg/mL,AMC荧光多肽底物的浓度为150 μM,其它反应时间和终止时间都一致,结果数据显示如图8。
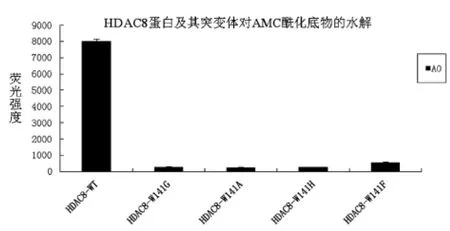
图8 HDAC8蛋白野生型及其突变体对AMC酰化底物的水解
由图8可见:A0为乙酰化AMC四肽底物,野生型的HDAC8对其水解能力最强,四种突变体对该AMC酰基底物水解能力都变弱了,说明141位色氨酸的突变影响了HDAC8的酶活力。
3 结论
在HDAC8蛋白野生型的基础上,将其酶活中心逃逸通道位置的141位的色氨酸分别突变为Ala、Gly、His和 Phe,突变成较小和较大的氨基酸,并纯化表达出相应的野生型和突变体蛋白,然后与AMC荧光底物A0测定酶活性,发现其对酰基底物的水解能力较野生型变弱,因此,得出HDAC8的141氨基酸所占空间位置的大小,影响其酶活性的结论。
[1]Somoza J R,Skene R J,KatzBA,et al.Structural snapshots of human HDAC8 provide insights into the class I histone deacetylases[J].Structure,2004,12(7):1325-1334.
[2]De Ruijter A J,Van Gennip A H,Caron H N,et al.Histone deacetylases(HDACs):characterization of the classical HDAC family[J].Biochemical Journal,2003,370(3):737-749.
[3]Gregoretti I,Lee Y-M,Goodson H V.Molecular evolution of the histone deacetylase family:functional implications of phylogenetic analysis[J].Journal ofmolecular biology,2004,338(1):17-31.
[4]Tan M,LuoH,Lee S,et al.Identification of67 histone marks and his-tone lysine crotonylation as a new type of histone modification[J].Cell,2011,146(6):1016-1028.
[5]夏靖,冯冰虹.组蛋白去乙酰化酶(HDACs)的研究进展[J].广东药学院学报,2010,05:546-551.
[6]姚毅武,姚和权,蒋晟,薛晓文.组蛋白去乙酰化酶抑制剂抗肿瘤临床研究进展[J].中国新药杂志,2013,03:294-300.

