呼肠孤病毒感染的树鼩中三类CD分子及IFN-γ表达变化及特征
袁圆,王璇,张志成,李娜,王文广,匡德宣,代解杰
(中国医学科学院/北京协和医学院医学生物学研究所, 中国医学科学院医学生物学研究所实验树鼩标准化与应用研究省创新团队,云南省眼科疾病防治研究重点实验室,昆明 650118)
哺乳动物呼肠孤病毒(mammalian orthoreovirus, MRV)是基因组含10个节段的呼肠孤病毒科 (Reoviridea)正呼肠孤病毒属 (Orthoreovirus) RNA病毒[1],标准株可根据红细胞凝集活性分为: T1L(Long株)、T2J(Jone 株)和T3D/T3A(Dearing株/ Abney株)[2]。MRV具有广泛的宿主谱,但一般仅在幼体或免疫功能不全的动物体内引起严重感染[3]。由于MRV特殊的基因组[4]特性和广泛的宿主谱特征可能对人造成潜在威胁[5],且其作为溶瘤病毒在肝癌治疗中的重要价值[6],故对呼肠孤病毒引起宿主免疫的特征的研究十分必要。目前呼肠孤病毒免疫学方面相关研究多集中于番鸭[7]、草鱼呼肠孤病毒[8],哺乳动物呼肠孤病毒免疫相关的研究十分有限;树鼩(tree shrew)作为灵长类近亲,近期也从其粪便中分离出的两株分属于T1型和T3型的呼肠孤病毒MRV1/TS/2011和MRV3/TS/2013[9],关于两株病毒的特征和引发宿主免疫的变化规律亟待补充。前期研究表明,呼肠孤病毒感染正常树鼩后,仅在感染前期有较高的复制表达,后期病毒表达水平有所下降,甚至逐渐被机体清除[10];在此过程中与适应性免疫相关的II型干扰素基因有所上调[11],但机体清除呼肠孤病毒的具体免疫机制以及机体适应性免疫在此过程中发挥的作用尚未明晰。临床检测中CD4+/CD8+和IL-4/IFN-γ常作为适应性免疫功能评价的指标[12],综合常用的评价指标[13],以及适应性免疫中发挥主要功能的细胞类群,本文选用:CD4(一般表达于辅助性T细胞)、CD8(一般表达于杀伤性T细胞,cytotoxic lymphocyte,CTL表面)、 CD19(表达于所有B细胞)、IFN-γ(由CD4+Th1类细胞分泌,可协同CTL细胞共同发挥细胞免疫作用)[14]作为实时监测机体适应性免疫反应变化情况的指标,用MRV1/TS/2011和MRV3/TS/2013感染自身未携带呼肠孤病毒的树鼩,通过对感染后树鼩体内病毒载量及四个指标的变化情况初步推断呼肠孤病毒引起宿主免疫反应的过程,为树鼩源呼肠孤病毒自身感染特性的研究提供科学依据,对人兽共患疾病的防治也有重要的指导意义。
1 材料与方法
1.1 材料
1.1.1实验动物
普通级远交繁殖的F4代中缅树鼩滇西亚种(tree shrew,Tupaiabelangerichinensis)由中国医学科学院医学生物学研究所树鼩种质资源中心提供【SCXK(滇)K2013-0001】,饲养于中国医学科学院医学生物学研究所树鼩种质资源中心普通环境【SYXK(滇)K2013-0001】,于中国医学科学院医学生物学研究所树鼩种质资源中心进行实验。所有操作均符合实验动物伦理学要求(伦理审批号:DWSP201803034)。
1.1.2试剂及设备
实时荧光定量PCR仪:美国Bio-Rad,型号为CFX-96;高压灭菌锅:日本Tomy公司,型号为TOMY-SS-325;恒温培养箱:美国Forma公司,型号为CO2 T/C;生物安全柜:美国Forma公司,型号为A/B3型(6Ft);低温离心机:日本Hitachi公司,型号为CT15RE;QIAamp®Viral RNA Mini Kit (德国Qiagen);生理盐水;胃管;采血注射器;Perfect Real Time One step primescript RT-PCR kit (TaKaRa);树鼩CD4单克隆抗体(PerCP,小鼠源);树鼩CD8单克隆抗体(PerCP,小鼠源);人CD19单克隆抗体(PerCP,小鼠源);溶血素(Beckman)。
1.2 方法
1.2.1动物分组
选取离乳40~50 d左右的树鼩16只,体重60~70 g,尾静脉采血160 μL,QIAamp®Viral RNA Mini Kit提取试剂盒提取总RNA,将产物进行PCR,随机选取病毒检测为阴性的动物12只(雌雄各半)分为三组,4只一组灌胃病毒液。A组:MRV1/TS/2011 106.1TCID 50/mL 0.8 mL/只;B组:MRV1/TS/2011 105.6TCID 50/mL 0.8 mL/只;对照组即C组:等量灌入生理盐水。
1.2.2病毒样本扩增培养及毒力检测
Vero细胞接种于12孔板进行病毒培养后,免疫荧光初步确定收毒条件:感染后36~75 h之间收毒,外源加入阿尔法糜蛋白酶。小方瓶内进行扩毒,收毒,反复冻融三次破碎细胞,4℃,4000 r/min离心30 min,去沉淀。
收取病毒,TCID50检测病毒毒力:将Vero细胞按接种于96孔板,于37℃孵箱中培养至长成致密单层。PBS清洗后,加入终浓度为10 μg/mL的糜蛋白酶的维持液,倍等比稀释病毒,101~108共8个稀释度,每个稀释度设10个实验孔,2个对照孔。甩干孔板中的PBS,实验孔接种稀释后的病毒液,对照孔加入相应不含病毒的维持液。37℃孵箱中培养,观察并记录出现CPE的孔数,计算TCID50。按前期实验确定的最适攻毒条件调整本次实验的攻毒剂量。
1.2.3样本采集处理
病毒感染第1、8、14、21、28天,尾静脉采集采抗凝血400 μL。
分为三部分,其中150 μL提取核酸后检测病毒载量,QIAamp®Viral RNA Mini Kit提取试剂盒提取总RNA,将产物进行RT-PCR,检测的引物见表1。
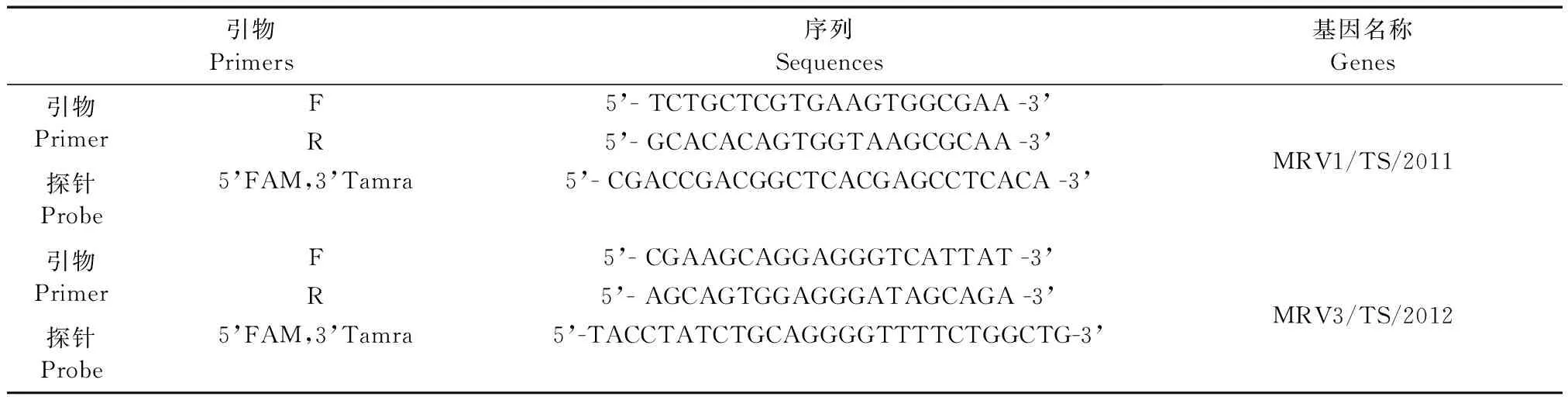
表1 用于实时定量RT-qPCR的MRV/TS探针及引物序列Tab.1 Primers and probes of RT-qPCR of the MRV/TS
取100 μL血样利用ELISA检测IFN-γ表达量:将标准品及样品加完后,放于湿盒内室温孵育2 h;弃去酶标包被板中液体,加满洗液清洗3次,拍干;用稀释液按1∶1500的比例稀释酶标抗体,在标准品梯度稀释孔、对照孔及待测样品孔中,每孔加入稀释好的酶标抗体100 μL,空白孔A1除外;湿盒内室温孵育1 h;加满洗液清洗3次,拍干;加入显色液显色10 min,加终止液1终止反应。在450 nm波长依序测量各孔的吸光度(A值)。
剩余部分样品利用红细胞裂解液裂解红细胞后流式上机检测。每份取100 μL单细胞悬液,约1×106个细胞;样品取一份细胞加入10 μL树鼩CD4/CD8/CD19单克隆抗体PerCP;空白取一份细胞不加抗体;室温下避光反应1~2 h;每份加入1 mL PBS,轻柔洗涤细胞一次,2000 r/min离心10 min,弃上清;每份加入300 μL PBS重悬细胞,上机检测。
1.3 数据处理
数据得出后以平均值±标准误记录,作图。组间差异性用t-test软件 分 析,P< 0.05表示差异有显著性,P< 0.01表示差异极显著。IFN-γ测定后,以标准品浓度为横坐标,A值为纵坐标,计算出标准品的Logistic曲线拟合(四参数)回归方程式,根据样品的A值代入方程式计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
2 结果
2.1 病毒载量随感染时间变化
血浆中两组病毒载量均在感染后第14天有高表达,其中A组(感染MRV1/TS/2011的动物)相较于B组(感染MRV3/TS/2013的动物)表达量较高,最高可达7.05×104copies/mg,其余时间均检测到微量表达;B组在第14天呈8.59×103copies/mg高表达后,第21天仍有较高表达,第28天表达量急剧减少。对照组无病毒RNA表达,与对照组比较,两个病毒感染组在第14天差异有显著性(P<0.05),详见图1。

注:与对照组比较 *P< 0.05,差异有显著性。图1 MRV1/TS/2011和MRV3/TS/2013感染树鼩后血浆中的病毒载量Note. *P< 0.05 means there was a significant difference.Fig.1 Expression of virus in the tree shrews infected with MRV1/TS/2011 and MRV3/TS/2013
2.2 免疫细胞数量及IFN-γ表达量随感染时间变化
经两株病毒感染后,CD4+、CD8+及CD19+细胞阳性率表达呈现波动变化,CD4+及CD19+细胞量均在第14天达峰值;对照组CD4+细胞阳性率基本表达在20%~30%之间,对照组CD19+细胞阳性率基本在4%~8%之间;其中,CD4+细胞在感染后第1、14、21天均有较高的表达,A组CD4+细胞在感染第1天显著高于对照组;其余时间细胞量低于对照组;CD19+在第21、28天表达量低于对照组,第28天感染后细胞阳性率与对照组相比差异有显著性。与对照组相比,经MRV3/TS/2013感染的CD19+细胞在第8天和第14天细胞阳性率显著升高;而经MRV1/TS/2011感染后CD19+细胞变化不如MRV3/TS/2013明显。两株病毒感染后CD8+细胞量在21天达峰值;在感染第14天、第28天时,与对照组相比,经两株病毒感染后CD8+细胞量显著减少。对照组CD8+细胞表达基本维持在1%~3%之间。如图2。
对照组CD4+/CD8+在感染后也呈波动变化,变化范围在5~14之间,在第21天时有最小值;MRV1/TS/2011感染后,在第1、8、14天,CD4+/CD8+显著高于对照组;而在MRV3/TS/2013感染后,第14、28天,CD4+/CD8+显著高于对照组。详见表2。对照组IFN-γ表达量在7~12之间,经MRV1/TS/2011及MRV3/TS/2013感染后,IFN-γ表达量均在第21天与对照组相比差异有显著性,达最大值,详见图3。
3 讨论
适应性免疫是机体抵御外界病原侵染的一条重要途径,由淋巴细胞增殖分化为表达不同CD分子的效应细胞[15],完成细胞免疫及体液免疫两种应对。生物研究和临床上常通过对CD分子的监测来反映机体免疫功能或判断病程。CD4+细胞增加被认为是细胞免疫增强的表现[16];IFN-γ诱导并参与细胞免疫,CD8+表达于CTL表面,两者表达量增加常意味着机体细胞免疫功能增强,B表面的CD19+增加则相反,表明机体体液免疫功能增强。而适应性免疫的研究不仅在疾病的机理研究中有重要作用[17-18],也能为后续治疗提供思路;如,溶瘤病毒治疗的一条重要思路就是发宿主的免疫应答[19],目前,在缺乏适应性免疫应答的两种小鼠模型中研究表明,借助引发免疫反应来实现呼肠孤病毒的抗肿瘤效应具有可行性和有效性[20]。故呼肠孤病毒引起机体适应性免疫反应的研究十分必要,且因树鼩与其他哺乳类实验动物,如小鼠,在免疫系统和神经系统中相比亲缘关系更接近于人[21],故本研究在未来临床治疗中存在重要的潜在价值。

注:a图为CD4+细胞阳性率随天数变化情况;b图为CD8+细胞阳性率随天数变化情况;c图为CD19+细胞阳性率随天数变化情况;与对照组比较 *P< 0.05,差异有显著性,**P< 0.01,差异有极显著性。图2 MRV1/TS/2011和MRV3/TS/2013感染树鼩后血浆中CD4+/CD8+/CD19+ 表达情况Note. Figure a shows CD4+ cells changed with the time after infection. Figure b shows CD8+ cells changed with the time after infection; Figure c shows CD19+ cells changed with the times after infection. *P< 0.05 means there was a significant difference, and **P< 0.01means there was a extremely significant difference.Fig.2 Expression of CD4+/ CD8+/CD19+ cells in the tree shrews infected with MRV1/TS/2011 and MRV3/TS/2013

组别Groups第1天Day 1第8天Day 8第14天Day 14第21天Day 21第28天Day 28实验组A:MRV1/TS/201111.07327.042174.8764.95514.0761实验组B:MRV3/TS/20136.4481.12966.9724.50819.546对照组Control8.61612.28613.4235.68313.154
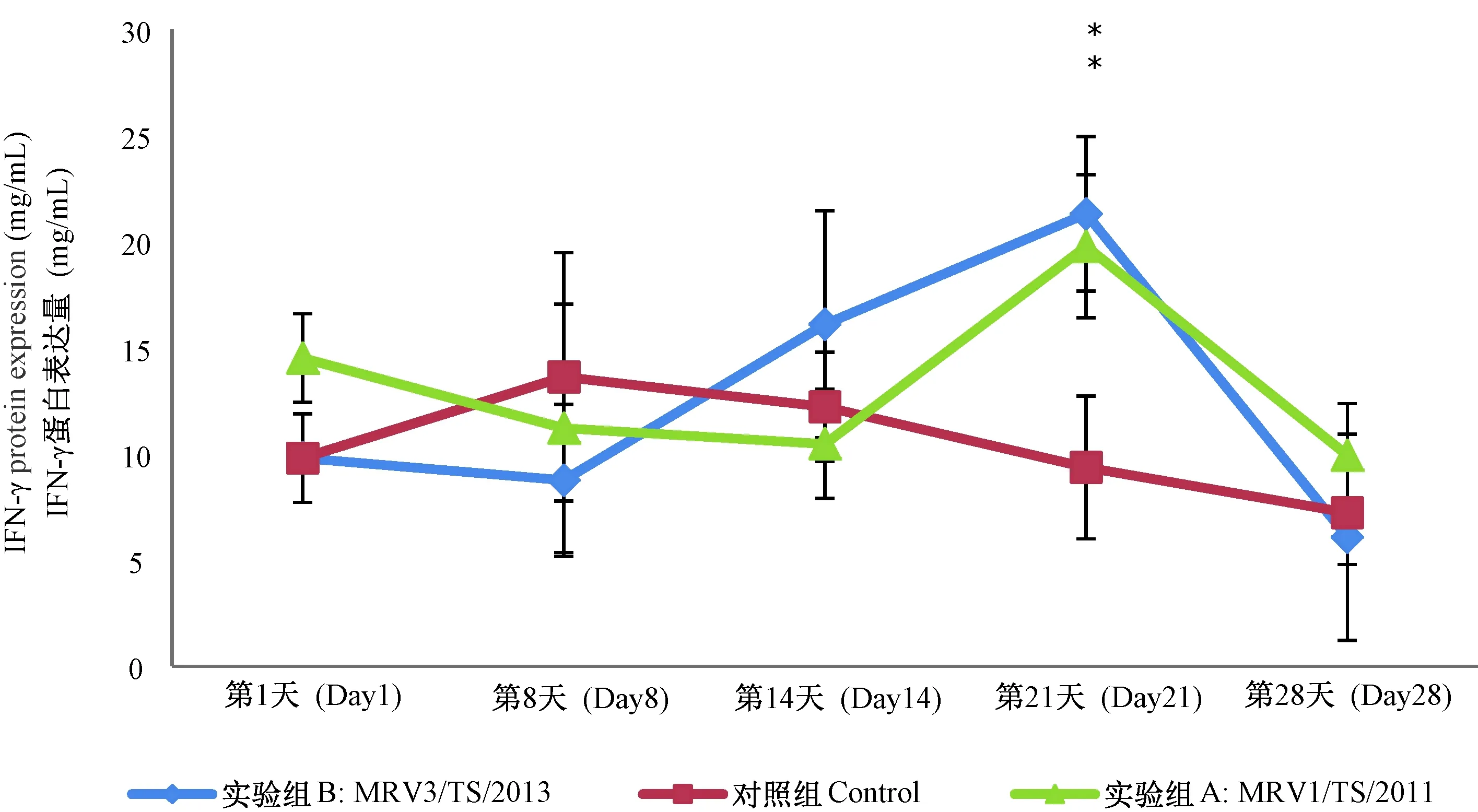
注:与对照组比较 *P< 0.05,差异有显著性;第21天时,MRV1/TS/2011和MRV3/TS/2013感染组与对照组相比差异均有显著性。图3 MRV1/TS/2011和MRV3/TS/2013感染树鼩后血浆中IFN-γ表达量情况Note. *P< 0.05 means there is a significant difference; animals infected by MRV1/TS/2011and MRV3/TS/2013 both have significant difference on the 21’th day, compared with the normal group.Fig.3 IFN-γ expression in the tree shrew infected with MRV1/TS/2011 and MRV3/TS/2013
目前关于呼肠孤病毒引起机体免疫反应的研究十分有限,主要以和产业养殖相关的草鱼和番鸭作为研究对象。草鱼呼肠孤病毒感染是草鱼出血症的主要病因,草鱼可以通过鱼鳃上调12种抗病毒免疫相关基因表达来应对病毒感染[8]。与哺乳动物不同,草鱼虽有脾、肾、胸腺等免疫器官,但主要的免疫细胞为IgM阳性细胞、IgZ阳性细胞和PAS阳性细胞[22],经病毒感染后三类主要免疫细胞的变化情况暂未见报道。姚金水等[23]先后证实番鸭呼肠孤病毒可诱导感染细胞凋亡,特别是免疫细胞凋亡从而引起免疫抑制,同时还能能引起严重的法氏囊损伤。而本文结果显示,CD4+、CD8+、CD19+三类细胞仅在感染后期明显低于正常组,未观察到明显的免疫抑制现象。李爽等[24]研究表明鸭源呼肠孤病毒感染雏鸭后CD8+细胞阳性率也呈波动变化,在第5 天达到峰值;而第14 天,实验组CD8+细胞阳性率明显低于对照组;同样,王全溪等[25]在雏番鸭上的研究也表明试验组脾脏在攻毒后第 5 天,浆细胞数量比对照组少,差异有显著性(P< 0.01),之后细胞数量有所回升,提示鸭源呼肠孤病毒可能直接对免疫器官进行损伤,使外周血 CD3+、 CD8+T 细胞阳性率降低, 导致机体细胞免疫和体液免疫水平下降,诱导机体产生免疫抑制;而本文研究表明MRV1/TS/2011及MRV3/TS/2013载量在感染第14 天达峰值,这一结果与前期实验所得相符[10];而CD4+及CD19+细胞数量也在感染后第14天达峰值,其中经MRV1/TS/2011感染后第1天CD4+就有较高表达且数值与正常组相比有显著性差异,且相较于其他两种被检测细胞,感染过程中,CD4+细胞阳性率一直较高;可推测在病毒感染前期,机体主要产生CD4+细胞,在整个应对感染的过程中,CD4+细胞一直发挥主要作用;在第14天病毒高表达时,CD19+细胞数量显著增加,共同参与机体免疫反应。关于哺乳动物源呼肠孤病毒的研究目前主要集中与其分子和感染特性,关于其引起机体的免疫反应尚未见报道。为了解树鼩源呼肠孤病毒感染正常个体后到被机体自然清除的过程,本文主要选用动物离乳40~50 d的树鼩,此发育阶段的树鼩个体免疫功能已近完善,且树鼩免疫系统发育在进化上要优于番鸭、草鱼,故不同于这两者的研究结果,在树鼩上未发现明显的免疫抑制现象,动物免疫器官及动物个体也未表现明显的感染病症。结合已有报道,以及本文CD4+细胞和CD19+经两株病毒感染后表现出的敏感性不同,一方面验证了前期实验中呼肠孤病毒能被正常机体清除的结论,另一方面提示我们不同来源的呼肠孤病毒对宿主感染的机制各不相同,不同型别的呼肠孤病毒也会针对性引起的机体不同的免疫反应。初步推测MRV1/TS/2011感染前期主要激起机体体液免疫;MRV3/TS/2013可能主要影响机体细胞免疫,体液免疫只在病毒表达量显著升高及感染后期发挥作用。与呼肠孤病毒现有的研究对象相比,本文选用近人灵长类动物树鼩作为对象,实验结果为哺乳动物呼肠孤病毒感染及刺激机体免疫应对的机制研究提供了补充资料。
不同时间服用缬沙坦氢氯噻嗪对非杓型高血压患者血压晨峰和内皮功能的影响………………… 张倩辉 王立立 张志梅 等(4)462
实验中采用的CD19+抗体为小鼠源抗人抗体,可通过交叉反应识别树鼩CD19+细胞[26],可能存在非特异性识别的情况,对B细胞数量的确立可能存在一定误差;且实验使用单染流式计数,所得结果仅能初步反应感染后个体免疫细胞的变化趋势,为确定T辅助细胞、B淋巴细胞等在感染过程中发挥的具体作用,则后续实验中还需加入CD3+细胞染色,由双染特异的圈定具体细胞亚群,反应其准确的变化情况。现有的IL-4试剂盒对树鼩检测的灵敏性不高,故实验中未加入该指标,仅用IFN-γ辅助判断细胞与体液免疫;本次各类CD分子及IFN-γ检测中,对照组结果都有较大的个体的差异,故CD4+/CD8+比值仅作为参考体液免疫和细胞免疫主导作用的一个辅助指标,需要进一步扩大样本才能得出一个正常比值范围,作为判断指标。本研究实验组仅选用4只动物,是从小样本得出的相应免疫细胞基本变化趋势,实验过程中发现,树鼩个体间免疫功能差异较大,后期实验还应扩大实验样本,同时在实验设计中加入阴性对照组(培养病毒使用的维持液灌胃)、阳性对照组,增加实验严谨性,避免偶然误差,得出普适变化规律。
本文通过检测两株最近从树鼩粪便分离得到的病毒MRV1/TS/2011及MRV3/TS/2013,感染正常树鼩后几类淋巴细胞表面CD分子及干扰素随感染时间的变化情况,初步揭示了树鼩呼肠孤病毒引起宿主免疫变化的规律,即:呼肠孤病毒感染树鼩后,主要刺激机体产生CD4+细胞,在病毒表达量达高峰期时,CD19+细胞显著增加,可能体液免疫发挥作用;而在病毒感染后期,CD8+细胞可能通过细胞免疫参与抗病毒反应,IFN-γ可由Th1类细胞和CD8+细胞分泌,在病毒感染后期参与细胞免疫;CD4+可能对1型呼肠孤病毒更敏感,而CD19+可能对3型呼肠孤病毒更敏感。对两株病毒的感染规律研究有一定补充,同时可为呼肠孤病毒在机体内避开机体免疫发挥溶瘤作用提供一定的思路,可拓展呼肠孤病毒发挥溶瘤效应的分子机制,也为树鼩的病毒防范提供了理论基础。

