18 F-FDG PET/CT in detection of recurrence and/or metastasis of differentiated thyroid carcinoma in patients with elevated serum thyroglobulin levels and negative131 I post-therapy whole body scan
, , , , ,
(Department of Nuclear Medicine, the First Affiliated Hospital of Nanjing Medical University, Nanjing 210029, China)
分化型甲状腺癌(differentiated thyroid carcinoma, DTC)是最常见的内分泌系统恶性肿瘤之一,包括乳头状甲状腺癌(papillary thyroid cancer, PTC)和滤泡状甲状腺癌(follicular thyroid cancer, FTC)。20%的DTC患者术后和/或131I治疗后可出现局部或远处复发、转移[1],早期、准确判断DTC复发和转移情况以及定位病灶非常重要。血清甲状腺球蛋白(thyroglobulin, Tg)水平和SPECT扫描等是评估DTC患者预后的主要方法,但有一定局限性[2-3]。本研究探讨18F-FDG PET/CT对131I-治疗剂量全身显像(131I post-therapy whole body scans,131I-RxWBS)阴性而Tg阳性的DTC复发或转移的诊断价值及其对治疗方案的影响。
1 资料与方法
1.1 一般资料 回顾性分析2010年1月—2015年7月于我院核医学科接受治疗的DTC患者72例,男31例,女41例,年龄15~79岁,平均(43.9±16.8)岁;58例PTC,14例FTC。纳入标准:①接受甲状腺癌根治术和淋巴结清扫术;②术后残留甲状腺均接受131I治疗;③131I治疗前停用左旋甲状腺素钠2~4周,以保证血清促甲状腺激素(thyroid stimulating hormone, TSH)> 30 mIU/ml,刺激后Tg>2 ng/ml;④131I-RxWBS结果为阴性。排除标准:刺激后TSH< 30 mIU/ml或甲状腺球蛋白抗体(anti-thyroglobulin antibodies, TgAb)高于正常值上限的2倍,即TgAb>230 IU/ml;有其他恶性肿瘤病史。参考文献[4]方法完成131I治疗,所有患者于131I治疗前测尿碘水平均≤300 μg/L。
1.2 仪器与方法
1.2.118F-FDG PET/CT 采用Siemens Biograph 16排螺旋CT的PET/CT仪,18F-FDG由GE回旋加速器生产并自动合成,放化纯度>95%。检查前嘱患者禁食6 h以上,使空腹血糖≤7.0 mmol/L,静脉注射18F-FDG 3.70~5.55 MBq/kg体质量,之后嘱患者饮水500 ml、静卧60 min后排空膀胱,行全身PET/CT。CT扫描参数:管电压120 kV,管电流140 mA,层厚和层间距均为5.0 mm。PET扫描采用三维模式,脑部扫描范围自颅顶至下颌骨平面,5 分钟/床位,体部扫描范围自颅底至股骨近端,1.5分钟/床位,采集6~7个床位。采用CT数据进行衰减校正,以迭代法进行重建,获得轴位、矢状位和冠状位PET、CT及PET/CT融合图像。
1.2.2131I-RxWBS和 SPECT/CT 采用Siemens Symbia T6和GE Discovery NM/CT 670 SPECT/CT仪,于患者口服131I后80~96 h完成全身平面显像及局部SPECT/CT断层融合显像。图像采集条件和参数参照文献[5],平面显像图像采集范围自颅顶至足底,扫描速度20 cm/min;颈胸部SPECT/CT断层显像的采集范围自上颈部至肺底,采集条件为15秒/帧,矩阵64×64,Zoom为1.45;分别采集局部SPECT及CT图像,采用随机配备软件进行图像融合。
1.3 图像分析 SPECT/CT图像:由2名具有15年以上核医学工作经验的医师共同阅片,意见有分歧时经讨论达成一致。先评价全身平面图像,再评价局部SPECT/CT断层图像。SPECT/CT阴性判断标准:平面和断层图像仅见生理性摄取,未见病理性异常放射性浓聚影,CT图像未见异常病灶。
PET/CT图像:由2名具有10年以上PET/CT工作经验的医师共同阅片,意见有分歧时经讨论达成一致。阅片时诊断医师知晓患者临床情况,先分别对PET和CT图像进行单独评价,再评价PET/CT融合图像。PET/CT阳性判断标准:排除胃、肠道、肾和膀胱等生理性18F-FDG摄取外,可见18F-FDG摄取异常增高和/或CT图像上可见肿瘤复发或转移表现。根据PET/CT结果,将患者分为阳性组和阴性组。
1.4 统计学分析 采用SPSS 17.0统计分析软件。计量资料以±s表示,计数资料以率或百分比表示,2组间一般资料比较采用两独立样本t检验(年龄及131I给药剂量)或χ2检验(性别及病理类型);以Mann-WhitneyU检验比较2组间刺激后Tg和TgAb值的差异。将显像结果与组织病理学检查和/或多种影像学联合检查和/或长期临床随访(6~36个月)结果进行对照,计算18F-FDGPET/CT诊断DTC复发和/或转移的效能。P<0.05为差异有统计学意义。
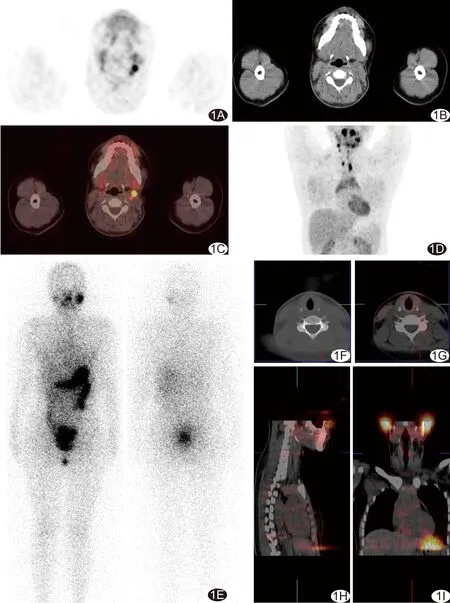
图1 患儿女,16岁,PTC术后,行第2次131I治疗(150 mCi) A.18F-FDG PET/CT图像示颈部多发局灶性高代谢灶; B.18F-FDG PET/CT局部轴位CT图像; C.18F-FDG PET/CT融合图像; D.MIP图像示颈部多发高代谢灶; E.131I-RxWBS前后位图像未见病理性异常放射性摄取凝聚灶; F.131I-SPECT/CT局部轴位CT图像; G.131I-SPECT/CT局部融合图像未见明显异常; H.131I-SPECT/CT局部矢状位融合图像未见病灶; I.131I-SPECT/CT局部冠状位融合图像未见病灶
2 结果
72例患者接受131I治疗2~5次,平均(2.47±0.73)次;131I治疗剂量为150~200 mCi,平均(159.44±15.91)mCi;刺激后Tg为2.1~1056.0 ng/ml,平均(147.96±259.32)ng/ml,TgAb为6.2~197.9 IU/ml,平均(31.93±42.53)IU/ml;32例血清TSH结果超过检测值上限,即>100 mIU/L,40例血清TSH为32.49~99.27 mIU/L,平均(62.88±19.22)mIU/L。
2.1 2组一般资料比较 2组患者年龄、性别、病理类型(PTC/FTC)及刺激后TgAb值比较差异均无统计学意义(P均>0.05),但131I给药剂量和刺激后Tg值比较差异均有统计学意义(P均<0.05),见表1。
2.218F-FDG PET/CT显像结果 阳性组42例(42/72,58.33%),其中真阳性34例,假阳性8例;阴性组30例(30/72,41.67%),其中真阴性26例,假阴性4例。
34例PET/CT真阳性患者中,FDG浓聚灶位于颈部和/或锁骨上淋巴结25例(25/42,59.52%;图1);远处转移7例(7/42,16.67%),其中肺转移5例和骨转移2例;2例(2/42,4.76%)同时存在局部淋巴结转移及远处转移(肺转移)。
2.318F-FDGPET/CT诊断效能18F-FDGPET/CT诊断DTC复发和/或转移的准确率、灵敏度、特异度、阳性预测值和阴性预测值为83.33%(60/72)、89.47%(34/38)、76.47%(26/34)、80.95%(34/42)和86.67%(26/30)。
2.418F-FDG PET/CT对治疗决策的影响及随访结果 对72例患者随访6~36个月,中位随访时间14个月。对35例(35/72,48.61%)在参考PET/CT结果后改变了治疗方案:对23例(23/35,65.71%)予以手术治疗,术后病理均示淋巴结转移(包括颈部、锁骨上或纵隔内),随访显示术后未见复发及转移(Tg<1 ng/ml或进行性下降,且无复发和转移的影像学证据);12例(12/35,34.29%)患者不能或不愿接受手术治疗,对其中9例单纯以左甲状腺素钠药物抑制治疗,2例结合外照射放疗,1例结合生物靶向治疗,随访期内均显示病情进展(Tg进行性增高和/或有影像学证据)。37例(37/72,51.39%)未改变最初治疗方案,随访显示其中27例Tg保持稳定或进行性下降,10例Tg进行性增高。
表1 2组一般资料比较(±s)
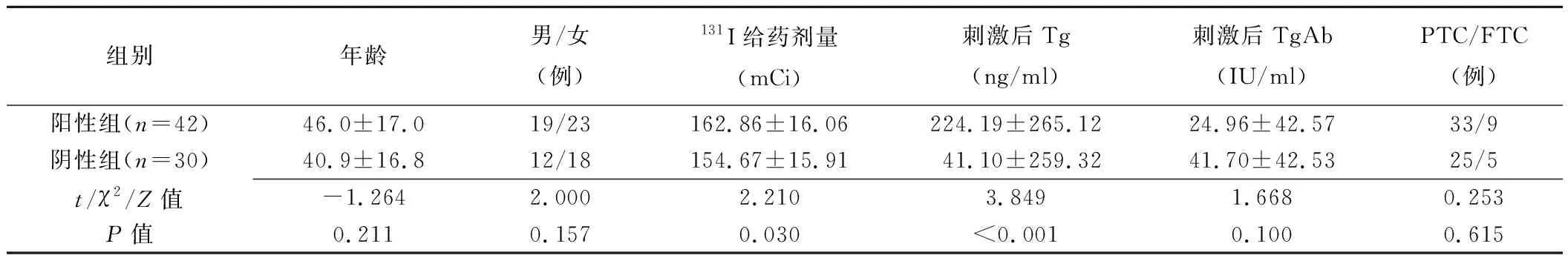
表1 2组一般资料比较(±s)
组别年龄男/女(例)131I给药剂量(mCi)刺激后Tg (ng/ml)刺激后TgAb(IU/ml)PTC/FTC(例)阳性组(n=42)46.0±17.019/23162.86±16.06224.19±265.1224.96±42.5733/9阴性组(n=30)40.9±16.812/18154.67±15.9141.10±259.3241.70±42.5325/5t/χ2/Z值-1.2642.0002.2103.8491.6680.253P值0.2110.1570.030<0.0010.1000.615
3 讨论
监测血清Tg水平是随访期间评估DTC病情的重要方法之一。DTC患者在甲状腺癌根治术后和131I清除残留甲状腺后出现Tg升高是存在肿瘤复发和转移的有力证据[6]。131I治疗是DTC的主要治疗方法之一,131I-RxWBS有助于对131I治疗期间DTC患者进行疗效评价、寻找病灶、再分期、指导治疗和预后判断等[7],但在部分Tg增高而高度怀疑病灶存在的DTC患者,由于转移灶失分化、病灶体积较小或部位等原因,病灶可能不摄取131I和/或131I-RxWBS图像上未见摄碘灶,从使而131I-RxWBS结果表现为假阴性[8-10]。对于此类患者,需更有效的方法来寻找复发和转移灶、指导制定治疗方案及进行准确的再分期。与传统的核医学显像设备相比,PET/CT图像具有更好的空间分辨率,图像质量更高[11]。PET/CT采用18F-FDG作为显像剂,FDG能够直接参与细胞代谢,从分子层面反映组织的功能代谢情况,在肿瘤的诊断、分级和预后判断等方面具有重要作用[11]。本研究中,PET/CT诊断DTC复发和/或转移的准确率、灵敏度、特异度、阳性预测值及阴性预测值分别为83.33%、89.47%、76.47%、80.95%和86.67%,PET/CT检出的病灶主要为淋巴结转移,部分为肺转移和骨转移,提示PET/CT有助于发现DTC复发和转移灶。既往研究[12]主要关注于18F-FDG在131I-诊断剂量扫描(DxWBS)阴性而Tg阳性的DTC患者中的应用,但受限于131I的剂量(2~5 mCi),DxWBS的图像质量较差,影响其诊断效能。本组患者131I的剂量均>150 mCi,能更可靠地判断有无摄碘灶。
本研究中,PET/CT结果阳性组与阴性组患者的年龄、性别、病理类型等差异均无统计学意义(P均>0.05),但阳性组刺激后Tg水平和131I给药剂量明显高于阴性组,提示监测Tg水平有助于判断DTC有无复发、转移。对于Tg明显升高的患者,应采用多种方法积极寻找可能存在的病灶,此类患者可能需要更高的131I治疗剂量。此外,本组共对35例因参考PET/CT结果而改变了最初的治疗方案,其中23例接受手术治疗,术后病理均示淋巴结转移,且术后均未见甲状腺癌复发及转移;而12例不能或不愿接受手术治疗者在随访期内均见病情进展,提示PET/CT能提供有价值的诊断信息,可指导制定手术等治疗方案。
本研究的局限性:①为回顾性研究,可能存在选择偏倚;②未与超声等结果进行比较;③部分随访结果是基于临床和影像学证据;④样本量较小,结果可能存在偏倚。
综上所述,对于RxWBS阴性而Tg阳性的DTC患者,18F-FDG PET/CT有助于诊断和定位复发及转移病灶,并指导后续治疗。
[参考文献]
[1] Heston TF, Wahl RL. Molecular imaging in thyroid cancer. Cancer Imaging, 2010,10(1):1-7.
[2] 范志娜,吴刚,袁建军.超声联合血清Tg、SPECT/CT诊断分化型甲状腺癌术后颈部淋巴结转移.中国医学影像技术,2014,30(3):362-365.
[3] Oh JR, Ahn BC. False-positive uptake on radioiodine whole-body scintigraphy: Physiologic and pathologic variants unrelated to thyroid cancer. Am J Nucl Med Mol Imaging, 2012,2(3):362-385.
[4] 程旭,李永军,徐兆强,等.治疗剂量131I SPECT/CT显像评价分化型甲状腺癌骨转移.标记免疫分析与临床,2015,22(11):1095-1098.
[5] 程旭,李永军,徐兆强,等.SPECT/CT诊断分化型甲状腺癌131I清甲治疗后淋巴结转移及ROC分析.医学影像学杂志,2017,27(1):36-39,66.
[6] Kim YI, Im HJ, Paeng JC, et al. Serum thyroglobulin level after radioiodine therapy (Day 3) to predict successful ablation of thyroidremnant in postoperative thyroid cancer. Ann Nucl Med, 2015,29(2):184-189.
[7] 沈晨天,薛艳丽,邱忠领,等.131I-SPECT/CT在分化型甲状腺癌诊治中的应用.中国医学影像技术,2015,31(7):1119-1123.
[8] Jeong SY, Lee SW, Kim HW, et al. Clinical applications of SPECT/CT after first I-131 ablation in patients with differentiated thyroid cancer. Clin Endocrinol (Oxf), 2014,81(3):445-451.
[9] Chong A, Song HC, Min JJ, et al. Improved detection of lung or bone metastases with an I-131 whole body scan on the 7th day after high-dose I-131 therapy in patients with thyroid cancer. Nucl Med Mol Imaging, 2010,44(4):273-281.
[10] Hassan FU, Mohan HK. Clinical utility of SPECT/CT imaging post-radioiodine therapy: Does it enhance patient management in thyroid cancer? Eur Thyroid J, 2015,4(4):239-245.
[11] Wiebel JL, Esfandiari NH, Papaleontiou MA, et al. Evaluating positron emission tomography use in differentiated thyroid cancer. Thyroid, 2015,25(9):1026-1032.
[12] Agrawal K, Bhattacharya A, Mittal BR. Role of single photon emission computed tomography/computed tomography in diagnostic iodine-131 scintigraphy before initial radioiodine ablation in differentiated thyroid cancer. Indian J Nucl Med, 2015,30(3):221-226.
- 中国医学影像技术的其它文章
- Correlation of intraoperative ultrasonography and immunohistochemical markers expression in glioma
- 《中国医学影像技术》杂志2018年征订启事
- Intraoperative ultrasonographic features of craniopharyngioma:Case report
- Portal venous velocity ratios in different degrees of portal vein stenosis following 70% partial hepatectomy of rats
- CT morphological characteristics of plantar nerves and their significances in diabetic foot
- 3.0T MR three-dimensional time-of-flight and fast imaging employing steady state acquisition sequences in pre-operative evaluation on spatial relationship among trigeminal nerve, facial nerve and peripheral vessels

