两种氮杂环卡宾Pd(Ⅱ)配合物的合成及表征
谢丹妮,霍 丹, ,司传领
(1. 天津市制浆造纸重点实验室,天津科技大学造纸学院,天津 300457;2. 中国科学院可再生能源重点实验室,广州 510640;3. 江苏省生物质绿色燃料与化学品重点实验室,南京林业大学化工学院,南京210037)
在金属有机领域中,氮杂环卡宾(NHC)主要用作配体.它们和其他带有两对孤电子的配体相似,是一类很好的给电子配体,与金属键有很强的结合能力,在催化反应中不易解离.氮杂环卡宾易于制备,且可以通过调节氮原子上的取代基,生成具有不同空间位阻和电子效应的卡宾,生成配合物的结构也具有多样性.氮杂环卡宾的后过渡金属配合物对水、热和空气稳定,并且在催化反应中可表现出很高的活性.因此,氮杂环卡宾受到越来越多的关注和研究.
吡啶增强前催化剂的制备、稳定和引发型钯催化剂[1-2]是指一类卡宾与吡啶同时配位的 Pd(Ⅱ)的配合物,在 2005年由 Organ等首先报道.这类配合物具有优异的催化性能,可以催化多种胺化反应和交叉偶联反应,且催化剂用量低[3].与其他类型的钯催化剂相比,这类配合物易于制备,稳定性高[4-16],在氮气保护下,即使在二甲亚砜中 110,℃加热 12,h也无法使其分解[17].
经典的氮杂环卡宾由咪唑、咪唑啉、苯并咪唑衍生而来.这类卡宾的共同点在于卡宾中心与两个氮原子直接相连.本文关注具有其他结构的氮杂环卡宾,比如以吲唑为母体的卡宾.这类化合物中,卡宾中心只与一个氮原子直接相连,其电子与空间效应都与经典氮杂环卡宾不同.相应的配合物可能具有不同的催化性质[18].本文以咪唑和吲唑为原料,分别合成了与后过渡金属钯络合的氮杂环卡宾配合物并对其进行了表征.
1 材料与方法
1.1 试剂与仪器
咪唑,98%,,美国 Sigma公司;溴乙烷、乙醚,化学纯,国药集团化学试剂有限公司;碳酸钾、二氯甲烷、氢氧化钠,分析纯,国药集团化学试剂有限公司;甲苯、溴化钠、无水乙醇、乙腈、吡啶、乙酸乙酯,分析纯,江苏强盛功能化学股份有限公司;甲醇,分析纯,上海凌峰化学试剂有限公司;吲唑,99%,,上海源叶生物科技有限公司;碘乙烷,99%,,Adamas 公司;氯化钯,59.0%,,上海达瑞精细化学品有限公司;氘代氯仿,美国CIL产品北京汉威士波谱公司分装.
Unity-Inova-400型超导核磁共振仪,美国瓦里安技术中国有限公司.
1.2 合成方法
1.2.1 化合物1的合成[19]
在 50,mL的圆底烧瓶中加入咪唑(0.68,g,10,mmol),再加入 5,mL甲苯,室温下搅拌至完全溶解.向甲苯溶液中加入 NaOH水溶液(1.6,mL,6.25,mol/L),混合搅拌 30,min.随后加入溴乙烷(1.64,mL,22,mmol),加热回流 12,h.反应结束后,待混合物温度降到室温,观察到体系上层为清液,下层为淡黄色油状物.旋转蒸发除去易挥发物质.向残余的固体中加入少量二氯甲烷至固体不再溶解,抽滤除去不溶物.冷冻干燥滤液,得到淡黄色油状物.对该油状物进行萃取,向其中加入 2,mL甲醇至全溶.将甲醇溶液缓慢滴入 20,mL乙醚中,不断搅拌15,min.静置后将上层清液倒出,下层淡黄色油状物继续溶在甲醇中,转移至20,mL乙醚中搅拌.如此反复进行3次,将最后得到的淡黄色油状物(化合物1)冷冻干燥至体积不再变化,保存在真空环境(1.088,1,g,产率 53%,).
1.2.2 化合物2的合成[20-21]
在 25,mL的 Schlenk管中先分别加入化合物 1(0.061,5,g,0.3,mmol)、氯化钯(0.053,2,g、0.3,mmol)、碳酸钾(0.207,3,g,1.5,mmol)、溴化钠(0.102,9,g,1,mmol),再加入 6,mL 吡啶,加热至 80,℃,反应12,h.反应结束后,待混合物温度降至室温,观察到体系上层为清液,下层有少许不溶物.旋转蒸发除去易挥发物质.向残余的固体中加入少量二氯甲烷,不断搅拌至固体不再继续溶解.静置后将上层清液倒出,向下层不溶物继续加入少许二氯甲烷搅拌.如此反复进行3次,将最后得到的二氯甲烷混合溶液旋转蒸发除去溶剂.向旋干后得到的黄色固体中加入20,mL乙醚,搅拌 15,min,静置后将上层清液倒出,向下层不溶物中继续加入少许乙醚搅拌.如此反复进行 3次,将最后得到的乙醚混合液冷冻干燥,得到淡黄色粉末.将该淡黄色粉末溶于少量二氯甲烷中,利用硅胶层析柱对混合物进行纯化.最后得到的纯化后产物(化合物 2)为淡黄色粉末(0.017,9,g,产率12%,).
1.2.3 化合物3的合成[19]
在 50,mL的圆底烧瓶中加入吲唑(0.590,9,g,5,mmol)、NaOH 水溶液(1.3,mL,6.25,mol/L),再加入10,mL乙腈,在室温下搅拌 2,h.随后加入碘乙烷(1.6,mL,20,mmol),加热至 75,℃,反应 36,h.反应结束后,待混合物温度降到室温,观察到体系上层为黄褐色清液,下层有少许沉淀.旋转蒸发除去易挥发物质.向残余的黄褐色黏稠液中加入少量二氯甲烷,不断搅拌 15,min.静置后将上层清液倒出,下层不溶物继续加入少许二氯甲烷搅拌.如此反复进行 3次,将最后得到的二氯甲烷混合溶液冷冻干燥.向干燥后得到的混合物中加入20,mL乙酸乙酯,搅拌15,min,静置后将上层清液倒出,下层不溶物继续加入少许乙酸乙酯搅拌.如此反复进行 3次,将最后得到的乙酸乙酯混合液冷冻干燥至体积不再变化,得到黄褐色黏稠物.将该黏稠物溶于少许甲醇中,缓慢滴入 20,mL乙醚,不断搅拌 15,min.静置后将上层清液倒出,下层的沉淀继续在乙醚中搅拌.如此反复进行3次.将最后得到的不溶物冷冻干燥,得到淡黄色粉末,即化合物3(0.223,3,g,产率15%,).
1.2.4 化合物4的合成[20-21]
在 25,mL的 Schlenk管中先分别加入化合物 3(0.090,6,g,0.3,mmol)、氯化钯(0.053,2,g,0.3,mmol)、碳酸钾(0.207,3,g,1.5,mmol)、溴化钠(0.102,9,g),1,mmol),再加入6,mL吡啶,加热升温至80,℃,反应12,h.反应结束后,待混合物温度降至室温,观察到体系上层为清液,下层有少许不溶物.旋转蒸发除去易挥发物质.向旋干的固体中加入少量二氯甲烷,不断搅拌 15,min.静置后将上层清液倒出,下层不溶物继续加入少许二氯甲烷搅拌.如此反复进行 3次,将最后得到的二氯甲烷混合液冷冻干燥.向干燥后得到的淡黄色固体中加入20,mL乙醚,搅拌15,min,静置后将上层清液倒出,下层不溶物继续溶在乙醚中,加入少许乙醚搅拌.如此反复进行 3次,将最后得到的不溶物冷冻干燥,得到黄色粉末,即化合物 4(0.142,3,g,产率 89 %,).
1.3 1H NMR和13C NMR测试
将合成的 4种化合物分别溶于氘代氯仿中(约0.5,mL),在室温下于Unity-Inova-400型核磁共振仪上进行测试.
2 结果与讨论
2.1 化合物1的合成及表征
咪唑与溴乙烷发生烷基化反应,反应以甲苯为溶剂,并加入氢氧化钠水溶液,以脱去咪唑中的活泼氢(图 1).
图1 反应式1Fig. 1 Equation 1
反应分离得到的化合物 1为淡黄色油状物,经1H NMR表征,为溴化1,3-二乙基咪唑盐,其核磁共振氢谱结果如图2所示.从图2可以看出:化学位移为 10.26的峰为多重峰,积分值为 1,归属为连在两个氮原子之间的碳原子上的氢;化学位移为 7.68的峰为双峰,积分值为 2,归属为咪唑环中碳碳双键上的两个氢;化学位移为4.45的峰为多重峰,积分值为4,归属为两个乙基中的亚甲基氢;化学位移为 1.62的峰为多重峰,积分值为 6,归属为两个乙基中的甲基氢.产物的氢谱数据如下:
1H NMR(400,MHz,CDCl3):δ 10.26(m,1H,CH),7.68(d,J=1.50,Hz,2H,CH=CH),4.45(m,J=7.20,Hz,4H,CH2),1.62(m,J=7.60,Hz,6H,CH3).
图2 化合物1的1H NMR谱图Fig. 2 1H NMR spectrum of Compound 1
2.2 化合物2的合成及表征
在 80,℃条件下,化合物 1与氯化钯、过量的碳酸钾和溴化钠在吡啶中反应(图 3).加入碳酸钾的目的在于脱掉卡宾前体中两个氮原子之间的碳原子上的氢,原位生成卡宾与Pd(Ⅱ)配位.加入过量溴化钠的目的在于保证溴离子与 Pd(Ⅱ)配位,避免生成既有氯离子又有溴离子配位的混合物.吡啶既是反应溶剂,又是配体.

图3 反应式2Fig. 3 Equation 2
反应结束后分离得到的化合物2为黄色粉末,经1H NMR和13C NMR进行表征,为(1,3-二乙基咪唑基)吡啶基二氯化钯(Ⅱ),其核磁共振氢谱和碳谱结果如图4和图5所示.从图4可以看出:化学位移为9.05的峰为多重峰,积分值为 2,归属为吡啶上氮原子邻位上的两个氢;化学位移为7.75的峰为多重峰,积分值为 1,归属为吡啶中氮原子对位上氢;化学位移为 7.33的峰为多重峰,积分值为 2,归属为吡啶中氮原子间位上的两个氢;化学位移为 6.96的峰为单峰,积分值为 2,归属为咪唑环中碳碳双键上的两个氢;化学位移为 4.60的峰为四重峰,积分值为 4,归属为两个乙基中的亚甲基氢;化学位移为 1.60的峰为三重峰,积分值为 6,归属为两个乙基中的甲基氢.值得注意的是,化合物 1中 10.26处的峰在化合物2的谱图中没有出现,说明两个氮原子之间的碳原子上的氢被脱去,成功生成了卡宾的 Pd(Ⅱ)配合物.从图5可以看出:在化学位移121.3~152.8的范围内出现 4个峰,可归属为芳环上的碳原子.咪唑环中两个氮原子之间的碳原子所对应峰的化学位移应在 160~200,但由于四级碳较难出峰,且13C NMR测试时间不足,因此对应峰并未在谱图中出现.甲基和次甲基碳原子对应的峰则分别出现在 46.3和15.8.谱图中1.13处是溶剂峰.产物的氢谱及碳谱数据如下:
1H NMR(400,MHz,CDCl3):δ 9.05(m,J=8.36,Hz,2H,Ar-H),7.75(m,J=18.49,Hz,1H,Ar-H),7.33(m,J=14.03,Hz,2H,Ar-H),6.96(s,2H,CH=CH),4.60(q,J=22.20,Hz,4H,CH2),1.60(t,J=14.68,Hz,6H,CH3).
13C NMR(100,MHz,CDCl3):δ 121.3~152.8(Ar-C),46.3(CH3),15.8(CH2).

图4 化合物2的1H NMR谱图Fig. 4 1H NMR spectrum of Compound 2
图5 化合物2的13C NMR谱图Fig. 5 13C NMR spectrum of Compound 2
2.3 化合物3的合成及表征
在成功合成咪唑盐及其相应卡宾 Pd(Ⅱ)配合物的基础上,继续研究具有不同骨架的卡宾前体的吲唑盐的合成,并尝试合成其相应卡宾Pd(Ⅱ)配合物.
吲唑与碘乙烷发生烷基化反应,反应以乙腈为溶剂,在 75,℃条件下进行,并加入过量的氢氧化钠水溶液,以脱去吲唑中的活泼氢(图6).
图6 反应式3Fig. 6 Equation 3
反应完成后分离得到的化合物3为淡黄色粉末,经1H NMR表征,为碘化 1,2-二乙基吲唑盐,其核磁共振氢谱如图7所示.从图7可以看出:化学位移为 9.67的峰为多重峰,积分值为 1,归属为五元杂环上与苯环相连碳上的氢;化学位移为8.08~7.50的峰为多重峰,积分值为4,归属为苯环上的氢;化学位移为 5.21的峰为多重峰,积分值为 2,归属两个乙基中其中一个的亚甲基氢;化学位移为 4.97的峰为多重峰,积分值为 2,归属两个乙基中另外一个的亚甲基氢;化学位移为 1.80的峰为多重峰,积分值为 3,归属两个乙基中其中一个的甲基氢;化学位移为 1.56的峰为多重峰,积分值为 3,归属两个乙基中另外一个的甲基氢.谱图中未归属的峰为溶剂残余峰.产物的氢谱数据如下:
1H NMR(400,MHz,CDCl3):δ 9.67(m,1H,CH),8.08(m,J=8.35,Hz,1H,Ar-H),7.83(m,J=16.64,Hz,1H,Ar-H),7.71(m,J=8.40,Hz,1H,Ar-H),7.50(m,J=15.39,Hz,1H,Ar-H),5.21(m,J=21.14,Hz,2H,CH2),4.97(m,J=21.64,Hz,2H,CH2),1.80(m,J=13.88,Hz,3H,CH3),1.56(m,J=14.30,Hz,3H,CH3).
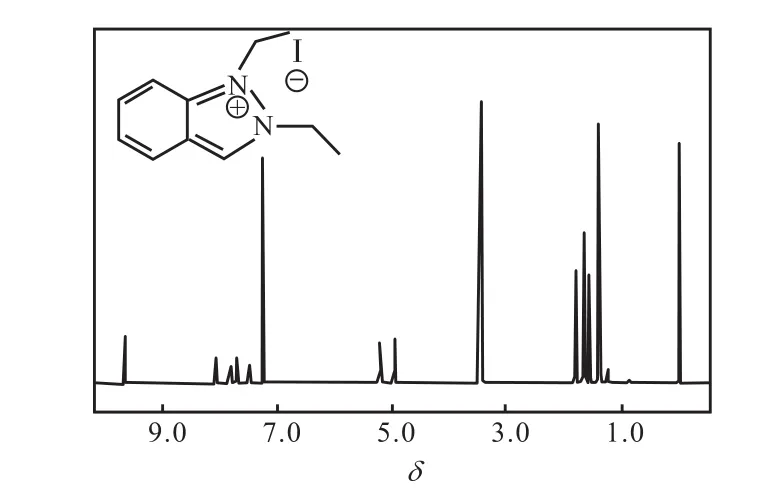
图7 化合物3的1H NMR谱图Fig. 7 1H NMR spectrum of Compound 3
2.4 化合物4的合成及表征
参照化合物2的合成方法,进行吲唑衍生的卡宾Pd(Ⅱ)配合物的合成.化合物 3与氯化钯、过量的碳酸钾和溴化钠在吡啶中反应,反应温度为 80,℃(图 8).

图8 反应式4Fig. 8 Equation 4
分离得到的化合物 4为黄色粉末,经1H NMR表征,为(1,2-二乙基吲唑基)吡啶基二溴化钯(Ⅱ),其核磁共振氢谱如图9所示.由图9可以看出:与化合物 3的谱图相比,9.67处的单峰消失,证明五元杂环上与苯环相连碳上的氢被脱掉.化学位移为 8.91的峰为双峰,积分值为 2,归属为吡啶环上氮原子邻位上的两个氢;化学位移为8.62的峰为双峰,积分值为 1,归属为吡啶环上氮原子对位上的氢;化学位移为 7.72的峰为多重峰,积分值为 2,归属为吡啶环上氮原子间位上的两个氢;化学位移为7.35~7.26的峰为多重峰,积分值为4,归属为苯环上的氢;化学位移为 3.49的峰为多重峰,积分值为 4,归属为两个乙基中亚甲基上的氢;化学位移为1.41的峰为多重峰,积分值为 6,归属为两个乙基中甲基上的氢.产物的氢谱数据如下:
1H NMR(400,MHz,CDCl3):δ 8.91(d,J=5.89,Hz,2H,Ar-H),8.62(d,J=4.17,Hz,1H,Ar-H),7.72(m,J=47.52,Hz,2H,Ar-H),7.35~7.26(m,J=24.73,Hz,4H,Ar-H),3.49(m,J=19.83,Hz,4H,CH2),1.41(m,J=13.73,Hz,6H,CH3).

图9 化合物4的1H NMR谱图Fig. 9 1H NMR spectrum of Compound 4
2.5 咪唑盐与吲唑盐制备过程的比较
咪唑中两个氮原子之间有一个碳原子,而吲唑中的两个氮原子处于邻位.由于氮原子的电负性大于碳原子,因此吲唑中氮原子的电荷密度会小于咪唑中的氮原子电荷密度使亲核取代反应难以进行.因此,在制备吲唑盐时,用极性较大的乙腈作为溶剂,有利于盐的生成.
另外,由于碘是一个很好的离去基团,碘乙烷是一个比溴乙烷更强的烷基化试剂.因此,在制备咪唑盐时使用的是溴乙烷,而在制备吲唑盐时则使用的是碘乙烷.
3 结 语
本文以咪唑和吲唑为原料合成了两种卡宾前体及相应后过渡金属 Pd(Ⅱ)配合物.以咪唑盐作为卡宾前体,在 K2CO3存在的条件下,与 PdCl2在吡啶中反应,分离得到了氮杂环卡宾 Pd(Ⅱ)配合物,其中Pd(Ⅱ)与卡宾和吡啶同时配位.以吲唑盐作为卡宾的前体,尝试了吲唑衍生的卡宾 Pd(Ⅱ)配合物的合成.核磁共振结果表明,实验中利用溴乙烷制备咪唑盐,碘乙烷和乙腈制备吲唑盐能够达到较好的效果,并且成功合成了两种氮杂环卡宾 Pd(Ⅱ)配合物,即(1,3-二乙基咪唑基)吡啶基二氯化钯(Ⅱ)和(1,2-二乙基吲唑基)吡啶基二溴化钯(Ⅱ).
[1] O'Brien C J,Kantchev E A B,Valente C,et al. Easily prepared air-and moisture-stable Pd-NHC(NHC=N-Heterocyclic Carbene)complexes:A reliable,user-friendly,highly active palladium precatalyst for the Suzuki-Miyaura reaction[J]. Chemistry-A European Journal,2006,12(18):4743-4748.
[2] Organ M G,Avola S,Dubovyk I,et al. A user-friendly,all-purpose Pd-NHC(NHC=N-heterocyclic carbene)precatalyst for the negishi reaction:A step towards a universal cross-coupling catalyst[J]. Chemistry-A European Journal,2006,12(18):4749-4755.
[3] Wanzlick H W. Aspects of nucleophilic carbene chemistry[J]. Angewandte Chemie International Edition,1962,1(2):75-80.
[4] Organ M G,Abdel-Hadi M,Avola S,et al. Biaryls made easy:PEPPSI and the Kumada-Tamao-Corriu reaction[J]. Chemistry-A European Journal,2007,13(1):150-157.
[5] Valente C,Baglione S,Candito D,et al. High yielding alkylations of unactivated sp3and sp2centres with alkyl-9-BBN reagents using an NHC-based catalyst:Pd-PEPPSI-IPr[J]. Chemical Communications,2008(6):735-737.
[6] Organ M G,Calimsiz S,Sayah M,et al. Pd-PEPPSIIPent:An active,sterically demanding cross-coupling catalyst and its application in the synthesis of tetra-orthosubstituted biaryls[J]. Angewandte Chemie International Edition,2009,48(13):2383-2387.
[7] Achonduh G T,Hadei N,Valente C,et al. On the role of additives in alkyl-alkyl Negishi cross-couplings[J].Chemical Communications,2010,46(23):4109-4111.
[8] Calimsiz S,Sayah M,Mallik D,et al. Pd-PEPPSI-IPent:Low-temperature negishi cross-coupling for the preparation of highly functionalized,tetra-ortho-substituted biaryls[J]. Angewandte Chemie International Edition,2010,49(11):2014-2017.
[9] Dowlut M,Mallik D,Organ M G. An efficient lowtemperature Stille-Migita cross-coupling reaction for heteroaromatic compounds by Pd-PEPPSI-IPent[J]. Chemistry-A European Journal,2010,16(14):4279-4283.
[10] Nasielski J,Hadei N,Achonduh G,et al. Structureactivity relationship analysis of Pd-PEPPSI complexes in cross-couplings:A close inspection of the catalytic cycle and the precatalyst activation model[J]. Chemistry-A European Journal,2010,16(35):10844-10853.
[11] Valente C,Belowich M E,Hadei N,et al. Pd-PEPPSI complexes and the Negishi reaction[J]. European Journal of Organic Chemistry,2010(23):4343-4354.
[12] Calimsiz S,Organ M G. Negishi cross-coupling of secondary alkylzinc halides with aryl/heteroaryl halides using Pd-PEPPSI-IPent[J]. Chemical Communications,2011,47(18):5181-5183.
[13] Hadei N,Achonduh G T,Valente C,et al. Differentiating C=Br and C=Cl bond activation by using solvent polarity:Applications to orthogonal alkyl-alkyl Negishi reactions[J]. Angewandte Chemie International Edition,2011,50(17):3896-3899.
[14] Hoi K H,Çalimsiz S,Froese R D J,et al. Amination with Pd-NHC complexes:Rate and computational studies on the effects of the oxidative addition partner[J]. Chemistry-A European Journal,2011,17(11):3086-3090.
[15] Hunter H N,Hadei N,Blagojevic V,et al. Identification of a higher-order organozincate intermediate involved in negishi cross-coupling reactions by mass spectrometry and NMR spectroscopy[J]. Chemistry-A European Journal,2011,17(28):7845-7851.
[16] Valente C,Çalimsiz S,Hoi K H,et al. The development of bulky palladium NHC complexes for the mostchallenging cross-coupling reactions[J]. Angewandte Chemie International Edition,2012,51(14):3314-3332.
[17] 李玉. 苯并咪唑类卡宾钯化合物的合成及其在N-芳基化反应中的应用[D]. 郑州:郑州大学,2010.
[18] Arduengo III A J,Goerlich J R,Krafczyk R,et al. 1,3,4,5-Tetraphenylimidazol-2-ylidene:The realization of Wanzlick's dream[J]. Angewandte Chemie International Edition,1998,37(13/14):1963-1965.
[19] Meiries S,Le Duc G,Chartoire A,et al. Large yet flexible N-heterocyclic carbene ligands for palladium catalysis[J]. Chemistry-A European Journal,2013,19(51):17358-17368.
[20] Kumar A,Katari M,Ghosh P. Understanding the lability of atransbound pyridine ligand in a saturated sixmembered N-heterocyclic carbene based(NHC) PdCl2(pyridine)type complex:A case study[J]. Polyhedron,2013,52:524-529.
[21] Zhong R,Pöthig A,Feng Y,et al. Facile-prepared sulfonated water-soluble PEPPSI-Pd-NHC catalysts for aerobic aqueous Suzuki-Miyaura cross-coupling reactions[J]. Green Chemistry,2014,16(12):4955-4962.

