稻田土壤厌氧氨氧化菌群落结构对长期不同施肥的响应*
聂三安 王 祎 王 飞 杨 静 周碧青 邢世和†
(1 福建农林大学生命科学学院,福州 350002)
(2 福建农林大学资源与环境学院,福州 350002)
(3 福建省农业科学院土壤肥料研究所,福州 350003)
稻田是我国典型的农业生态系统,与人类关系密切,受人为干扰较大。为了获得高产,各种不同形式的氮肥长期大量投入,引起氨挥发和硝酸盐淋溶、径流及反硝化等氮损失过程[1]。长期以来,反硝化被认为是稻田土壤氮素损失的最主要生物学途径,但随着20世纪末厌氧氨氧化的发现改变了这一传统观点[2],厌氧氨氧化导致土壤氮素的损失不可忽略[3-4]。厌氧氨氧化是在厌氧或微氧条件下,厌氧氨氧化菌以亚硝酸盐为电子受体将氨氮氧化为氮气和水的生物反应过程,是生态系统氮循环的重要环节,在湿地生态系统中广泛发生。过去的研究大多集中在海洋[5-6]、湖泊[7-8]、河流岸边带[9]的厌氧氨氧化过程,针对稻田的研究主要针对单一肥料在短期内对厌氧氨氧化过程的影响[10-11],而关于长期不同施肥(化肥、有机肥、有机无机配施)对厌氧氨氧化过程的效应研究十分有限。
厌氧氨氧化菌广泛存在于农业土壤中[11-12]。参与厌氧氨氧化反应的微生物属于细菌域浮霉菌门的Brocadiales(目名,中文译名未定),目前已探知的厌氧氨氧化菌有5个属:Candidatus Brocadia、Candidatus Kuenenia、Candidatus Anammoxoglobus、Candidatus Jettenia和Candidatus Scalindua,这5个属均已在农业土壤中发现[4,11,13],但这些研究因大部分未进行高通量测序无法获得具体的厌氧氨氧化菌相对丰度及多样性数据。利用新一代高通量测序技术可以破译微生物群落结构,结合土壤因子的变化,可以反映微生物对环境因子的响应机制[14]。中国不同地区旱地农田土壤的研究表明,厌氧氨氧化菌丰度为每克干土6.4×104~3.7×106个拷贝数,厌氧氨氧化菌的优势种群为Candidatus Brocadia,其多样性和群落结构与土壤有机质和氨含量显著相关[13]。中国东北典型白浆土水稻土的优势种群是Candidatus Scalindua,且4 a种植水稻的厌氧氨氧化菌多样性高于1 a和9 a种植水稻土壤[12]。对中国南方典型水稻土的研究表明,厌氧氨氧化菌丰度为每克干土1.2×104~9.6×104个拷贝数,可检测到Candidatus Brocadia和Candidatus Kuenenia两个属,厌氧氨氧化菌群落结构受pH和氨浓度显著影响[11]。已有的研究表明,厌氧氨氧化菌在不同稻田土壤中的数量和群落结构不尽相同,不同肥料种类和种植方式的土壤中丰度和种群分布也具有一定差异。
因此,本研究选择福建省农业科学院33 a长期定位试验田为研究对象,设置不施肥、单施化肥、无机肥配施牛粪、无机肥加秸秆还田四个处理,针对厌氧氨氧化的功能基因hzsA进行定量,并对厌氧氨氧化菌的16S rRNA基因在Illumina Miseq平台进行高通量测序,研究长期不同施肥稻田厌氧氨氧化微生物的数量和群落结构特征。
1 材料与方法
1.1 试验设计
本研究依托福建省农业科学院位于福建省闽侯县白沙镇(119°04′10″E,26°13′31″N)的长期定位试验田。供试土壤类型为黄泥田,成土母质为低丘红壤坡积物。定位试验于1983年开始。试验地1983—2004年采用双季稻轮作,2005年开始采用单季稻种植。
设置(1)不施肥(CK)、(2)单施氮磷钾化肥(NPK)、(3)氮磷钾加牛粪(NPKM)、(4)氮磷钾加秸秆还田(NPKS)四个处理,每个处理3次重复,小区面积12 m2(3 m×4 m),小区之间采用随机区组排列,用水泥埂隔开。施肥量为:CK处理不施用任何肥料,其余处理无机肥施用量均为N 103.5 kg hm-2(尿素),P2O527.0 kg hm-2(过磷酸钙)和K2O 135.0 kg hm-2(氯化钾)。牛粪养分含量为有机质394.2 g kg-1,N 15.8 g kg-1,P2O58.8 g kg-1和K2O 11.7 g kg-1,施用量(干基)为3 750 kg hm-2;秸秆养分含量为有机质647.4 g kg-1,N 11.0 g kg-1,P2O53.8 g kg-1和K2O 20.4 g kg-1,施用量为上茬秸秆全部回田,多年平均还田量为4 500 kg hm-2。
1.2 土壤样品采集与基本理化性质分析
土壤样品采集于2016年7月,为水稻种植之前。采样方法:用土钻在每个小区采用对角线多点采样法采集耕层(0~20 cm)土壤样品,混匀后采用四分法保留样品。样品分为两部分,一部分立即液氮冷却后带回实验室冷冻干燥,用于分子生物学分析;另一部分鲜样带回实验室后,或直接用于铵态氮(NH4+-N)和硝态氮(NO3--N)分析,或室内自然风干后过2 mm筛用于总有机碳、全氮、盐度(电导率)和pH分析。
土壤样品相关理化性质分析参照《土壤农业化学分析方法》[15]中的分析方法。其中,铵态氮(NH4+-N)和硝态氮(NO3--N)采用KCl(2 mol L-1)浸提,流动注射仪(FIA QC8500,Lachat,美国)分析测定。总有机碳、全氮采用总有机碳分析仪(TOC-V CPH,SHIMADZU,日本)进行分析。土壤pH采用水土比为1︰2.5,pH计测定。盐度测定采用中华人民共和国环境保护标准(HJ 802-2016)方法[16]测定。
1.3 DNA提取与实时荧光定量PCR
称取约0.5 g冷冻干燥后的土壤,按照土壤DNA快速提取试剂盒的方法提取土壤总DNA。超微量紫外分光光度计(ND2000,Thermo,美国)检测DNA纯度。采用实时荧光定量PCR方法对土壤DNA中hzsA基因进行定量检测。定量仪器为TIB-8600(泰普,中国),引物为hzsA_1594F和hzsA_1857R,反应条件为预变性95℃ 3 min,扩增95℃ 10 s,63℃ 10 s,72℃ 10 s(45个循环),最终溶解曲线为82℃ 10 s。每个独立样品3次重复,反应体系20 μL,包括4 μL DNA模板,0.6 μL前引物和后引物,10 μL SYBR 2 Premix Ex Taq酶,1.0 μL牛血清白蛋白(20 mg mL-1),3.8 μL灭菌水。
1.4 高通量测序和序列分析
对于厌氧氨氧化菌16S rRNA基因,采用巢式PCR反应。第一次反应采用引物PLA46f-630r,反应条件为:预变性96℃ 10 min,扩增96℃ 60 s,56℃ 1 min(35个循环),溶解曲线72℃ 1 min。然后取1 mL PCR产物稀释500倍作为第二步扩增反应的模板。第二次反应的引物为Amx368f-Amx820r,反应条件为:预变性96℃10 min,扩增96℃ 30 s,58℃ 1 min(25个循环),溶解曲线72℃ 1 min。反应体系和反应条件参照Hefting等[17]的方法。扩增产物由2%琼脂糖凝胶电泳进行检测,经琼脂糖凝胶纯化试剂盒(Promega,Madison,WI)后用超微量紫外分光光度计ND 2000(Thermo,美国)测定浓度,通过Illumina Miseq平台(派森诺生物科技有限公司,上海)进行测序。
序列分析步骤如下:①序列整理和过滤:为了整合原始双端测序数据,首先采用滑动窗口法对FASTQ格式的双端序列逐一作质量筛查,要求碱基平均测序准确率大于99%,且不允许存在模糊碱基。随后,利用FLASH软件对通过质量初筛的双端序列根据重叠碱基进行配对连接,要求两条序列的重叠碱基长度大于10 bp,且不允许碱基错配。最后,根据每个样本所对应的Barcode序列信息,将连接后的序列识别分配入对应样本,获取有效序列。②操作分类单元(OTU)划分和分类地位鉴定:使用QIIME软件,调用序列比对工具UCLUST,对前述获得的序列按97%的序列相似度进行归并和OTU划分,并选取每个OTU中丰度最高的序列作为该OTU的代表序列。随后,根据每个OTU在样本中所包含的序列数,构建OTU在各样本中丰度的矩阵文件。在QIIME软件中通过将OTU代表序列与对应数据库的模板序列相比对,获取每个OTU所对应的分类学信息。
1.5 数据分析
数据处理采用Microsoft Excel 2010,图形处理采用SigmaPlot 12.5软件,采用SPSS 21.0软件进行单因素方差分析(one-way ANOVA),显著性检验采用邓肯(Duncan)法,不同字母表示在p<0.05水平具有显著性差异,相关性分析采用双尾检验。高通量测序多样性指数包括香农指数(Shannon index)、辛普森指数(Simpson index)、丰富度指数(Chao 1 index)等采用R 3.1.0软件运行。
2 结 果
2.1 长期不同施肥对土壤理化性质的影响
表1列出了长期不同施肥管理模式下稻田土壤基本理化性质。由表1可知,由于长期施肥(33 a)改变了土壤养分,有机质(OM)、全氮(TN)、铵态氮(NH4+-N)和盐度(EC)均发生了显著变化。与CK处理相比,NPKM和NPKS处理均显著增加了土壤有机质、全氮、氨态氮和盐含量,但CK处理与NPK处理差异不明显,说明有机无机配施更有利于土壤养分的提高。此外,NPKM处理的有机质、全氮、铵态氮含量与NPKS处理无显著差异。盐度的方差分析表明,有机无机配施有利于土壤盐的提高,且NPKS显著高于NPKM。不同处理之间土壤pH无显著差异。各处理硝态氮(NO3--N)含量均较低,且含量无显著差异。
2.2 长期不同施肥土壤厌氧氨氧化菌功能基因
为研究不同施肥对厌氧氨氧化菌数量的影响,采用荧光定量PCR技术分析了厌氧氨氧化菌功能基因hzsA的拷贝数。结果表明,不同处理之间hzsA基因丰度存在显著差异,且长期施肥处理基因丰度高于不施肥处理2个数量级(图1)。总体而言,有机无机配施高于单施无机肥,单施无机肥高于不施肥。其中,NPKM处理hzsA丰度最高(每克干土(3.6±0.2)×106个),NPKS处理次之(每克干土(2.9±0.2)×106个),且显著高于NPK处理(每克干土(1.3±0.2)×106个)和CK处理(每克干土(6.9±0.6)×104个)。因此,长期施肥显

表1 不同处理下的土壤理化性质Table 1 Effects of long-term different fertilization on soil physical-chemical properties relative to formula of the fertilization (n=3)
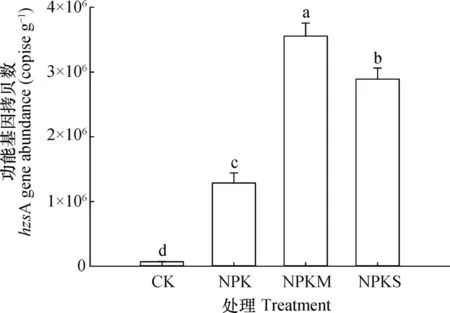
图1 长期不同施肥土壤厌氧氨氧化菌hzsA基因丰度Fig. 1 hzsA gene abundance in paddy soils under long-term fertilization relative to formula of the fertilization (n=3)
著提高了厌氧氨氧化菌丰度,且有机无机配施效果更为明显。
将厌氧氨氧化菌功能基因hzsA丰度与土壤理化性质做相关性分析(表2),结果发现,不同施肥处理厌氧氨氧化菌丰度与土壤有机质(r=0.999,p=0.001)和铵态氮(r=0.998,p=0.002)均呈极显著正相关,与全氮呈显著相关关系(r=0.988,p=0.012)。厌氧氨氧化菌功能基因的数量与土壤pH、盐度和硝态氮含量无显著相关关系。表明长期施肥土壤中,高土壤肥力(有机质及全氮)和铵态氮利于厌氧氨氧化菌的生长。
2.3 厌氧氨氧化菌的群落组成与多样性
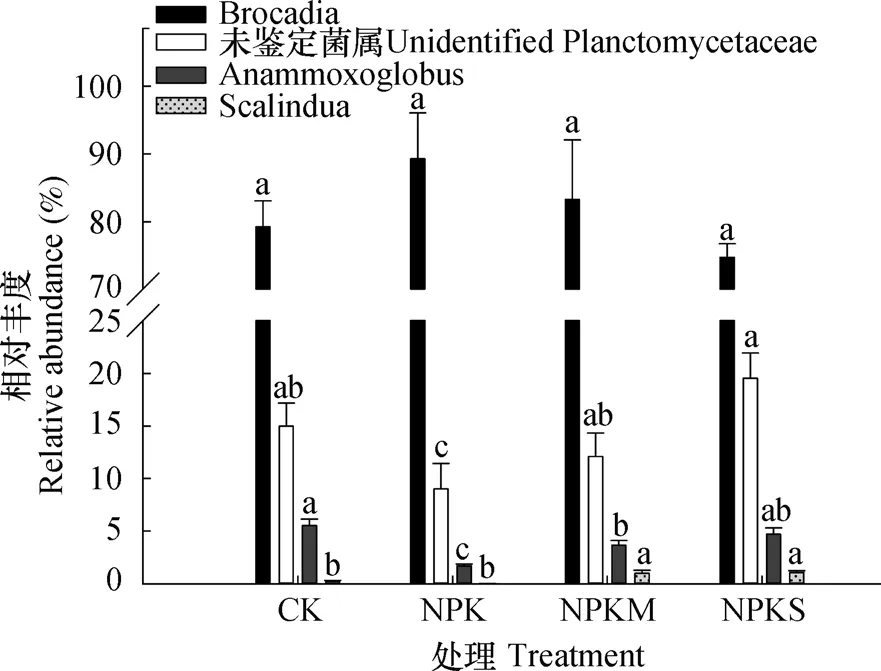
图2 长期不同施肥土壤厌氧氨氧化菌相对丰度Fig. 2 Relative abundance of anammox bacteria in paddy soils under long-term fertilization relative to formula of the fertilization
2.3.1厌氧氨氧化菌的群落组成 根据厌氧氨氧化菌16S rRNA基因高通量测序结果,对不同施肥稻田土壤厌氧氨氧化细菌的所有序列在97%的相似度下进行聚类,挑选出1 355条代表性序列,挑选出每个OTUs的代表序列加入DNA序列数据库(Genebank)中与已探明的厌氧氨氧化菌序列做参比序列,总共获得4类厌氧氨氧化菌:Candidatus Brocadia、Candidatus Anammoxoglobus、Candidatus Scalindua以及相当一部分未分离或不可培养的厌氧氨氧化菌(Unidentified Planctomycetaceae)。然后对代表性序列对应的OTUs中的样品序列进行注释,获得每个样品的厌氧氨氧化细菌群落组成的相对丰度(图2)。结果显示,长期不同施肥土壤厌氧氨氧化菌的优势种群为Candidatus Brocadia(74.70%~89.27%),且不同处理间无显著差异。其次为不可培养的厌氧氨氧化菌Unidentified Planctomycetaceae,相对丰度为9.00%~19.53%,其中C K处理(1 5.0 0%±2.1 8%)、N P K M处理(1 2.1 0%±2.2 3%)和N P K S处理(19.53%±2.39%)之间无显著差异,但显著高于NPK处理(9.00%±2.40%)。另外两种厌氧氨氧化菌Candidatus Anammoxoglobus和Candidatus Scalindua丰度较低(0.0 3%~5.5 3%)。其中CK处理Candidatus Anammoxoglobus相对丰度最高(5.5 3%±0.6 1%),N P K S处理次之(4.7 0%±0.6 1%),N P K M处理为3.6 7%±0.4 4%,显著高于N P K处理(1.70%±0.17%)。不同土壤中,仅有少量Candidatus Scalindua(0.03%~1.07%)被鉴定出来,有机无机配施处理(NPKS和NPKM)相对丰度(1.00%~1.07%)显著高于NPK处理和CK处理(0.03%~0.27%)。
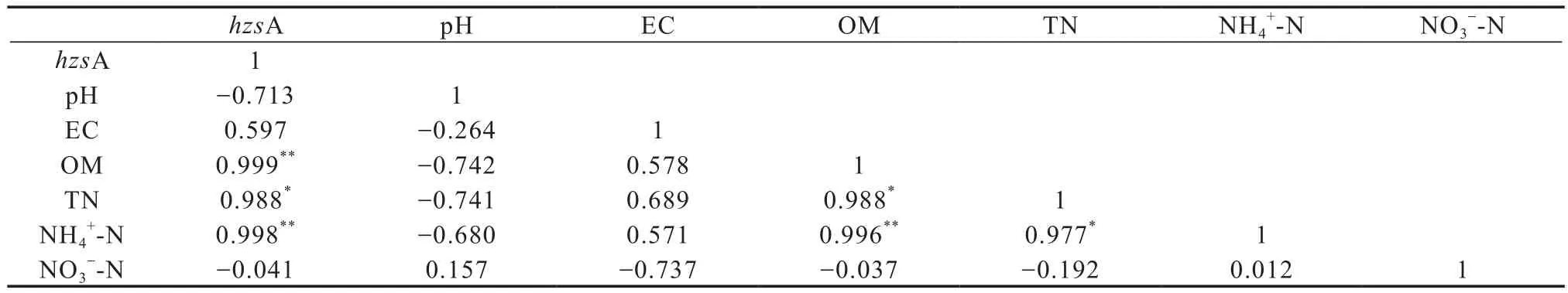
表2 不同施肥土壤厌氧氨氧化功能基因(hzsA)与理化性质的相关性Table 2 Pearson correlations between hzsA gene copies and soil physical-chemical properties under long-term fertilization relative to formula of the fertilization (n=4)
通过不同施肥处理厌氧氨氧化菌的群落组成与土壤基本理化因子的相关性分析发现(表3),所有样品中,仅发现Candidatus Scalindua相对丰度与土壤有机质(r=0.619,p=0.032)及氨态氮(r=0.607,p=0.036)呈正相关,其他种的相对丰度与所测土壤理化性质均无显著相关性。因此,在一定范围内高有机质和氨氮有利于Candidatus Scalindua在土壤中的富集生长。土壤厌氧氨氧化菌的相对丰度可能受土壤综合因素的影响。
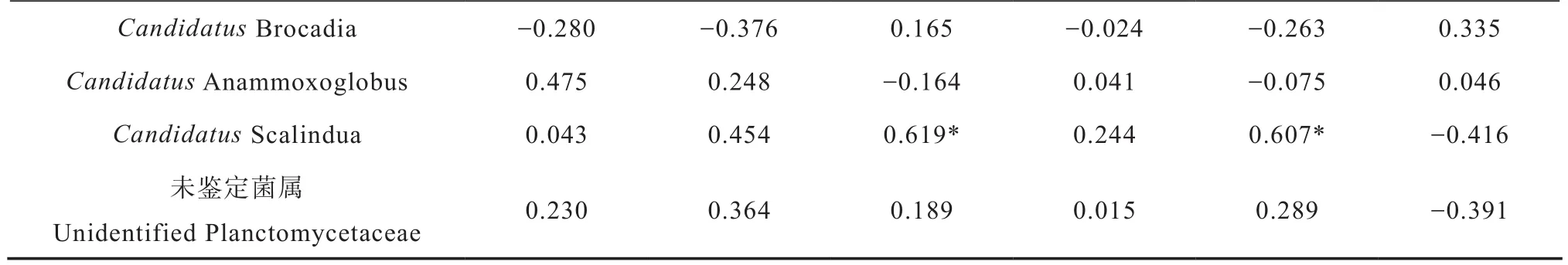
表3 不同施肥土壤厌氧氨氧化菌群落组成与理化性质的相关系数Table 3 Pearson correlations coefficient between community structure of anammox bacteria and soil physical-chemical properties under long-term fertilization relative to formula of the fertilization (n=12)
2.3.2 厌氧氨氧化菌的α多样性 本研究从OTUs水平上通过分析香农指数(Shannon index)、辛普森指数(Simpson index)及丰富度指数(Chao1 index)考察不同施肥处理厌氧氨氧化菌的α多样性。其中,香农指数表示物种的丰富度和均匀度;辛普森指数表示一个群落或生境内优势种的地位和作用,其值越高表明群落内物种数量分布越不均匀,优势种群的地位越突出;丰富度指数表示一个群落或生境内物种的复杂程度,值越高表明群落内物种数目越多。通过R3.1.0软件对样品OTUs进行多样性分析得出计算结果,见表4。总体而言,不同施肥处理的土壤样品中,不施肥(CK处理)和氮磷钾加秸秆还田(NPKS处理)厌氧氨氧化菌的群落多样性明显高于单施氮磷钾肥(NPK处理)和氮磷钾加牛粪(NPKM处理)。
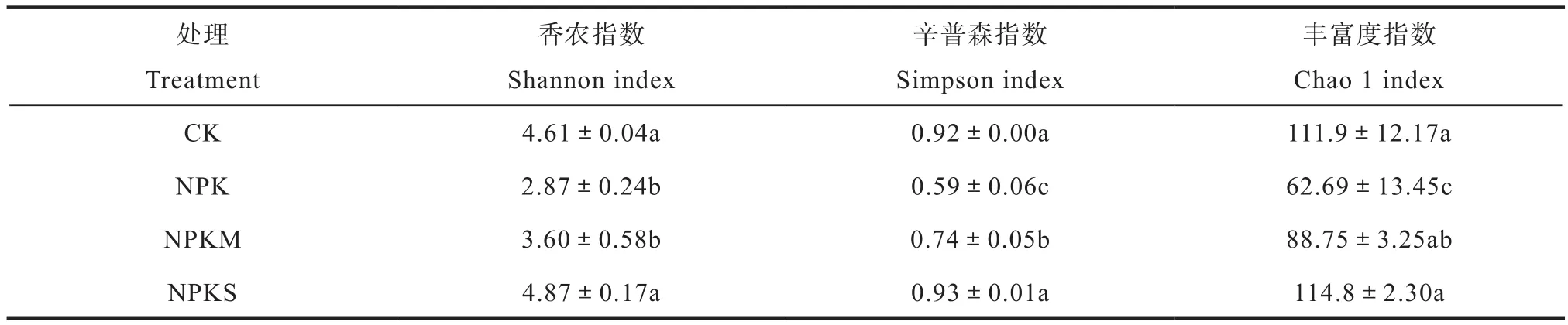
表4 长期不同施肥土壤厌氧氨氧化菌的α多样性指数Table 4 α-diversity index of anammox bacteria in paddy soils under long-term fertilization relative to formula of the fertilization(n=3)
比较不同施肥处理土壤厌氧氨氧化菌的α多样性指数发现,CK处理和NPKS处理多样性较高且差异不显著,说明这两个处理厌氧氨氧化菌多样性较为接近。NPK处理和NPKM处理多样性较低,除香农指数无显著差异外,NPKM处理的辛普森指数(0.74±0.05)和丰富度指数(88.75±3.25)显著高于N P K处理(分别为0.5 9±0.0 6和62.69±13.45)。因此,单施化肥和化肥加牛粪均降低了厌氧氨氧化菌的多样性,且在单施化肥处理中更为明显。通过分析不同处理α多样性指数与土壤理化因子之间的相关性,发现二者之间无显著相关关系(数据未列出),说明厌氧氨氧化菌多样性可能受土壤因子综合因素的影响。
3 讨 论
本研究应用新一代高通量测序技术结合荧光定量PCR技术,针对厌氧氨氧化菌的16S rRNA基因进行扩增测序,并对功能基因进行定量,研究了长期不同施肥对土壤厌氧氨氧化菌群落结构、多样性和数量的影响及其与土壤因子的关系。
3.1 长期不同施肥稻田土壤厌氧氨氧化菌群落组成差异的原因
已有研究表明Candidatus Brocadia是土壤中最主要的厌氧氨氧化菌[18-19],本研究结果表明,长期不同施肥处理稻田土壤的优势种群也是Candidatus Brocadia。大量研究表明,这类厌氧氨氧化菌更适合在土壤系统中生长,原因可能是相比于其他厌氧氨氧化菌,Candidatus Brocadia本身的代谢途径多样[20],可以利用更多的电子供体,如小分子有机酸、Fe2+、Mn2+等,还原亚硝酸盐(NO2-)生成氮气(N2)[21]。不同施肥处理可以检测到少量的Candidatus Scalindua,且有机无机配施处理相对丰度显著高于不施肥和单施化肥(图2),这很可能与盐度有关。在高盐度区域如海洋中优势种群通常是Candidatus Scalindua[22],对河口和河流沉积物的研究表明,Scalindua与盐度高度相关,但Brocadia和Kuenenia在低盐中丰度更高[23],说明Scalindua对高盐度具有更好的适应性。对中国东北白浆土的厌氧氨氧化菌群落结构研究表明,Scalindua是白浆水稻土中的优势种群[12],尽管原文未指出具体原因,推测很可能是白浆土的高盐基饱和度造成的[24-25]。本研究中,长期有机无机配施后显著提高了土壤盐度(表1),利于Scalindua的生长。但由于其盐度相对于海洋与河流沉积物等生态系统存在数量级上的差异,因此,在土壤中仅能检测到少量的Scalindua。相关分析结果还表明,Scalindua丰度也与土壤有机质和氨态氮含量具有一定的正相关关系,因此,土壤中Scalindua的生长不仅受盐度调控,也可能与有机质和氨态氮有关。不同施肥处理均可以检测到一定数量的Anammoxoglobus属(1.7%~5.5%),与中国32个不同旱地农田土壤Anammoxoglobus平均丰度3%接近[13],说明不同农业土壤Anammoxoglobus属的相对丰度较为接近。其他研究也在长期施肥土壤中鉴定出一定数量的Anammoxoglobus属[4,26],但不同处理之间的相对丰度差异原因仍有待深入研究。
3.2 长期不同施肥稻田土壤厌氧氨氧化菌多样性差异的原因
研究表明,土壤中厌氧氨氧化菌的生物多样性高于海洋[22]和淡水生态系统[27],这可能与土壤中存在复杂的多种微生态有关。本研究表明,不同施肥处理对厌氧氨氧化菌的多样性影响也不同。综合而言,不施肥和无机肥加秸秆还田处理的厌氧氨氧化菌多样性高于无机肥加牛粪处理,无机肥加牛粪处理又高于单施无机肥处理(表4)。一般认为,施肥处理会增加土壤微生物结构多样性[28-29],然而本研究表明,施肥在一定程度上降低了厌氧氨氧化菌多样性,且单施无机肥处理最为明显。对不同施氮水平的研究[30]表明,稻田厌氧氨氧化菌群落结构对高氮水平具有较高的响应,高氮处理的厌氧氨氧化菌群落多样性显著高于中、低氮和不施肥对照。但该研究仅对同一种施肥条件下进行,且因未进行测序分析无法得到具体的微生物群落信息[30]。最近,王蓥燕等[31]对石灰性紫色水稻土的研究结果表明,单施化肥和化肥配施猪厩肥均在一定程度上降低了厌氧氨氧化菌的多样性,本研究结果与之类似。然而,无机肥加秸秆还田不仅未降低厌氧氨氧化菌多样性,与不施肥处理相比,还有一定程度的提高(表4)。本研究认为这主要与施用有机肥料的组成成分、性质及腐解速度有关[32]。牛粪中含有较多的易分解有机氮成分,C/N比较低(约20.2~42.4:1),分解速度较快;秸秆的C/N较高(约43.5~58.2:1)[33],分解速率较慢。一方面,牛粪中较低的C/N可能会影响厌氧氨氧化菌的碳源代谢,使其养分和能源受限,如Li等[34]的研究表明,C/N比可能是影响厌氧氨氧化的重要因素;另一方面,过快的分解速度不能为厌氧氨氧化菌提供稳定的外界环境,而厌氧氨氧化菌自身是一类生长缓慢的微生物,本研究不施肥处理厌氧氨氧化菌多样性较高的结果也证实了该观点。因此,厌氧氨氧化菌的多样性对不同肥料种类的响应不尽相同。
3.3 厌氧氨氧化菌丰度与土壤性质的关系
长期定位施肥可以改善土壤理化性质,提高土壤肥力和作物产量,对土壤微生物生长的影响更加深刻[35]。厌氧氨氧化菌多样性与肥料性质有关,但其数量受土壤性质影响较大。本研究结果表明,由于长期施肥显著提高了土壤肥力(表1),厌氧氨氧化菌的数量也发生了显著变化(图1)。厌氧氨氧化菌数量与土壤有机质、全氮和铵态氮含量显著相关(表2)。铵态氮是厌氧氨氧化菌的底物来源,高铵态氮利于其生长,不同地区农田土壤的研究也表明,厌氧氨氧化菌丰度与有机质或铵态氮含量显著正相关[13]。土壤有机质和全氮也是微生物利用底物的重要来源,其含量往往对微生物的生长具有重要影响。本研究中,由于长期施肥,土壤肥力发生显著变化,有机无机配施有机质含量显著高于单施化肥,因此更利于厌氧氨氧化菌的生长。此外,长期施肥可以改善土壤结构和通气性,促进大颗粒团聚体的形成[36],这些环境也可能利于厌氧氨氧化菌在土壤中的富集。单施化肥也在一定程度上提高了土壤肥力,其厌氧氨氧化菌数量显著高于不施肥处理(图2)。
本研究从一定范围内揭示了厌氧氨氧化菌对长期施肥的响应及与土壤理化因子的关系。由于土壤是复杂的多相系统,且受人为因素干扰较大,对厌氧氨氧化菌与土壤关键因子的生物调控机理及其他指标(如容重、溶解氧、氧化还原电位、温度、土壤团聚体、孔隙度等)与厌氧氨氧化菌的关系尚有待深入研究。此外,不同田间管理措施,如灌溉、轮作方式、耕作如何通过影响土壤进而对厌氧氨氧化过程进行调控也有待进一步研究。
4 结 论
本文通过高通量测序和荧光定量PCR技术对不同施肥模式下厌氧氨氧化微生物的数量和群落多样性进行分析,主要有以下结论:(1)长期不同施肥显著改变了厌氧氨氧化菌的数量,厌氧氨氧化菌数量与有机质、全氮和氨态氮呈显著正相关关系;(2)长期施肥稻田土壤中主要的厌氧氨氧化菌为Candidatus Brocadia、Candidatus Anammoxoglobus和Candidatus Scalindua,其中优势种群为Candidatus Brocadia;(3)厌氧氨氧化菌多样性与土壤基本理化性质无显著相关性,但很可能与肥料性质有关,厌氧氨氧化菌对不同施肥的响应不同。
[ 1 ] 朱兆良. 中国土壤氮素研究. 土壤学报,2008,45(5):778—783 Zhu Z L. Research on soil nitrogen in China (In Chinese). Acta Pedologica Sinca,2008,45(5):778—783
[ 2 ] Mulder A,van de Graaf A A,Robertson L A,et al. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor. FEMS Microbiology Ecology,1995,16(3):177—183
[ 3 ] Nie S A,Li H,Yang X R,et al. Nitrogen loss by anaerobic oxidation of ammonium in rice rhizosphere.ISME Journal,2015,9(9):2059—2067
[ 4 ] Zhu G B,Wang S Y,Wang Y,et al. Anaerobic ammonia oxidation in a fertilized paddy soil. ISME Journal,2011,5(12):1905—1912
[ 5 ] Dalsgaard T,Canfield D E,Petersen J,et al. N2production by the anammox reaction in the anoxic water column of Golfo Dulce,Costa Rica. Nature,2003,422(6932):606—608
[ 6 ] Hamersley M R,Lavik G,Woebken D,et al.Anaerobic ammonium oxidation in the peruvian oxygen minimum zone. Limnology and Oceanography,2007,52(3):923—933
[ 7 ] Dale O R,Tobias C R,Song B K. Biogeographical distribution of diverse anaerobic ammonium oxidizing(anammox) bacteria in Cape Fear River Estuary.Environmental Microbiology,2009,11(5):1194—1207
[ 8 ] Trimmer M,Nicholls J C,Deflandre B. Anaerobic ammonium oxidation measured in sediments along the Thames Estuary,United Kingdom. Applied and Environmental Microbiology,2003,69(11):6447—6454
[ 9 ] Zhu G B,Wang S Y,Wang W D,et al. Hotspots of anaerobic ammonium oxidation at land-freshwater interfaces. Nature Geoscience,2013,6(2):103—107
[10] Bai R,Xi D,He J Z,et al. Activity,abundance and community structure of anammox bacteria along depth profiles in three different paddy soils. Soil Biology &Biochemistry,2015,91:212—221
[11] Yang X R,Li H,Nie S A,et al. Potential contribution of anammox to nitrogen loss from paddy soils in southern China. Applied and Environmental Microbiology,2015,81(3):938—947
[12] Wang J,Gu J D. Dominance of Candidatus Scalindua species in anammox community revealed in soils with different duration of rice paddy cultivation in Northeast China. Applied Microbiology and Biotechnology,2013,97(4):1785—1798
[13] Shen L D,Liu S,Lou L P,et al. Broad distribution of diverse anaerobic ammonium-oxidizing bacteria in Chinese agricultural soils. Applied and Environmental Microbiology,2013,79(19):6167—6172
[14] 郑燕,贾仲君. 新一代高通量测序与稳定性同位素示踪DNA/RNA技术研究稻田红壤甲烷氧化的微生物过程. 微生物学报,2013,53(2):173—184 Zheng Y,Jia Z J. Next generation sequencing and stable isotope probing of active microorganisms responsible for aerobic methane oxidation in red paddy soils (In Chinese). Acta Microbiologica Sinica,2013,53(2):173—184
[15] 鲁如坤. 土壤农业化学分析方法. 北京:中国农业科学技术出版社,2000 Lu R K. Analytical methods for soil and agro-chemistry(In Chinese). Beijing:China Agricultural Science and Technology Press,2000
[16] 中华人民共和国环境保护部. 土壤电导率的测定电极法:HJ 802-2016. 北京:中国环境科学出版社,2016 Ministry of Environmental Protection of the People’s Republic of China. Soil quality-determination of conductivity-Electrode method:HJ 802-2016 (In Chinese). Beijing:China Environmental Science Press,2016
[17] Hefting M,Beltman B,Karssenberg D,et al. Water quality dynamics and hydrology in nitrate loaded riparian zones in the Netherlands. Environmental Pollution,2006,139(1):143—156
[18] Shen L D,Liu S,Huang Q,et al. Evidence for the cooccurrence of nitrite-dependent anaerobic ammonium and methane oxidation processes in a flooded paddy field. Applied and Environmental Microbiology,2014,80(24):7611—7619
[19] Wang Y,Zhu G,Harhangi H R,et al. Co-occurrence and distribution of nitrite-dependent anaerobic ammonium and methane-oxidizing bacteria in a paddy soil. FEMS Microbiology Letters,2012,336(2):79—88
[20] Gori F,Tringe S G,Kartal B,et al. The metagenomic basis of anammox metabolism in Candidatus ‘Brocadia fulgida’. Biochemical Society Transactions,2011,39(6):1799—1804
[21] Kartal B,van Niftrik L,Rattray J,et al. Candidatus‘Brocadia fulgida’:An autofluorescent anaerobic ammonium oxidizing bacterium. FEMS Microbiology Ecology,2008,63(1):46—55
[22] Schmid M C,Risgaard-Petersen N,van de Vossenberg J,et al. Anaerobic ammonium-oxidizing bacteria in marine environments:Widespread occurrence but low diversity. Environmental Microbiology,2007,9(6):1476—1484
[23] Amano T,Yoshinaga I,Okada K,et al. Detection of anammox activity and diversity of anammox bacteriarelated 16s rRNA genes in coastal marine sediment in Japan. Microbes and Environments,2007,22(3):232—242
[24] 贾会彬,刘峰,赵德林,等. 白浆土某些理化特性与改良的研究. 土壤学报,1997,34(2):130—137 Jia H B,Liu F,Zhao D L,et al. Research on some physical-chemical properties and improvement of planosols (In Chinese). Acta Pedologica Sinica,1997,34(2):130—137
[25] 律兆松,徐琪. 中国白浆土研究Ⅰ:白浆土机械组成特点及元素地球化学分异特征. 土壤学报,1993,30(3):274—288 Lü Z S,Xu Q. Study on albic soils in China Ⅰ:Mechanical comosition and geochemical elemental variability (In Chinese). Acta Pedologica Sinica,1993,30(3):274—288
[26] Shen L D,Wu H S,Gao Z Q,et al. Occurrence and importance of anaerobic ammonium-oxidizing bacteria in vegetable soils. Applied Microbiology and Biotechnology,2015,99(13):5709—5718
[27] Schubert C J,Durisch-Kaiser E,Wehrli B,et al.Anaerobic ammonium oxidation in a tropical freshwater system (Lake Tanganyika). Environmental Microbiology,2006,8(10):1857—1863
[28] Islam M R,Chauhan P S,Kim Y,et al. Community level functional diversity and enzyme activities in paddy soils under different long-term fertilizer management practices. Biology and Fertility of Soils,2011,47(5):599—604
[29] Zhao J,Ni T,Li Y,et al. Responses of bacterial communities in arable soils in a rice-wheat cropping system to different fertilizer regimes and sampling times. PLoS One,2014,9(1):e85301
[30] 宋亚娜,吴明基,林艳. 稻田厌氧氨氧化菌群落结构对氮肥的响应. 中国生态农业学报,2013,21(4):409—415 Song Y N,Wu M J,Lin Y. Response of anammox bacteria community structure to nitrogen in paddy soils(In Chinese). Chinese Journal of Eco-Agriculture,2013,21(4):409—415
[31] 王蓥燕,卢圣鄂,李跃飞,等. 石灰性紫色水稻土不同土壤深度中厌氧氨氧化细菌对施肥的响应. 中国农业科学,2017,50(16):3155—3163 Wang Y Y,Lu S E,Li Y F,et al. Response of anammox bacteria community structure and vertical distribution to different long-term fertilizations in calcareous purple paddy soil (In Chinese). Scientia Agricultura Sinica,2017,50(16):3155—3163
[32] 徐阳春,沈其荣,冉炜. 长期免耕与施用有机肥对土壤微生物生物量碳、氮、磷的影响. 土壤学报,2002,39(1):89—96 Xu Y C,Shen Q R,Ran W. Effects of zero-tillage and application of manure on soil microbial biomass C.N and P after sixteen years of cropping (In Chinese).Acta Pedologica Sinica,2002,39(1):89—96
[33] 陈贵,赵国华,汤银根,等. 不同动物粪便炭化特性比较. 江苏农业科学,2016,44(11):485—487 Chen G,Zhao G H,Tang Y G,et al. Comparison of Carbonization characteristics of different animal feces (In Chinese). Jiangsu Agricultural Sciences,2016,44(11):485—487
[34] Li H,Yang X R,Weng B S,et al. The phenological stage of rice growth determines anaerobic ammonium oxidation activity in rhizosphere soil. Soil Biology &Biochemistry,2016,100:59—65
[35] Murase J,Hida A,Ogawa K,et al. Impact of longterm fertilizer treatment on the microeukaryotic community structure of a rice field soil. Soil Biology& Biochemistry,2015,80(Supplement C):237—243
[36] Peoples M B,Brockwell J,Herridge D F,et al.The contributions of nitrogen-fixing crop legumes to the productivity of agricultural systems. Symbiosis,2009,48(1/3):1—17

