杉木小孢子叶球发育过程中形态结构变化
朱李奎 唐 亮 赵贝贝 路兆庚 王 莉*
(1.扬州大学园艺与植物保护学院,扬州 225009; 2.西藏农牧学院,林芝 860000)
杉木(Cunninghamialanceolata)雌雄异株,风媒传粉植物,现在被广泛栽培于亚洲各地以及其他地区,是典型亚热带树种。杉木应用广泛,涉及建筑、桥梁、家具、木制品等多个领域,相比于其他用材树种,具有干形通直、木材耐腐蚀,生长速度快、病虫害少、易加工等特点[1]。因此,杉木成为我国南方最主要的用材树种,也是我国南方造林面积最大的树种,具有重要的经济价值。
近几十年来,对于杉木的研究主要集中在森林培育[2~4]、生理生态[5~8]、生殖生物学[9~12]、遗传育种[13~16]等方面。而对于杉木雄性生殖器官发育的研究主要集中在小孢子叶球发育以及雄性不育的机理研究等,如徐进[17]等对杉木花粉母细胞减数分裂的细胞学特性及异常现象进行了研究,发现杉木四分体分裂方式主要是单平面分裂,导致花粉败育的原因可能是由于在杉木花粉形成过程中减数分裂异常引起的遗传物质不均衡分配。吕洪飞[18~20]等对杉木雄性不育株的小孢子叶球及小孢子囊发育进行了初步研究。以上研究为揭示杉木生殖生物学特点及其系统发育位置提供了基础资料。然而,杉木小孢子叶球的生长发育及其散粉的过程尚未见报道。系统研究和观察杉木小孢子叶球发育及其散粉规律对深入理解杉木传粉生物学具有重要意义。本研究采用体视镜观察、扫描电镜和半薄切片等方法,从形态学与组织学角度系统观察了杉木小孢子叶球的发育及散粉过程。主要包括以下四个方面的研究:小孢子叶球的形态特征、小孢子叶的形态特征、小孢子囊及囊壁的组织分化和散粉过程的形态变化。通过研究杉木小孢子叶球发育过程中的形态结构变化与组织分化,为杉木生殖发育、有性繁殖以及系统演化研究提供重要理论依据。
1 材料与方法
1.1 试验材料
实验所用杉木取自江苏省扬州市瘦西湖风景区(32°24′N,119°25′E)内,树体健壮,生长发育良好,无病虫害。在2012年1月下旬~2012年4月期间内,对生长条件一致的杉木进行连续取样,观察杉木小孢子叶球的发育及散粉的过程,并将采集的新鲜样品用戊二醛和FAA固定液固定后放入4℃冰箱中保存待用。
1.2 试验方法
1.2.1 数码相机观察法
定期观察杉木小孢子叶球的形态发育情况,每隔3天观察一次,并用数码相机拍照记录。在散粉期,每天拍摄一次。
1.2.2 体视镜观察法
将即将散粉的小孢子叶球置于体视镜(型号:Motic SMZ-168)下,每隔1 h观察一次散粉情况并拍照记录。
1.2.3 扫描电镜观察法
将传粉前后的杉木小孢子叶球浸入FAA固定液中固定后放入4℃冰箱中保存。样品取出后,用0.1 mol·L-1磷酸缓冲液清洗3次,每次15 min,梯度丙酮(50%、70%、80%、90%、95%、100%)各处理15 min,100%丙酮加无水硫酸钠2次各处理15 min,丙酮与乙酸异戊酯按比例2∶1、1∶1、1∶2混合液脱水处理各10 min,纯乙酸异戊酯处理一次30 min。脱水后在临界点干燥仪(型号:HCP-2)上干燥,然后在离子溅射喷镀仪(型号:SCD 500)上喷金20 min,最后将样品置于场发射扫描电子显微镜(型号:S-4800Ⅱ)下扫描并拍照[21]。
1.2.4 半薄切片观察法
2012年2月20日~3月15日期间,对杉木的小孢子叶球进行连续取样,样品用2.5%戊二醛固定液固定后置于4℃冰箱中保存一周左右。样品取出后,用0.1 mol·L-1磷酸缓冲液清洗3次,每次15 min,梯度乙醇(30%、50%、70%、80%、90%、100%)脱水处理各15 min,乙醇与丙酮2∶1、1∶1、1∶2混合液脱水处理各15 min,纯丙酮脱水处理一次15 min,脱水处理后用spurr树脂浸透包埋。包埋后的样品进行修样后,用超薄切片机(型号:ULTnb RACUTE)进行样品切片,切片后用甲苯胺蓝染色后置于光学显微镜(型号:LEICADMLS2)下观察并拍照[22]。
2 结果与分析
2.1 杉木雄球花发育过程的形态学特征
通过对扬州地区所试杉木的小孢子叶球进行连续两年形态学(图1:A)和物候期(图1:B)的观察发现,1月下旬,杉木的雄花芽着生于枝条顶端,花芽呈绿色,且外部有芽鳞包被(图1:C)。2月上旬,雄花芽的芽鳞逐渐张开,小孢子叶球逐渐伸到芽鳞外,每个雄花芽上着生约20个小孢子叶球,单个小孢子叶球体积较小,其上着生约50个小孢子叶(图1:D)。2月中下旬,小孢子叶球向下生长,几乎全部裸露在芽鳞外,小孢子叶球之间的间隙逐渐增大(图1:E)。3月上中旬,小孢子叶球体积增加明显,部分芽鳞被小孢子叶球挤压脱落,小孢子叶的体积也持续增加,小孢子叶之间的轮廓变得明显(图1:F)。3月中下旬,芽鳞几乎全部脱落,小孢子叶球上的小孢子叶清晰可辨,变为深红色(图1:G),此时小孢子叶球发育成熟,杉木进入散粉期。进入散粉期后,一般处于雄球花上部的小孢子叶球首先散粉,小孢子叶苞片张开,花粉自然散出(图1:H~I),散粉完成后,只剩苞片还着生在主轴上(图1:J)。综上,在形态学上,杉木小孢子叶球发育是一个体积逐渐变大、颜色逐渐加深的过程,但在散粉过程中,散粉首先从雄球花的上部的小孢子叶球开始,且散粉的过程较快。

图1 杉木小孢子叶球发育进程 A.杉木小孢子叶球;B.杉木小孢子物候期观察;C~J.杉木小孢子叶球发育及散粉过程(C.雄花芽形成;D~G.小孢子叶球生长发育;H~J.小孢子叶球散粉过程) MB.雄花芽;MC′.小孢子叶球;SB.芽鳞Fig.1 The development process of male cones in C.lanceolata A. The male cones of C.lanceolata; B. Phenology of male cones in C.lanceolata; C-J. The development and the the process of pollen release of male cones in C.lanceolata(C. The formation of male flower bud; D-G. Growth and development of microstrobilus; H-J. The process of pollen release in strobile) MB. Male flower bud; MC′. Male cone; SB. Subtending bract
2.2 杉木小孢子叶球及小孢子囊壁发育过程的观察
杉木的小孢子叶球由小孢子叶及其外部的鳞片组成,单个小孢子叶球的扫描电镜观察发现,10月中旬,杉木小孢子叶球形成,呈绿色,着生于新枝顶端,长约500 μm,宽约300 μm,小孢子叶螺旋排列在主轴上(图2:A~B)。11月中旬,小孢子叶球体积增大,长约2 mm,宽约1.5 mm,小孢子叶的体积也随之增大,外部的鳞片逐渐张开(图2:C~D)。到下年的1月中下旬,小孢子叶球体积进一步增加,长约4 mm,小孢子囊的体积随着小孢子叶的发育不断生长(图2:E)。2月,小孢子叶不断增大,逐渐突出到芽鳞外(图2:F)。3月中旬,小孢子叶球成熟,体积到达最大,长约9 mm,宽约5 mm,小孢子叶几乎全部突出到芽鳞外(图2:G~H)。每个小孢子叶一般由3个小孢子囊组成,3个小孢子囊呈三角形排列,每个小孢子囊长约300 μm,宽约60 μm(图2:I)。至此,杉木小孢子叶球成熟,即将进入散粉期。
杉木花粉是由小孢子囊内散出的,因此囊壁的发育过程对花粉散出有着重要作用。杉木的小孢子囊壁通常由3~4层细胞组成,分别为最外层的1层表皮细胞、1~2层中间层细胞和1层绒毡层细胞。对杉木发育过程中不同时期的小孢子囊进行半薄切片处理,观察其囊壁的生长发育过程。发现在2011年10月中旬,小孢子囊壁还没有分化形成,囊壁之间没有明显分层(图2:J),表明此时囊壁还未分化。至2012年1月中旬,发现囊壁的表皮细胞首先分化形成,并向内分化出2~3层细胞,这几层细胞紧靠表皮细胞,与中间的小孢子母细胞有明显的界限,表皮细胞的体积明显大于刚分化出的中间层的细胞(图2:K)。2月上旬,已经分化出的2~3层细胞继续分化形成中层和绒毡层,绒毡层呈线性排列,细胞成长条形,细胞核较为明显,而中层细胞呈不规则排布散状排列(图2:L)。2月下旬,绒毡层细胞体积增大,内突至小孢子囊内,细胞形状也由原来的长条形变为圆形(图2:M)。3月上旬,中层和绒毡层细胞逐渐解体(图2:N),到3月中下旬时,中层和绒毡层完全解体消失(图2:O)。
2.3 杉木小孢子叶球的散粉机制
对杉木小孢子叶球传粉前后的形态进行观察发现,在散粉之前,各小孢子叶螺旋着生在主轴上,排列紧密,几乎没有空隙,且颜色呈现绿色(图3:A)。散粉开始后,处于小孢子叶球基部的小孢子叶首先张开散粉,颜色由绿逐渐变黄(图3:B)。随着散粉进程的深入,小孢子囊从基部开始向顶端散粉(图3:C)。散粉后期所有小孢子囊的花粉全部散出,小孢子叶变为深红色,小孢子叶从主轴上脱落(图3:D)。整个散粉过程约经历18 h,前8 h散粉速度较慢,只有很少的花粉散出,随后散粉速度迅速增大,直到全部散出。
同时,对小孢子囊散粉过程进行观察后发现,在散粉前,着生在小孢子叶上的3个小孢子囊紧密排列在一起,呈佛手状(图3:E)。随后,小孢子囊彼此间分离(图3:F)。散粉开始,小孢子囊间的距离进一步加大,小孢子囊沿开裂口从基部开始破裂,花粉从开裂口散出(图3:G~I)。随着散粉过程不断进行,首先位于中间的小孢子囊完全破裂,花粉散出,随后两边的小孢子囊也开始散粉(图Ⅲ:J~M)。最后,3个小孢子囊全部破裂,花粉完全散出(图3:N~P)。单个小孢子囊的散粉过程经历8~10 h,一旦开裂口打开,花粉在20 min内呈爆炸状散出。
最后,对杉木散粉过程中的小孢子囊壁进行切片观察,发现在3月中旬,杉木的小孢子囊壁外壁向上形成许多带状突起加厚(图3:T),而开裂口处的囊壁却没有加厚,小孢子囊壁首先在开裂口破裂,小孢子囊沿开裂口纵向开裂,成熟花粉从开裂口散出(图3:Q~S),散粉完成。
3 讨论
雄球花是裸子植物重要的生殖器官,其形态特征在传粉过程中起着至关重要的作用[23~24]。杉木的雄球花为柔荑状,与冷杉(Abiesfaxoniana)、大别山五针松(Pinusdabeshanensis)、罗汉松(Podocarpusmacrophyllus)等裸子植物相同。这种花序的特点是花轴上着生许多无柄或是短柄的单性小花(雄花或雌花),其中雄花为柔荑花序的比较多见。有的花轴柔软下垂如水杉(Metasequoiaglyptostroboides),有的花轴直立如苏铁(CycasrevolutaThunb.)等。Urzay[25]指出在风媒传粉植物中,雄花呈长丝状或葇荑状的植物能够利用自身周围产生的气流动力将成熟花粉从孢囊内有效地散出。本研究中我们发现杉木雄球花的花轴直立,散粉后雄球花枯萎,但仍然长期宿存在枝上。杉木的雄球花通常分布于树冠的外部,着生于新枝的顶端。这点不同于小孢子叶球着生于叶腋处的罗汉松等,杉木的这种分布和着生方式可能是为了使雄球花更多的裸露在高空开阔处,在传粉过程中能够有效的降低叶片对花粉散出的阻碍。同时,杉木树体较高也有利于散出的花粉借助风力远距离传播,这些结构上的变化显然有利于提高散粉效率,可见杉木在长期的演化过程中,形成了许多有利于风媒传粉的结构特征。
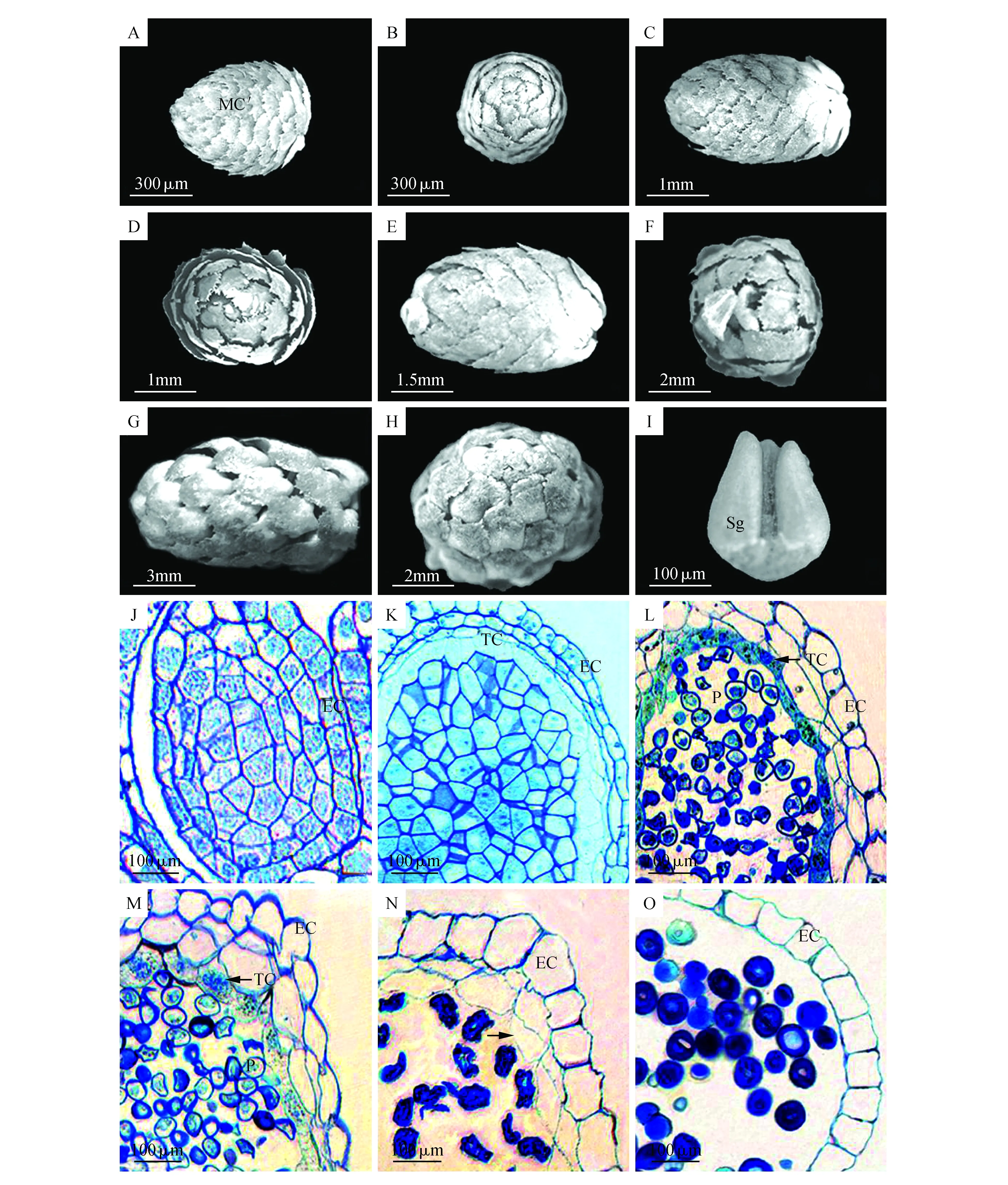
图2 杉木小孢子叶球扫描电镜及囊壁发育过程的结构观察 A~I.杉木单个小孢子叶球扫描电镜观察(A~H. 10月中旬至翌年3月中旬,小孢子叶球生长发育过程;I.成熟小孢子叶由3个小孢子囊和一个苞片组成);J~O.杉木小孢子囊壁发育过程半薄切片观察(K. 1月中旬,小孢子囊壁表皮细胞已经形成;L~M. 2月,绒毡层形成及生长;N~O. 3月,绒毡层逐渐解体与消失) MC′.小孢子叶球;Sg.小孢子囊;EC.表皮细胞;TC.绒毡层细胞;P.花粉粒Fig.2 The SEM of the microstrobilus and the anatomical structure of sac wall of male cones in C.lanceolata A-I. SEM images of single male cone of C.lanceolata(A-H. From mid-October to late mid-March, the process of growth and development of male cone in C.lanceolata; I. Mature microsporophyll consists of three microsporangiums and one bract.); J-O. The semi-thin slice observation on the developmental process of sporangial wall in C.lanceolate(K. In mid-January, the epidermal cell of sporangial wall have formed; L-M. In February, the formation and growth of tapetum; N-O. In March, the tapetum gradually disintegrated and disappeared.) MC′. Male cone; Sg. Sporangiole; EC. Epidermal cell; TC. Tapetum cell; P. Pollen grain

图3 杉木小孢子叶球的散粉过程及解剖结构 A~D.杉木单个小孢子叶球的散粉过程;E~P.杉木小孢子囊的散粉过程;Q~T.杉木小孢子叶囊壁的开裂特征 MA.主轴;SW.小孢子囊壁;Sg.小孢子囊;P.花粉;DL.开裂口Fig.3 The process of pollen release and the anatomical structure of microsporangium wall of male cone in C.lanceolata A-D. The process of pollen release of single male cone in C.lanceolata; E-P. The process of pollen release of the microsporangia in C.lanceolata; Q-T. The dehiscence of microsporophyll wall during pollen release in C.lanceolata MA. Main axis; SW. Sporangial wall; Sg. Microsporangium; P. Pollen; DL. Dehiscence line
此外,通过对杉木单个小孢子叶球和小孢子叶散粉过程的观察发现,散粉前小孢子叶和小孢子囊紧密排列在一起,散粉过程中,小孢子叶松散,位于小孢子叶上的3个小孢子囊也彼此分开,首先位于中间的小孢子囊从基部沿着开裂口到顶端依次开裂,然后位于两侧的小孢子囊再依次开裂,最后花粉完全散出。这种开裂顺序可以减少恶劣天气对传粉的影响,延长散粉时间,弥补花期不同步造成的花粉损失。
小孢子囊的开裂对花粉的成功散出起着关键作用[26]。多数被子植物的花药壁由4层细胞组成,由外到内依次为:表皮、内壁、中层和绒毡层[27],花药的开裂机制包括一系列的物理和生理过程。例如,水稻(Oryzasativa)花药的开裂是在内部花粉发育生长的压力、囊壁表皮向内弯曲的收缩力以及囊壁具有加厚带的内壁向外的弯曲力共同作用下完成的[28]。Keijzer等[29]通过对玉米(maize)花药开裂机制的研究发现,玉米是通过酶解作用使其花药开裂。而裸子植物的孢囊壁一般由3层细胞组成,如在水杉中[30],孢囊壁由表皮细胞、中层细胞和绒毡层细胞组成,其中层细胞随着小孢子囊的发育而解体退化。本研究的结果与水杉相似,杉木的小孢子囊壁由外层细胞、中层细胞和绒毡层细胞组成,3月中下旬,中层细胞和绒毡层细胞瓦解,小孢子囊壁外壁向上形成许多带状突起加厚,而在开裂口处囊壁却没有加厚,小孢子囊壁首先在开裂口破裂,小孢子囊沿开裂口纵向开裂,成熟花粉从开裂口散出。这种散粉机制的形成可能是由于细胞失水,胞内的细胞液内聚力增加,使细胞径向壁间产生一定的拉力,而无带状加厚的囊壁是应力的集中点,抗压能力薄弱,当细胞进一步失水后,便从此处破裂。外壁的加厚可以防止花粉在成熟增大时对囊壁形成机械伤害,保证花粉质量;开裂口的囊壁没有加厚说明在花粉成熟时有利于其从开裂口散出,减少阻力。这些结果表明尽管水杉是落叶树种、杉木是常绿树种,但两者具有相似的散粉机制。
1.彭万喜,吴义强,张仲凤,等.中国的杉木研究现状与发展途径[J].世界林业研究,2006,19(5):54-58.
Peng W X,Wu Y Q,Zhang Z F,et al.Situation and developing trends of Chinese-fir[J].World Forestry Research,2006,19(5):54-58.
2.雷布先,倪臻,唐海生.杉木多世代滚动式种子园营建技术研究[J].广西林业科学,2003,32(3):111-117.
Lei B X,Ni Z,Tang H S.Research on methods use for developing difference generation in breeding cycle of seed orchard in Chinese fir[J].Guangxi Forestry Science,2003,32(3):111-117.
3.刘欲晓.杉木种子园结实规律与种子高产稳产技术[J].湖南林业科技,2005,32(2):14-16,19.
Liu Y X.The fruit law and high-yield steady production techniques of seed yard ofCunninghamia[J].Hunan Forestry Science & Technology,2005,32(2):14-16,19.
4.郑璐嘉,黄志群,何宗明,等.林龄、叶龄对亚热带杉木人工林碳氮稳定同位素组成的影响[J].林业科学,2015,51(1):22-28.
Zheng L J,Huang Z Q,He Z M,et al.Influence of forest and foliar ages on the composition of stable carbon and nitrogen isotope ofCunninghamialanceolatain subtropic China[J].Scientia Silvae Sinicae,2015,51(1):22-28.
5.车少辉,张建国.基于自稀疏理论的杉木人工林密度指标研究[J].植物研究,2012,32(3):343-347.
Che S H,Zhang J G.Comparative study on stand density measures based on self-thinning theory for Chinese Fir plantation[J].Bulletin of Botanical Research,2012,32(3):343-347.
6.Trieu N B,陈宇,林小琴,等.不同种源越南杉木幼龄期叶绿素荧光特征比较[J].四川农业大学学报,2016,34(1):34-38.
Trieu N B,Chen Y,Lin X Q,et al.Chlorophyll fluorescence characteristics of Vietnam between different Chinese fir provenances[J].Journal of Sichuan Agricultural University,2016,34(1):34-38.
7.韩畅,宋敏,杜虎,等.广西不同林龄杉木、马尾松人工林根系生物量及碳储量特征[J].生态学报,2017,37(7):2282-2289.
Han C,Song M,Du H,et al.Biomass and carbon storage in roots ofCunninghamialanceolataandPinusmassonianaplantations at different stand ages in Guangxi[J].Acta Ecologica Sinica,2017,37(7):2282-2289.
8.魏晓骁,王士亚,陈爱玲,等.不同化感型杉木无性系对连栽地的生理响应[J].森林与环境学报,2017,37(1):22-28.
Wei X X,Wang S Y,Chen A L,et al.Physilolgical response of different allelopathic types of Chinese fir clones to continuous cropping obstacles soil[J].Journal of Forest and Environment,2017,37(1):22-28.
9.高智慧,史忠礼,许月明,等.杉木种子发育生理、涩籽成因及降低败育措施的研究[J].林业科学研究,2000,13(6):659-666.
Gao Z H,Shi Z L,Xu Y M,et al.Studies on the seed developmental physiology,the formation of the abortive seed and the measures of decreasing abortion inCunninghamialanceolata[J].Forest Research,2000,13(6):659-666.
10.Farjon A,Garcia S O.Cone and ovule development inCunninghamiaandTaiwania(Cupressaceae sensu lato) and its significance for conifer evolution[J].American Journal of Botany,2003,90(1):8-16.
11.沈捷,祝晨辰,徐进,等.硼、钙离子对杉木花粉萌发和花粉管生长影响[J].林业科技开发,2010,24(6):57-60.
Shen J,Zhu C C,Xu J,et al.Effects of mineral elements on pollen germination and pollen tube growth ofCunninghamialanceolate(Lamb.)Hook[J].China Forestry Science and Technology,2010,24(6):57-60.
12.张卓文.杉木生殖生物学特性研究[D].武汉:华中农业大学,2005.
Zhang Z W.Studies on Chinese fir reproduction characteristics[D].Wuhan:Huazhong Agricultural University,2005.
13.刘琼瑶.杉木NAC基因的克隆、表达和SNP分析[D].杭州:浙江农林大学,2015.
Liu Q Y.Isolation,expression and single nucleotide polymorphisms analysis of NAC genes in Chinese fir(Cunninghamialanceolata)[D].Hangzhou:Zhejiang A&F University,2015.
14.陈梦俅.60Co-γ辐照对杉木种子诱变效应研究[D].福州:福建农林大学,2016.
Chen M Q.A study of mutagenic effects on the seeds ofCunninghamialanceolata(Lamb.) Hook[D].Fuzhou:Fujian Agriculture and Forestry University,2016.
15.武星彤,文亚峰,韩文军,等.杉木荧光标记通用引物多重PCR微卫星基因分型技术的建立与应用[J].分子植物育种,2016,14(7):1795-1803.
Wu X T,Wen Y F,Han W J,et al.Establishment of microsatellite marker genotyping technology by multiplex PCR with fluorescently labelled universal primers and application on Chinese fir(Cunninghamialanceolata)[J].Molecular Plant Breeding,2016,14(7):1795-1803.
16.许业洲,唐万鹏,胡兴宜,等.杉木优良变异类型——罗田垂枝杉生物学特性研究[J].植物科学学报,2005,23(6):577-582.
Xu Y Z,Tang W P,Hu X Y,et al.Study on biological characteristics ofCunninghamialaceolata(Lamb.)Hk.cv.Luotian—A superior variation ofCunninghamialaceolata[J].Plant Science Journal,2005,23(6):577-582.
17.徐进,施季森,杨立伟,等.杉木花粉母细胞减数分裂的细胞学特性及异常现象的观察[J].林业科学,2007,43(11):32-36.
Xu J,Shi J S,Yang L W,et al.Cell biological characteristics and abnormal behavior during the meiosis of pollen mother cells inCunninghamialanceolata[J].Scientia Silvae Sinicae,2007,43(11):32-36.
18.吕洪飞,余象煜,李平,等.杉木雄性不育株与可育株小孢子囊发育的电镜研究[J].植物科学学报,1997,15(2):97-102.
Lü H F,Yu X Y,Li P,et al.Electron microscope observation on the microsporangium development in male-sterlie plant and male-fertile plant ofCunninghamialanceolata[J].Plant Science Journal,1997,15(2):97-102.
19.吕洪飞,余象煜,李平,等.杉木雄性不育株与可育株的形态解剖学的比较研究[J].华东森林经理,1996,10(3):26-29.
Lü H F,Yu X Y,Li P,et al.A comparative study on morphology and anatomy of male sterile and fertile plant ofCunninghamialaceolata[J].East China Forest Management,1996,10(3):26-29.
20.吕洪飞,余象煜,李平,等.杉木雄性不育接穗与可育砧木小孢子叶球和叶的生理生化的研究[J].浙江师范大学学报:自然科学版,1997,20(2):73-77.
Lü H F,Yu X Y,Li P,et al.Studies on the interaction of physiology and biochemistry of microstrobilus and leaves between male sterile scion and fertile stock inCunninghamialanceolata[J].Journal of Zhejiang Normal University:Natural Sciences,1997,20(2):73-77.
21.马开骠,唐亮,崔佳雯.杉木花粉发育过程中形态结构的变化研究[J].广西植物,2017,37(10):1342-1347.
Ma K B,Tang L,Cui J W,et al.Change of morphological structure during pollen development process inCunninghamialanceolate[J].Guihaia,2017,37(10):1342-1347.
22.姜蓓,唐亮,路兆庚,等.杉木大孢子叶球发育过程中形态结构的变化[J].植物科学学报,2017,35(4):469-476.
Jiang B,Tang L,Lu Z G,et al.Morphological and structural changes during female cone development inCunninghamialanceolata[J].Plant Science Journal,2017,35(4):469-476.
23.Niklas K J.The aerodynamics of wind pollination[J].Botanical Review,1985,51(3):328-386.
24.Di-Giovanni F,Kevan P G.Factors affecting pollen dynamics and its importance to pollen contamination:a review[J].Canadian Journal of Forest Research,1991,21(8):1155-1170.
25.Urzay J,Smith S G L,Thompson E,et al.Wind gusts and plant aeroelasticity effects on the aerodynamics of pollen shedding:a hypothetical turbulence-initiated wind-pollination mechanism[J].Journal of Theoretical Biology,2009,259(4):785-792.
26.Keijzer C J.The processes of anther dehiscence and pollen dispersal.Ⅰ.The opening mechanism of longitudinally dehiscing anthers[J].New Phytologist,1987,105(3):487-498.
27.胡适宜.被子植物生殖生物学[M].北京:高等教育出版社,2005.
Hu S Y.Reproductive biology of angiosperms[M].Beijing:Higher Education Press,2005.
28.Matsui T,Omasa K,Horie T.Mechanism of anther dehiscence in rice(OryzasativaL.)[J].Annals of Botany,1999,84(4):501-506.
29.Keijzer C J,Leferink-Ten Klooster H B,Reinders M C.The mechanics of the grass flower:anther dehiscence and pollen shedding in maize[J].Annals of Botany,1996,78(1):15-21.
30.Jin B,Tang L,Lu Y,et al.Temporal and spatial characteristics of male cone development inMetasequoiaglyptostroboidesHu et Cheng[J].Plant Signaling & Behavior,2012,7(12):1687-1694.

