鲊广椒细菌多样性评价及其对风味的影响
王玉荣 沈 馨 董 蕴 尚雪娇 郭 壮
(湖北文理学院食品科学技术学院,湖北 襄阳 441053)
鲊广椒又称鲊海椒、鲊金椒或鲊辣椒,是中国云南、贵州、四川和成都等少数民族地区的特色传统发酵食品,湖北省恩施、襄阳、宜昌和荆门亦有制作和食用鲊广椒的习俗[1]。不同地区因物产资源不同,其制作原料和工艺亦有较大的不同[2],宜昌地区通常使用大米面、鲜红辣椒、玉米面和食盐为主要原料进行鲊广椒制备。由于使用原料及制作工艺的不同,鲊广椒中微生物菌群信息可能丰富而复杂,因而不同农户家庭制作的鲊广椒品质存在较大的差异。值得一提的是,目前市场上尚无成熟的鲊广椒产品,因而全面系统地解析其微生物多样性信息,对实现鲊广椒的产业化生产可能具有积极的意义。
Miseq测序技术具有通量高、检测速度快和检测结果准确的特点[3],实现了对某一微生态系统中微生物群落结构全面、客观、无偏地揭示。目前已在发酵肉制品[4]、浓香型白酒窖泥[5]、发酵果酒[6]、发酵蔬菜[7]、饮用水[8]和发酵茶[9]微生物群落结构解析中有着广泛的应用。作为一种新颖的检测复杂风味的仪器,电子鼻由具有选择性的化学传感器阵列和模式识别系统构成[10],目前已应用在肉制品加工[11]、农产品检测[12]和发酵制品风味识别[13]等领域。
本研究从湖北省宜昌市当阳地区农户家中采集了8 个鲊广椒样品,在解析样品细菌微生物群落结构的基础上,进一步依据便携式电子鼻系统对不同样品挥发性物质的响应差异进行了测定,探讨了细菌多样性对鲊广椒风味的影响,以期为后续鲊广椒用发酵剂的制备及鲊广椒的产业化提供指导。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与试剂
鲊广椒样品:从宜昌市农户家中使用一次性采样勺采集8 份鲊广椒样品,每个样品约采集30 g并装入无菌采样管中保存。样品采集后迅速置于含有冰袋的采样箱中,冷链运送回实验室,于-80 ℃冰箱中冷冻贮存以备用;
QIAGEN DNeasy mericon Food Kit:德国QIAGEN公司;
FastPfu Fly DNA 聚合酶、三磷酸脱氧核糖核苷酸混合液、其他PCR反应试剂:北京全式金生物技术有限公司;
引物338F、引物806R:由天一辉远生物科技有限公司合成。
1.1.2 主要仪器设备
高通量测序平台:Miseq PE300型,美国Illumina公司;
便携式电子鼻(配置W1C、W5S、W3C、W6S、W5S、W1S、W1W、W2S、W2W和W3S 10 个金属氧化物半导体型化学传感元件):PEN3型,德国Airsense公司;
机架式服务器:R920型,美国DELL公司;
凝胶成像分析系统:UVPCDS8000型,美国UVP公司。
1.2 方法
1.2.1 DNA提取、PCR扩增及高通量测序 取1.0 g榨广椒,使用DNA 提取试剂盒对微生物宏基因组进行提取,并以此为模板进行细菌16S rRNA V3-V4区扩增。扩增体系:10 ng DNA模板,0.4 μL 5 U/μL DNA聚合酶,0.8 μL 5 μmol/L 正向引物,0.8 μL 5 μmol/L反向引物,2 μL 2.5 mmol/L dNTPs mix,4 μL 5×PCR缓冲液,体系用ddH2O补充至20 μL。扩增条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s, 35 个循环重复后72 ℃延伸10 min。扩增产物使用Miseq PE300型平台进行高通量测序。
1.2.2 序列优化及质控 按照序列间的重叠关系对Miseq PE300型平台下数据进行拼接,在拼接过程中要求重叠区的碱基数≥10 bp或最大错配比率≤0.2,同时要求引物碱基错配数≤2 bp,且切除引物后序列的长度在50 bp以上,若序列不符合上述条件则予以剔除。
1.2.3 生物信息学分析 应用QIIME平台(v1.70)进行生物信息学分析[14]:① 在使用PyNAST对序列排齐的基础上[15],按照100%相似性进行序列UCLUST归并[16];② 按照97.0%的相似度,将16s rRNA V3-V4区集中的序列进行分类操作单元(Operational taxonomic units,OTU)划分;③ 使用Ribosomal Database Project[17]和Greengenes[18]数据库明确各OTU的分类学地位;④ 在使用FastTree软件[19]绘制系统发育进化树的基础上计算α多样性;⑤ 在计算UniFrac距离的基础上计算β多样性。
1.2.4 优势及核心菌群的定义 若某一细菌属或OTU的平均相对含量≥1.0%,则将其定义为优势菌属或OTU;若在所有样品中均存在则将其定义为核心菌属或OTU;若在所有样品中均存在且相对平均含量>1.0%,则将其定义为优势核心菌属或OTU。
1.2.5 核酸登录号 序列提交至MG-RAST数据库(http: //metagenomics.anl.gov/),登录号为mgp80896。
1.2.6 鲊广椒风味品质的评价 在室温下(25 ℃),准确称取3.0 g鲊广椒样品于样品瓶中,使用PEN3型便携式电子鼻对样品进行检测,待传感器信号稳定后选定49,50,51 s为信号采集时间,并将3 个点的平均值作为最终结果。每个样品平行做3 次重复。
1.2.7 多元统计学分析 在构建电子鼻各传感器响应值与对应样品各细菌属相对含量矩阵的基础上,使用皮尔森相关性分析法计算两者间的相关系数,同时选取绝对值>0.5的指标,采用Cytoscape软件绘制相关性网络图;将核心OTU相对含量开平方后,采用热图(Heatmap)对结果进行展示。
2 结果与分析
2.1 序列丰富度和多样性分析
纳入本研究的8 个鲊广椒样品16S rRNA测序基本信息见表1。
质量控制后,本研究共获得了256 094条高质量序列,根据100%相似性进行序列UCLUST归并后得到68 316条代表性序列,根据100%相似性进行OTU划分后得到3 853个OTU,其中12.48%的OTU不能鉴定到属水平。以测序深度为自变量,发现物种数和香农指数为因变量,对测序深度是否满足后续生物信息学分析的要求进行评估,纳入本研究8 个样品的稀疏曲线和香农指数见图1。
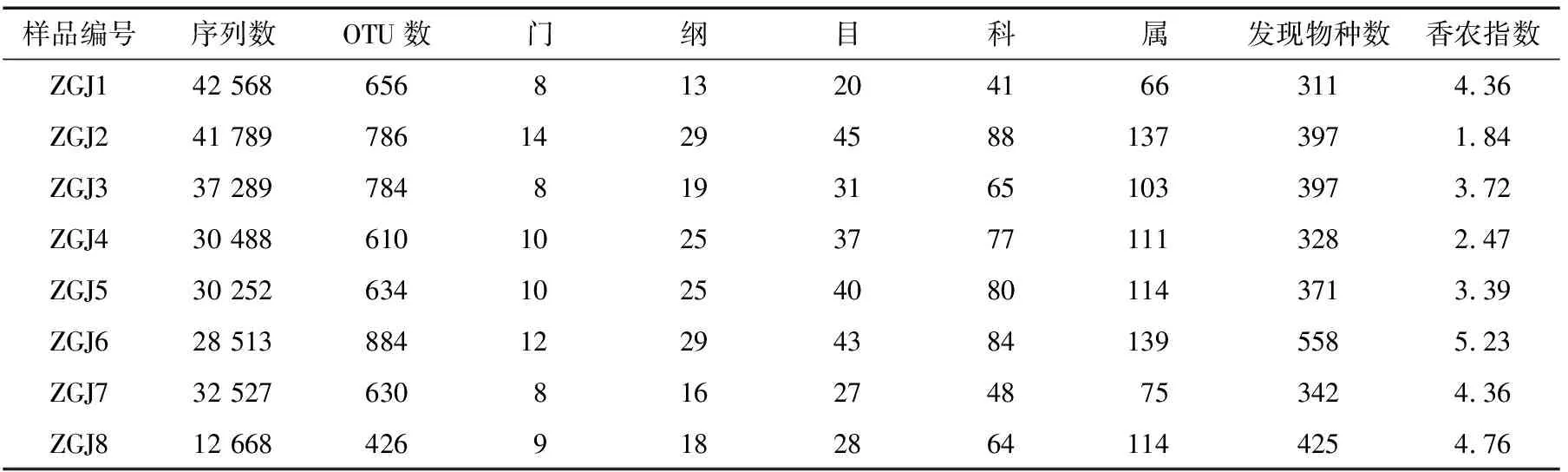
表1 测序基本信息†
† 在测序深度为12 610条序列时,计算发现物种数和香农指数。

图1 稀疏曲线图和香农指数图
由图1可知,即使测序量达到本研究的单个样品最大测序量42 568条时,稀疏曲线亦没有进入平台期,然而当测序量仅为2 000条左右时,香浓曲线已基本达到平衡状态。由此可见,即使本研究单个样品最小测序产出量仅有12 668条序列(样品ZGJ8),其测序深度亦足以满足后续分析。
2.2 基于门属水平鲊广椒细菌丰度分析
在鲊广椒样品中共发现20个门的细菌,其中相对含量>1.0%的门为Firmicutes(厚壁菌门)、Proteobacteria(变形菌门)和Bacteroidetes(拟杆菌门),其相对含量分别为84.07%,13.88%,1.29%。由此可见,鲊广椒样品中的细菌微生物主要隶属于Firmicutes和Proteobacteria 2个门。本研究进一步对鲊广椒样品中优势细菌属的相对含量进行了比较分析,结果见图2。

图2 鲊广椒属水平主要细菌丰度
由图2可知,Firmicutes中相对含量>1.0%的属分别为Lactobacillus(乳酸杆菌属,77.33%)、Weissella(魏斯氏菌属,2.24%)、Pediococcus(片球菌属,2.18%)和Staphylococ-cus(葡萄球菌,1.27%)。此外,隶属于Proteobacteria的Carnimonas(肉胞菌属)和Enterobacter(肠杆菌属)及隶属于Bacteroidetes的Prevotella(普氏菌属)平均相对含量亦>1.0%,分别为5.66%,2.47%,1.05%。由此可见,当阳地区鲊广椒主要是由若干个隶属于Firmicutes和Proteobacteria已知的优势细菌属组成。值得一提的是,Lactobacillus、Enterobacter、Pediococcus和Prevotella在8 个样品中均存在,其累计含量分别为83.03%,而Carnimonas仅在样品ZGJ8中存在,其相对含量高达45.29%。
目前市场上常用的乳酸杆菌菌株多分离自健康人体肠道、传统发酵乳制品或泡菜中,本研究发现Lactobacillus为鲊广椒中的优势细菌属,其平均相对含量高达77.33%,且Weissella和Pediococcus等隶属于Lactobacillales(乳杆菌目)的乳酸菌在鲊广椒中的累计平均相对含量达4.42%。当阳地区鲊广椒由大米面、玉米面、新鲜辣椒和食盐等原料混合固体发酵而成,其发酵方式和基质与传统发酵乳制品和泡菜有着较大的差异,因而将鲊广椒作为新的乳酸菌菌株的分离源并积极开展乳酸菌菌种资源的收集和保藏工作,对中国商业化乳酸菌的开发利用及相关食品产业的持续健康发展可能具有一定的积极意义。
本研究发现Prevotella为当阳地区鲊广椒样品中的优势细菌属之一,其相对含量为1.05%,且与风味物质的形成具有积极的作用。有研究[20]指出长期食用低动物蛋白低脂肪和高碳水化合物的志愿者肠道内该菌平均相对含量较高,并认为其与碳水化合物的代谢有关。鲊广椒原料富含碳水化合物,且发酵条件为厌氧环境,这可能是Prevotella相对含量较高的原因之一。然而值得注意的是,Prevotella为人体肠道中的优势细菌属[21],在样品采集过程中,本研究发现鲊广椒制作和发酵环境相对开放,因而鲊广椒中Prevotella是由原料中带入还是制作环境较差因粪便污染引起的是一个值得进一步研究的问题。此外,Faecalibacterium和Roseburia亦为人体肠道的优势菌群[21],本研究亦发现各有1个OTU隶属于上述2个细菌属,但其平均含量仅分别为0.041% 和0.025%。
本研究发现Staphylococcus和Enterobacter均为当阳地区鲊广椒中的优势细菌属之一,其平均含量分别为1.27%和2.47%,且有1个核心OTU隶属于Klebsiella和Nocardia。Staphylococcus广泛地分布于自然环境中,虽多数为非致病菌,但少数可导致疾病发生,隶属于该属的金黄色葡萄球菌(S.aureus)是人类化脓感染中最常见的病原菌,可在加工、贮藏和运输过程中对食品造成污染[22]。Enterobacter亦广泛存在于自然环境中,能引起多种肠道外的条件致病性感染,隶属于该菌属的阪崎肠杆菌(E.Sakazakii)能引起新生儿脑膜炎和败血症,死亡率高达75%[23]。作为Klebsiella中常见的种,肺炎克雷伯氏菌(K.peneumoniae)对人致病性较强,是重要的条件致病菌和医源性感染菌之一[24]。作为好气性腐生菌,Nocardia能同化多种碳水化合物,星状诺卡氏菌(N.asteroides)对人或动物具有致病性[25]。Carnimonas具有一定的嗜盐性,可以在腊肉制品表面形成黑色斑点[26],从而导致肉制品失去食用价值并造成经济损失,本研究发现ZGJ8中Carnimonas相对含量高达45.29%,且其与有机硫化物等风味物质的生成呈现正相关。由此可见,由于制作环境相对开放,当阳地区鲊广椒中不仅存在Lactobacillus等有益菌,而且存在着少量的有害微生物或腐败菌,因而优化鲊广椒加工环境显得尤为重要。此外,在对鲊广椒中乳酸菌进行发掘和收集的基础上,筛选出具有优良发酵特性的菌株并进行发酵剂制备,可能对鲊广椒食用安全性的提升和产业化发展具有重要的意义。OTU在8 个鲊广椒样品中出现次数统计见图3。
由图3可知,在所有样品中均出现的OTU仅有10个,但其包含的序列数为31 600条,占所有质控后合格序列数的12.34%。由此可见,虽然鲊广椒主要是由若干个隶属于Firmicutes和Proteobacteria已知的优势细菌属组成,但是在OTU(按照序列97.0的相似性进行划分)水平上,鲊广椒样品间微生物构成存在较大的差异,所有样品仅有12%左右的核心菌群。进一步对10个核心OTU在各鲊广椒样品中的相对含量进行了比较分析,其结果见图4。

图3 OTU出现次数统计

图4 核心OTU相对含量的热图
由图4可知,本研究甄别出的10个核心OTU,其中2个隶属于Bacillus,各有1个隶属于Lactobacillus、Pediococcus、Faecalibacterium(粪栖杆菌属)、Roseburia(罗氏菌属)、Nocardia(诺卡氏菌属)、Ralstonia(青枯菌属)、Klebsiella(克雷伯氏菌属)和Enterobacter。各核心OTU在样品中的分布也存在较大的差异,例如OTU1177(Lactobacillus)在ZGJ1和ZGJ7中的相对含量分别为29.87%和20.12%,但在其他样品中的相对含量均<1.0%,OTU88(Enterobacter)在ZGJ4中的相对含量达到12.62%,但在其他样品中的相对含量<1.0%。由此可见,虽然存在于所有样品中,但核心OTU在各样品中的平均含量差异较大。
作为世界上危害最大、分布最广和造成损失最严重的植物病害之一,青枯病常由Ralstonia的细菌引起。本研究发现有1个核心OTU隶属于Ralstonia,究其原因可能在鲊广椒的加工过程中,居民使用了患有青枯病的辣椒作为辅料,从而将该腐败菌带入了产品中。由此可见,辣椒的选择可能是后续鲊广椒产业化生产加工过程中的关键控制点之一。
2.3 基于多元统计学分析的鲊广椒细菌微生物构成研究
进一步在OTU水平,采用基于加权UniFrac距离的UPGMA聚类分析对不同鲊广椒样品的微生物群落结构相似性进行了分析,结果见图5。
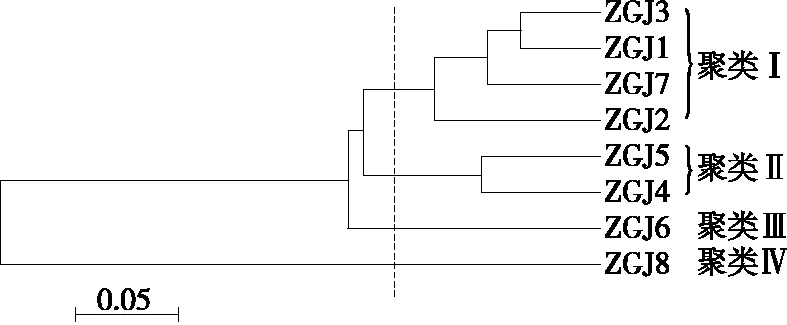
图5 基于加权UniFrac距离的聚类分析
由图5可知,样品ZGJ1、ZGJ2、ZGJ3和ZGJ7的细菌群落结构较为相似,而样品ZGJ8的细菌群落结构与其他样品存在较大差异,可能与其特有的Carnimonas及其相对含量(高达45.29%)有关。
本研究以16S rRNA V3-V4区为测序靶点,采用Miseq 高通量测序技术对当阳地区鲊广椒中微生物群体的物种组成及丰度进行了揭示,打破了传统微生物学基于纯培养研究的局限性。然而,虽然Miseq 高通量测序技术具有通量高、检测速度快和检测结果准确的特点,但存在读数短的缺点,所以为保证分析结果的准确性,本研究仅能在属水平上对当阳地区鲊广椒中细菌的多样性进行揭示。随着测序技术的发展,PacBio SMRT(single molecule real-time 单分子实时)测序技术已在乳制品[27]和肠道微生物[28]研究中有了一定的应用,在解析微生物多样性和丰富度均较高的复杂基质研究方面显示出了较大的技术优势,将该技术引入到鲊广椒及传统发酵食品微生物多样性研究中具有积极的意义。
2.4 鲊广椒风味品质的评价
基于电子鼻技术鲊广椒样品挥发性风味物质的分析见表2。
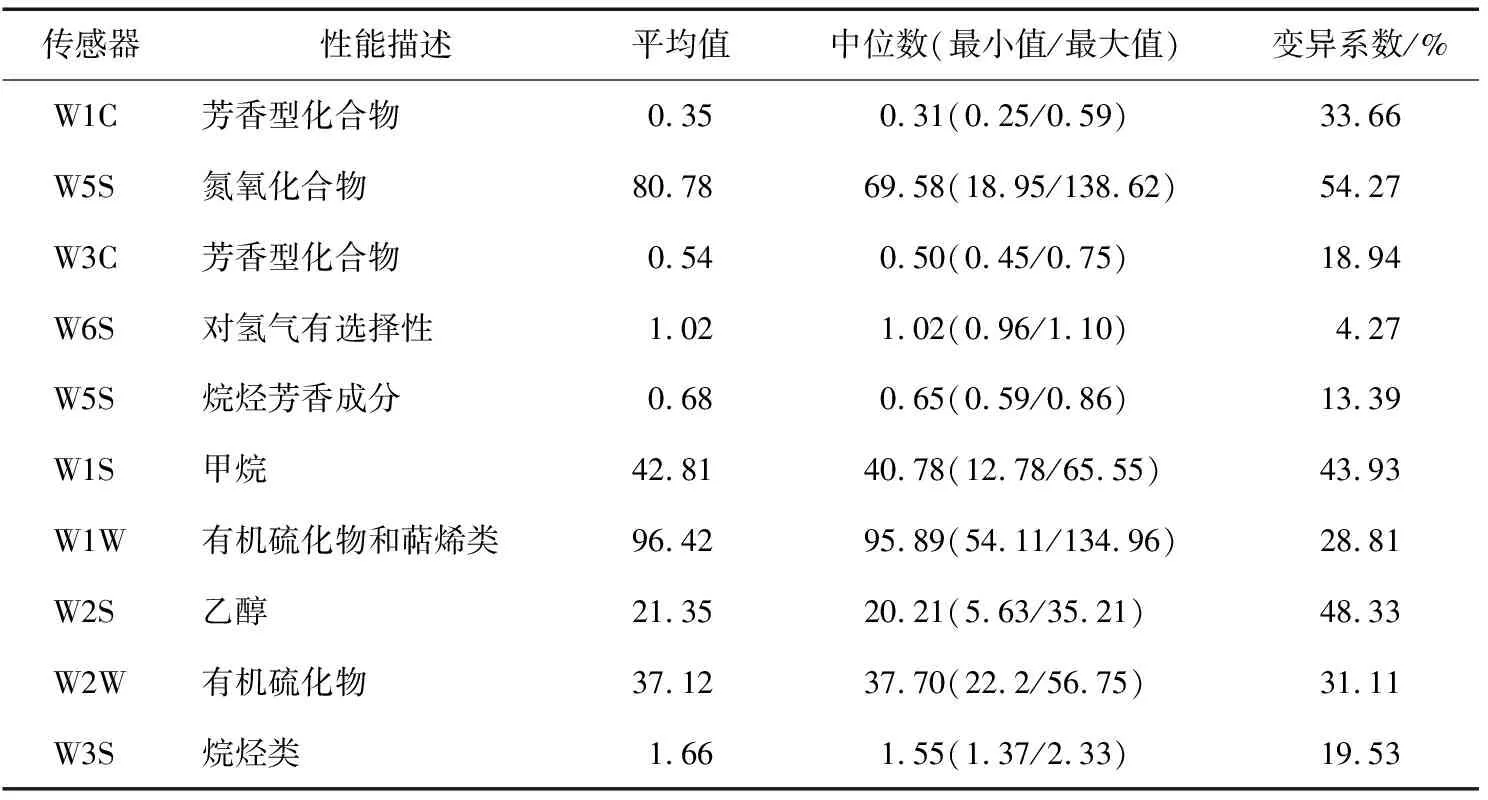
表2 基于电子鼻技术鲊广椒样品挥发性风味物质的分析
由表2可知,除W6S外其他9个传感器对鲊广椒样品的响应差异均较大,变异系数均在10%以上,说明各鲊广椒样品的风味品质存在较大差异。值得一提的是,W1W和W2W 2个传感器对样品ZGJ8的响应值均最大,分别为134.96% 和56.75%,说明该样品挥发性风味物质中有机硫化物含量可能较高。
2.5 鲊广椒优势细菌属及风味物质的关联性分析
在对鲊广椒细菌多样性和风味品质进行揭示及评价的基础上,对样品中优势细菌属相对含量和电子鼻各传感器响应值之间的相关性进行了关联计算,并构建了相关性网络图,结果见图6。
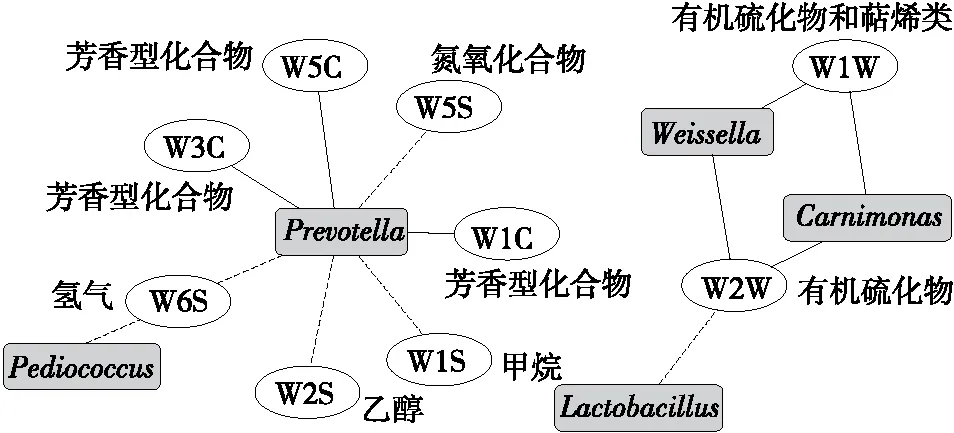
实线表示正相关,虚线表示负相关
由图6可知,Weissella和Carnimonas与有机硫化物等风味物质的生成呈现正相关,而Lactobacillus与其呈现负相关。除此之外,Prevotella与芳香型化合物的生成呈现正相关,而与氮氧化物、乙醇、氢气和甲烷等物质的形成呈现负相关。由此可见,Lactobacillus和Prevotella对鲊广椒风味的形成具有积极的作用。
3 结论
本研究在对8 个鲊广椒样品细菌微生物群落结构进行解析的基础上,进一步探讨了细菌多样性对产品风味品质的影响,研究发现鲊广椒中细菌微生物主要是由若干个隶属于Firmicutes和Proteobacteria已知的优势菌属组成,且Lactobacillus和Prevotella对鲊广椒风味的形成具有积极的作用。虽然通过本研究的开展,弥补了目前关于鲊广椒细菌群落结构研究尚少的不足,然而本研究亦存在样本量偏少和采样地点单一的缺陷,因而在后续研究中进一步增加样本量同时设置多个采样点进行样品采集是极为必要的。
[1] 王巧碧, 王丹, 赵欠, 等. SDE 和 SPME 法对鲊海椒发酵中香气组成的比较分析[J]. 食品科学, 2016, 37(4): 108-114.
[2] 葛平珍, 王丹, 周才琼. 不同淀粉源对鲊海椒发酵过程中功能成分的影响[J]. 食品科学, 2015, 36(21): 191-195.
[3] CAPORASO J G, LAUBER C L, WALTERS W A, et al. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms[J]. The ISME Journal, 2012, 6(8): 1 621-1 624.
[4] JUSTYNA P, ANNALISA R, VINCENZA P, et al. Bacterial diversity in typical Italian salami at different ripening stages as revealed by high-throughput of 16S rDNA amplicons[J]. Food Microbiology, 2015, 46(4): 342-356.
[5] HU Xiao-long, DU Hai, REN Cong, et al. Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J]. Applied and Environmental Microbiology, 2016, 82(8): 2 506-2 515.
[6] BOYNTON P J, GREIG D. Fungal diversity and ecosystem function data from wine fermentation vats and microcosms[J]. Data in Brief, 2016, 8(12): 225-229.
[7] YANG Hong-yan, WU Hao, GAO Li-juan, et al. Effects ofLactobacilluscurvatusandLeuconostocmesenteroideson Suan Cai fermentation in northeast China[J]. Journal of Microbiology and Biotechnology, 2016, 26(12): 2 148-2 158.
[8] 葛英亮, 于水利, 时文歆, 等. 应用 Illumina MiSeq 测序解析 O3-BAC 水处理技术生产饮用水中细菌多样性[J]. 食品与机械, 2016, 32(6): 52-57.
[9] FU Jian-yu, LV Hai-peng, CHEN Feng. Diversity and variation of bacterial community revealed by MiSeq Sequencing in Chinese dark teas[J]. PloS One, 2016, 11(9): e0162719.
[10] 朱娜, 毛淑波, 潘磊庆, 等. 电子鼻对草莓采后贮藏早期霉菌感染的检测[J]. 农业工程学报, 2013, 29(5): 266-273.
[11] 宋雪, 高韶婷, 杭梦茜, 等. 基于电子鼻的金华和宣威火腿产地鉴别与品级评定[J]. 食品与机械, 2015, 31(2): 114-118.
[12] 陈辰, 鲁晓翔, 张鹏, 等. 基于电子鼻技术的玫瑰香葡萄贮藏期快速判别[J]. 食品与机械, 2015, 31(6): 137-141.
[13] 张玉玉, 黄明泉, 陈海涛, 等. 7种面酱的电子鼻和电子舌辨别分析[J]. 中国食品学报, 2012, 12(1): 198-205.
[14] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336.
[15] CAPORASO J G, BITTINGER K, BUSHMAN F D, et al. PyNAST: a flexible tool for aligning sequences to a template alignment[J]. Bioinformatics, 2010, 26(2): 266-267.
[16] EDGAR R C. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics, 2010, 26(19): 2 460-2 461.
[17] COLE J R, CHAI B, FARRIS R J, et al. The ribosomal database project (RDP-II): introducing myRDP space and quality controlled public data[J]. Nucleic Acids Research, 2007, 35(1): 169-172.
[18] DESANTIS T Z, HUGENHOLTZ P, LARSEN N, et al. Greengenes, a chimera-checked 16S rRNA gene database and workbench compatible with ARB[J]. Applied and Environmental Microbiology, 2006, 72(7): 5 069-5 072.
[19] PRICE M N, DEHAL P S, ARKIN A P. Fasttree: computing large minimum evolution trees with profiles instead of a distance matrix[J]. Molecular Biology and Evolution, 2009, 26(7): 1 641-1 650.
[20] DE FILIPPO C, CAVALIERI D, DI PAOLA M, et al. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa[J]. Proceedings of the National Academy of Sciences, 2010, 107(33): 14 691-14 696.
[21] ARUMUGAM M, RAES J, PELLETIER E, et al. Enterotypes of the human gut microbiome[J]. Nature, 2011, 473(7 346): 174-180.
[22] TONG S Y C, DAVIS J S, EICHENBERGER E, et al.Staphylococcusaureusinfections: epidemiology, pathophysiology, clinical manifestations, and management[J]. Clinical Microbiology Reviews, 2015, 28(3): 603-661.
[23] HU Xue, DOU Wen-chao, FU Ling-lin, et al. A disposable immunosensor forEnterobactersakazakiibased on an electrochemically reduced graphene oxide-modified electrode[J]. Analytical Biochemistry, 2013, 434(2): 218-220.
[24] 陈文秀, 姜旋, 马晓燕, 等. 实时荧光环介导等温扩增技术检测乳粉中的肺炎克雷伯氏菌[J]. 食品科学, 2014, 35(20): 192-197.
[25] PATEL R, SISE A, AL-MOHTASEB Z, et al.Nocardiaasteroideskeratitis resistant to amikacin[J]. Cornea, 2015, 34(12): 1 617-1 619.
[26] LOZANO-OJALVO D, RODRGUEZ A, CORDERO M, et al. Characterisation and detection of spoilage mould responsible for black spot in dry-cured fermented sausages[J]. Meat Science, 2015, 100(2): 283-290.
[27] ZHENG Yi, XI Xiao-xia, XU Hai-yan, et al. Using pacbio long-read high-throughput microbial gene amplicon sequencing to evaluate infant formula safety[J]. Journal of Agricultural and Food Chemistry, 2016, 64(37): 6 993-7 001.
[28] LI Jing, XU Hai-yang, SUN Zhi-hong, et al. Effect of dietary interventions on the intestinal microbiota of Mongolian hosts[J]. Science Bulletin, 2016, 61(20): 1 605-1 614.

