南疆传统发酵酸奶中酵母菌的分子鉴定及抗氧化活性研究
古丽娜孜·卡哈尔 努尔古丽·热合曼 迪丽拜尔·玉山 麦克丽亚·亚力昆
(新疆师范大学,新疆 乌鲁木齐 830054)
新疆地域辽阔,气候多样,向来就以其丰富的乳制品资源著称。当地的传统发酵酸奶更是历史悠久,味道可口[1]。传统发酵食品的微生物区系通常有细菌与酵母菌组成,少数情况下也有霉菌参与。这些微生物在发酵过程中,增添了独特的芳香物质与层次感[2]。酵母菌在真核微生物群体当中所占的数量庞大,分布广泛,而且在生物技术方面拥有多种用途[3-4]。在众多发酵食品当中酵母菌占有举足轻重的地位[5]。此外,酵母菌可以从外界环境中吸取酚类物质,具有提高自身抗氧化活性的能力[6],含有丰富的维他命B6、B12以及可以与各种酶类有协同作用的诸多矿物质[7]。传统工业化生产的酸奶主要发酵菌是乳酸菌,很少会将酵母菌添加为发酵菌,酵母菌一直以来也被看做是引起产品腐坏的腐败菌。
在鉴定方面,随着科学技术水平的发展,26S rDNA及其转录间区 ITS 的序列分析等技术被越来越多地应用于酵母菌的分类与序列分析当中[8-9]。Kurtzman等[10]对大约500种子囊菌酵母和担子菌酵母26S rDNA 中的D1/D2区域序列进行了研究,发现该方法可以将绝大部分分离开来。由于这些序列均已公布于GenBank/EM-BL/DDBJ等国际核酸数据库,为酵母菌的分子分类学、分子系统学和多样性的研究带来很大便利[11] 8-9。近年来,Lachance等[12]发现Clavisporalusitaniae的26S rDNAD1/D2区具有显著的多态性。随着研究的深入,发现愈来愈多的酵母菌中存在个体基因组ITS和26S rDNA序列多态性,同一菌株基因组内不同类型的ITS序列差异也可能远远超过菌种间的差异范围[13]。因此,仅仅依靠单一序列的鉴定结果会有一定程度的不确定性。在抗氧化活性方面,中国已有利用抗氧化活性酵母在小鼠体内进行抗衰试验等方面的研究[14]。
本研究拟以新疆阿图什与乌什的4种酸奶中分离纯化得到的78株酵母菌为研究对象,采用26S rDNA D1/D2区域及ITS内转录序列扩增技术进行分子生物学鉴定,并对其总抗氧化能力,羟基自由基抑制能力、抗超氧阴离子自由基能力以及脂质过氧化物产量进行测定,筛选出具有优良抗氧化活性的菌株;通过双序列测序技术对分离得到的酵母菌进行鉴定,使用MEGA 7.0等生物学软件绘制系统发育进化树,并对南疆地区酸奶中的酵母菌抗氧化活性进行初筛,为酵母菌资源的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 菌株及其来源
传统手工酸奶:阿图什与乌什地区农民家庭作坊生产,将样品装置于无菌容器,运至实验室后置于4 ℃保藏,从中分离纯化得到78株酵母菌,标号,并用20%甘油于-80 ℃超低温冰箱保种。
1.1.2 仪器与试剂
立式压力蒸汽灭菌器:LZDZX-30KBS型,上海申安医疗器械厂;
离心机:BLF6型,上海一恒科技有限公司;
PCR仪:LNB48+型,上海皓庄仪器有限公司;
分光光度计:722型,上海菁华科技仪器有限公司;
酵母浸粉、蛋白胨:分析纯,北京澳博星生物技术有限责任公司;
葡萄糖、琼脂:分析纯,合肥志宏生物技术有限公司;
酵母菌基因组提取试剂盒:天根生化科技有限公司;
上游引物(NL1、ITS1)、下游引物(NL4、ITS4):上海生物工程股份有限公司;
总抗氧化能力(T-AOC)测定试剂盒(货号A015-1)、脂质过氧化(LPO)测试盒(货号A106)、抗超氧阴离子自由基测试盒(货号A052)、羟基自由基测定试剂盒(货号A018):南京建成生物工程研究所。
1.2 方法
1.2.1 菌株鉴定
(1) 菌种活化:在提取酵母菌基因组DNA之前先对其进行2次活化,将用甘油冻藏(-80 ℃)的酵母菌菌株按照1%的接种量接种于新鲜配置的YPD培养基中(10 g/L 酵母浸粉, 20 g/L蛋白胨,20 g/L 葡萄糖)[15],28 ℃培养24 h。
(2) 总DNA的提取:DNA的提取按照试剂盒说明书进行操作,第二步略有改动,水浴时间改为40 min对酵母菌进行破壁处理[16]。
(3) 基因组DNA电泳:提取的DNA采用1.0%的琼脂糖凝胶进行电泳,电压80 V,时长40 min,在凝胶成像仪中观察凝胶。
(4) 26S rDNA D1/D2区PCR扩增:酵母菌PCR扩增体系见表1,引物为通用引物,正向引物NL1:(5’-GCATATCAATAAGCGGAGGAAAAG-3’),反向引物NL4:(5’-GGTCCGTGTTTCA AGACGG-3’)。

表1 26S rDNA D1/D2区 PCR扩增体系[18]
扩增循环为95 ℃ 5 min,预变性,94 ℃ 1 min、52 ℃ 1 min、72 ℃ 1 min,36个循环,72 ℃延伸8 min[17]。扩增结束后取4 μL PCR扩增产物与Golden viewer核酸染料混合点样,用(1×TAE)缓冲液制备2.0%琼脂糖凝胶进行电泳检测,扩增成功在600 bp左右形成可见条带。PCR产物被送到新疆昆泰锐生物技术有限公司进行测序。
(5) ITS序列PCR扩增:ITS PCR扩增体系见表2,引物采用ITS通用扩增引物,正向引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’),反向引物ITS4(5’-TCCTCCGCTTATTGATATGC-3’)。
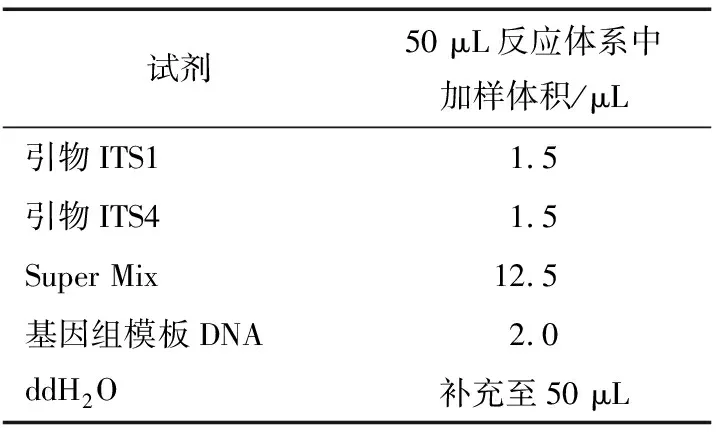
表2 ITS PCR扩增体系[18]16
扩增循环为95 ℃ 5 min预变性,94 ℃ 1 min、55 ℃ 1 min、72 ℃ 1.5 min,30个循环,72 ℃延伸10 min[18]15-16。扩增结束后取4 μL PCR扩增产物与Golden viewer核酸染料混合点样,用(1×TAE)缓冲液制备2.0%琼脂糖凝胶进行电泳检测,扩增成功在400~700 bp左右形成可见条带[19]。PCR产物被送到新疆昆泰锐生物技术有限公司进行测序。
(6) 同源性分析:利用MEGA7.0 软件,对被测酵母菌的26S rDNA D1/D2区域、ITS序列以及GenBank中比对获得的参比菌株序列进行同源性分析,申请菌株登录号,构建系统发育进化树。
1.2.2 酵母菌抗氧化活性检测
(1) 酵母菌细胞的收集:将-80 ℃下甘油保藏的菌株进行活化,将活化好的酵母菌10 000 r/min离心10 min收集细胞。
(2) 酵母细胞预处理:将离心收集的细胞用无菌水洗涤3~5次后进行冷冻干燥(-48 ℃,4 Pa),冻干细胞备用。利用反复冻融超声破碎法[20]提取粗酶液。
(3) 抗氧化能力检测:菌株总抗氧化能力(T-AOC)检测[21]、羟基自由基抑制能力检测、抗超氧阴离子自由基能力测试以及产生脂质过氧化物(LPO)含量测试均以南京建成测定试剂盒步骤进行,每个样品均重复3次。
2 结果与分析
2.1 26S rDNA序列分析结果
分别采用78株菌的基因组序列为模板,采用引物NL1、NL4扩增出26S rDNA D1/D2序列,利用2.0%浓度的琼脂糖凝胶对扩增产物进行电泳,大小约为600 bp(图1)。扩增序列片段经测序后,通过BIOEDIT生物软件整理数据并在GenBank 中进行BLAST同源序列搜索,对同源性高的相似菌株序列进行下载。结果表明,78株酵母菌的26S rDNAD1/D2区域基因序列同源性均≥99%,菌株登录号及名称见表3。

图1 部分菌株26S rDNA D1/D2区域序列电泳图
随后利用MEGA7.0对序列绘制系统发育进化树(图2)。结果表明,阿图什与乌什县传统发酵乳当中的酵母菌共属于3个属3个种,其中3个属分别为酵母属(Saccharomycescerevisiae)、克鲁维酵母属(Kluyveromycesmarxianus)、毕赤酵母属(Pichiakudriavzevii);3个种为酿酒酵母(Saccharomycescerevisiae)、马克思克鲁维酵母(Kluyveromycesmarxianus)、库德里阿兹威毕赤酵母(Pichiakudriavzevii)。
2.2 ITS序列分析结果
同样采用78株酵母菌基因序列为模板,利用ITS1与ITS4引物对ITS序列进行扩增,将产物用浓度2.0%的琼脂糖凝胶进行电泳,发现在400~700 bp处出现条带(图3),对扩增产物进行测序后,通过BIOEDIT生物软件整理数据并在GenBank 中进行BLAST同源序列搜索,对同源性高的相似菌株序列进行下载。结果表明,78株酵母菌的ITS区域基因序列同源性均≥98%,与26S rDNA结果一致,菌株相似性比较结果见表4。
同样利用MEGA7.0软件绘制菌株系统发育进化树(图4),结果表明,78株菌分属于酿酒酵母(Saccharomycescerevisiae)、马克思克鲁维酵母(Kluyveromycesmarxianus)、毕赤酵母(Pichiakudriavzevii)。其中NG-98、NG-M66、NG-Y36 3株酵母菌ITS序列相似性只有98%,需通过TA克隆进行进一步研究。
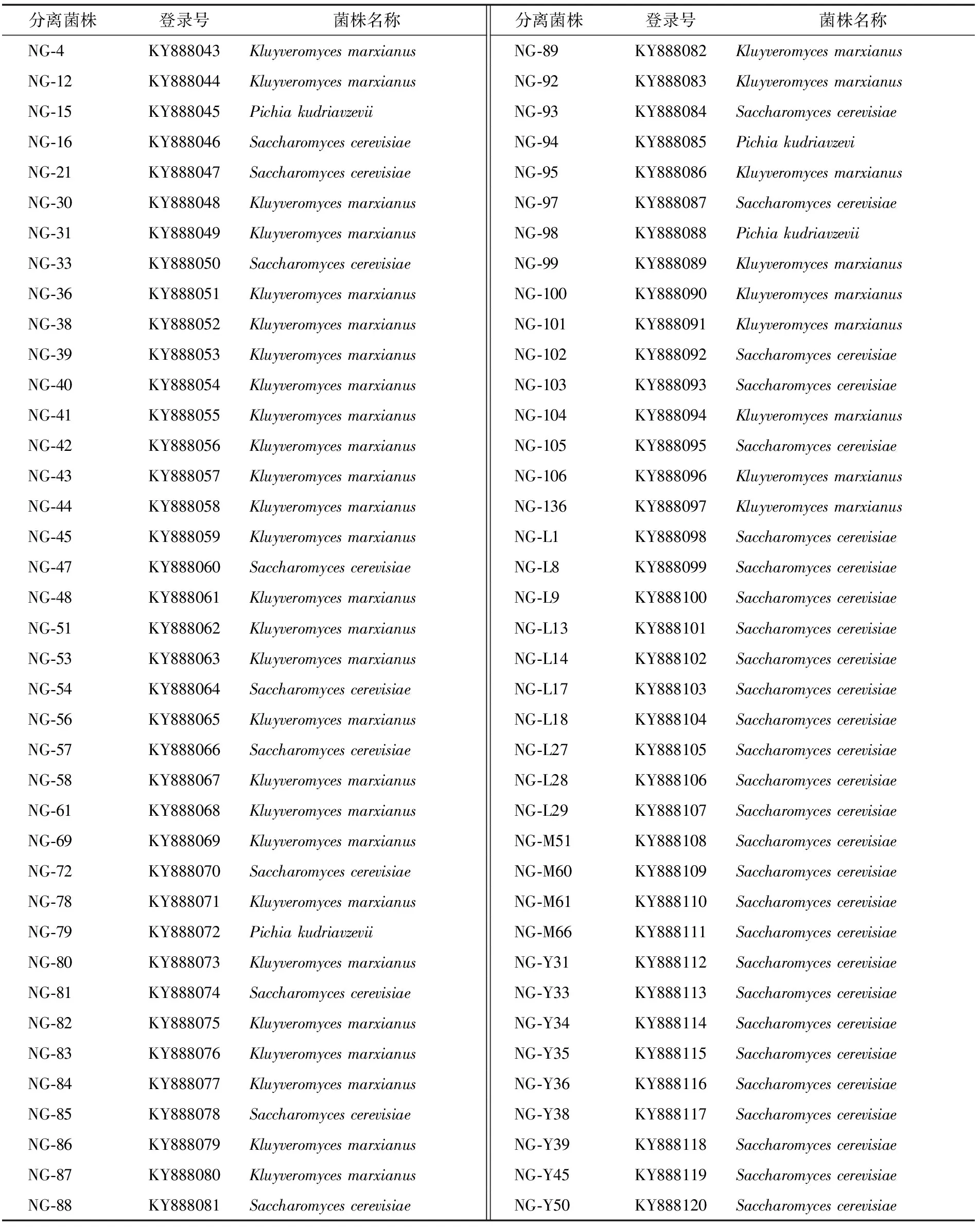
表3 菌株名称及登录号
2.3 抗氧化能力筛选
2.3.1 总抗氧化能力(T-AOC) 本试验通过总抗氧化能力试剂盒,最终测定出78株菌株中42株具有抗氧化活性,见图5。
通过图5可以看出,42株酵母中NG-Y50号菌抗氧化活性最高,为(107.33±2.97) U/mL;NG-L18号菌株抗氧化活性最低,仅为(4.29±2.84)U/mL。高于平均值的菌株有NG-40、NG-41、NG-54、NG-56、NG-57、NG-58、NG-87、NG-105、NG-L1、NG-Y50、NG-M60、NG-M66。
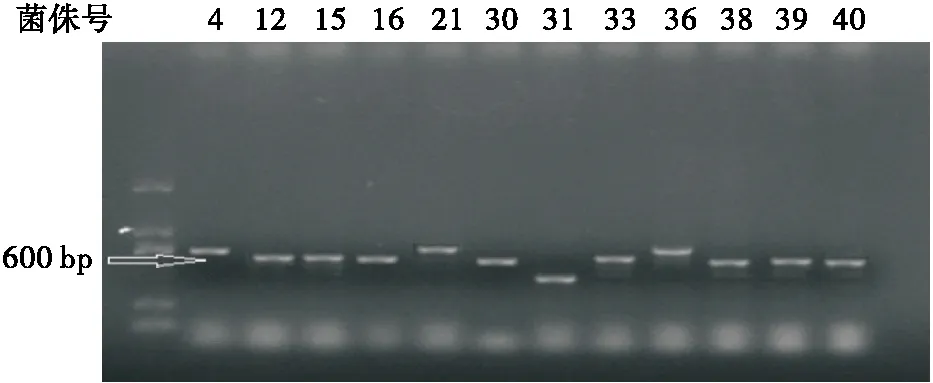
图3 部分菌株ITS序列PCR产物电泳图

分离菌株登录号相似菌株分离菌株登录号相似菌株NG-4KY888043Kluyveromyces marxianusNG-89KY888082Kluyveromyces marxianusNG-12KY888044Kluyveromyces marxianusNG-92KY888083Kluyveromyces marxianusNG-15KY888045Pichia kudriavzeviiNG-93KY888084Saccharomyces cerevisiaeNG-16KY888046Saccharomyces cerevisiaeNG-94KY888085Pichia kudriavzeviNG-21KY888047Saccharomyces cerevisiaeNG-95KY888086Kluyveromyces marxianusNG-30KY888048Kluyveromyces marxianusNG-97KY888087Saccharomyces cerevisiaeNG-31KY888049Kluyveromyces marxianusNG-98KY888088Pichia kudriavzeviiNG-33KY888050Saccharomyces cerevisiaeNG-99KY888089Kluyveromyces marxianusNG-36KY888051Kluyveromyces marxianusNG-100KY888090Kluyveromyces marxianusNG-38KY888052Kluyveromyces marxianusNG-101KY888091Kluyveromyces marxianusNG-39KY888053Kluyveromyces marxianusNG-102KY888092Saccharomyces cerevisiaeNG-40KY888054Kluyveromyces marxianusNG-103KY888093Saccharomyces cerevisiaeNG-41KY888055Kluyveromyces marxianusNG-104KY888094Kluyveromyces marxianusNG-42KY888056Kluyveromyces marxianusNG-105KY888095Saccharomyces cerevisiaeNG-43KY888057Kluyveromyces marxianusNG-106KY888096Kluyveromyces marxianusNG-44KY888058Kluyveromyces marxianusNG-136KY888097Kluyveromyces marxianusNG-45KY888059Kluyveromyces marxianusNG-L1KY888098Saccharomyces cerevisiaeNG-47KY888060Saccharomyces cerevisiaeNG-L8KY888099Saccharomyces cerevisiaeNG-48KY888061Kluyveromyces marxianusNG-L9KY888100Saccharomyces cerevisiaeNG-51KY888062Kluyveromyces marxianusNG-L13KY888101Saccharomyces cerevisiaeNG-53KY888063Kluyveromyces marxianusNG-L14KY888102Saccharomyces cerevisiaeNG-54KY888064Saccharomyces cerevisiaeNG-L17KY888103Saccharomyces cerevisiaeNG-56KY888065Kluyveromyces marxianusNG-L18KY888104Saccharomyces cerevisiaeNG-57KY888066Saccharomyces cerevisiaeNG-L27KY888105Saccharomyces cerevisiaeNG-58KY888067Kluyveromyces marxianusNG-L28KY888106Saccharomyces cerevisiaeNG-61KY888068Kluyveromyces marxianusNG-L29KY888107Saccharomyces cerevisiaeNG-69KY888069Kluyveromyces marxianusNG-M51KY888108Saccharomyces cerevisiaeNG-72KY888070Saccharomyces cerevisiaeNG-M60KY888109Saccharomyces cerevisiaeNG-78KY888071Kluyveromyces marxianusNG-M61KY888110Saccharomyces cerevisiaeNG-79KY888072Pichia kudriavzeviiNG-M66KY888111Saccharomyces cerevisiaeNG-80KY888073Kluyveromyces marxianusNG-Y31KY888112Saccharomyces cerevisiaeNG-81KY888074Saccharomyces cerevisiaeNG-Y33KY888113Saccharomyces cerevisiaeNG-82KY888075Kluyveromyces marxianusNG-Y34KY888114Saccharomyces cerevisiaeNG-83KY888076Kluyveromyces marxianusNG-Y35KY888115Saccharomyces cerevisiaeNG-84KY888077Kluyveromyces marxianusNG-Y36KY888116Saccharomyces cerevisiaeNG-85KY888078Saccharomyces cerevisiaeNG-Y38KY888117Saccharomyces cerevisiaeNG-86KY888079Kluyveromyces marxianusNG-Y39KY888118Saccharomyces cerevisiaeNG-87KY888080Kluyveromyces marxianusNG-Y45KY888119Saccharomyces cerevisiaeNG-88KY888081Saccharomyces cerevisiaeNG-Y50KY888120Saccharomyces cerevisiae
2.3.2 羟基自由基抑制能力 通过羟基自由基测定试剂盒对具有抗氧化活性的42株酵母菌进行测定,结果见图6。
由图6可知,在测试的这42株菌株中NG-M61号菌株抑制羟基自由基能力最高,为(755.80±3.63) U/mL;NG-M60号菌株抑制羟基自由基能力最低,仅为(60.46±4.66) U/mL。其中抑制羟自由基能力高于平均值的菌株有NG-15、NG-30、NG-33、NG-40、NG-41、NG-45、NG-53、NG-57、NG-58、NG-72、NG-84、NG-92、NG-93、NG-105、NG-106、NG-L1、NG-L13、NG-Y39、NG-Y50、NG-M51、NG-M61。对筛选抗氧化能力以及抑制羟基自由基能力均高于平均值的7株酵母菌进行抗超氧阴离子自由基测定以及脂质过氧化物(LPO)含量测试。
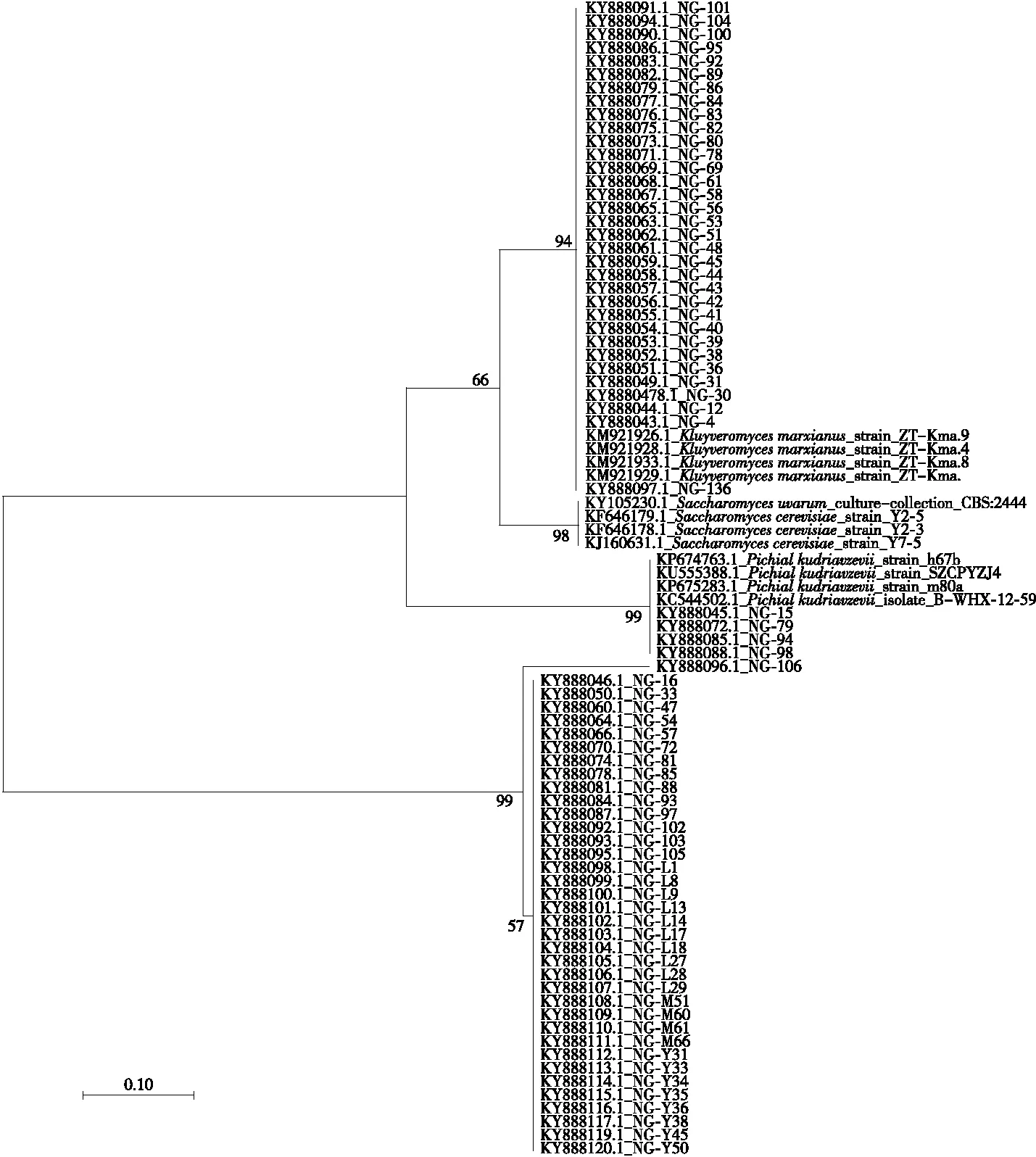
图4 部分菌株ITS序列系统发育进化树

图5 具有抗氧化活性的菌株及其抗氧化能力

图6 42株酵母菌羟基自由基抑制能力
2.3.3 抗超氧阴离子自由基能力 抗超氧阴离子自由基能力见图7。
由图7可以看出,7株酵母菌中NG-105号菌株的抗超氧阴离子自由基能力最强[(134.29±1.72) U/mL],NG-58号菌株最弱[(35.53±4.66) U/mL]。
2.3.4 脂质过氧化物含量 脂质过氧化物含量测定结果见图8。
由图8可知,本研究所测试的7株酵母菌,产生脂质过氧化物的含量偏低,脂质过氧化物含量最高的菌株NG-Y57所产生的LPO值也仅为(4.97±0.11) μmol/L,而含量最低的菌株NG-105产生的LPO值只有(0.32±0.14) μmol/L。
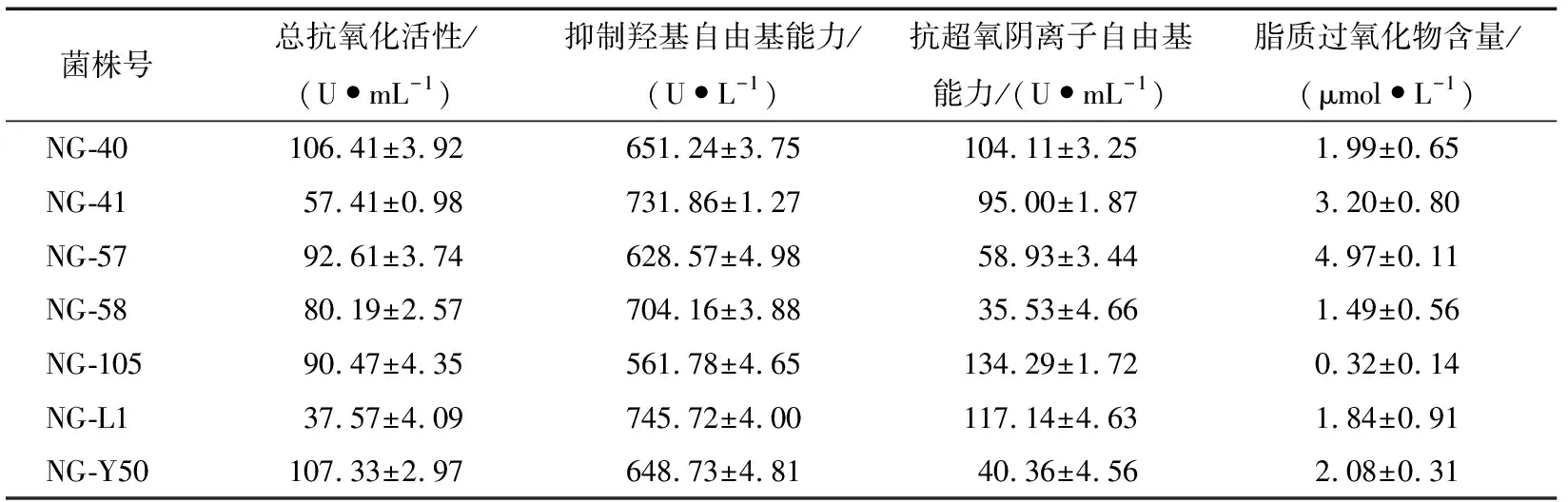
由表5可以看出,NG-Y50号菌株抗氧化活性最高,抑制羟基自由基能力为(648.73±4.81) U/L,但是其抗超氧阴离子能力[(40.36±4.56) U/mL]不及NG-40,而且NG-40号菌株抗氧化活性为(106.41±3.92) U/mL,抑制羟基自由基能力为(651.24±3.75) U/L,抗超氧阴离子能力为(104.11±3.25) U/mL,而其所含有的脂质过氧化物含量仅有(1.99±0.65) μmol/L。综上所述,NG-40具有较强的抑制自由基能力,可被开发为新型抗氧化活剂。这株菌被鉴定为马克思克鲁维酵母(Kluyveromycesmarxianus)。

图7 抗超氧阴离子自由基能力
3 结论
(1) 本研究对酸奶中的酵母菌进行分子鉴定,结果表明,38株属于酿酒酵母(Saccharomycescerevisiae),36株属于马克思克鲁维酵母(Kluyveromycesmarxianus),4株属于毕赤酵母(Pichiakudriavzevii)。Gabriela Diosma等[22]对开菲尔样品中分离出的酵母菌进行鉴定,发现它们属于Saccharomycescerevisiae,Saccharomycesunisporus,Issatchenkiaoccidentalis,Kluyveromycesmarxianus4种酵母。但本试验的样品中并没有发现Saccharomycesunisporus以及Issatchenkiaoccidentalis等酵母菌种,这与样品的地域性以及种类有关。 Yang等[23]以西藏牦牛酸奶为对象,对其中的酵母菌进行研究,发现它们同样属于酿酒酵母,马克思克鲁维酵母与毕赤酵母。李静等[24]对新疆酸驼乳进行研究时也同样分离出这3种酵母。由此可见马克思克鲁维酵母与酿酒酵母在传统发酵乳制品中很常见。

图8 菌株脂质过氧化物(LPO)含量测定
菌株号总抗氧化活性/(U•mL-1)抑制羟基自由基能力/(U•L-1)抗超氧阴离子自由基能力/(U•mL-1)脂质过氧化物含量/(μmol•L-1)NG-40106.41±3.92651.24±3.75104.11±3.251.99±0.65NG-4157.41±0.98731.86±1.2795.00±1.873.20±0.80NG-5792.61±3.74628.57±4.9858.93±3.444.97±0.11NG-5880.19±2.57704.16±3.8835.53±4.661.49±0.56NG-10590.47±4.35561.78±4.65134.29±1.720.32±0.14NG-L137.57±4.09745.72±4.00117.14±4.631.84±0.91NG-Y50107.33±2.97648.73±4.8140.36±4.562.08±0.31
(2) 通过抗氧化活性试剂盒从78株酵母中筛选出7株高抗氧活性酵母,其中NG-40、NG-41、NG-58为马克思克鲁维酵母(Kluyveromycesmarxianus),NG-57、NG-105、NG-L1、NG-Y50为酿酒酵母(Saccharomycescerevisiae)。戴玥等[25]通过超氧阴离子清除率等试验选出具有高抗氧能力的假丝酵母Y1,其羟基自由基清除能力超过40%。韦琰琰[26]从食品中筛选到1株具有高抗氧化活性的酵母菌Y11,并将其鉴定为Aureobasidiumpullulans。这些研究结果与本研究结果相一致,说明酵母菌具有抑制和清除某些自由基的能力。在发酵食品中,酿酒酵母与马克思克鲁维酵母对食物风味做出的贡献较大[11]37-39[18]47-48,而毕赤酵母一般因其产气效应被视为污染菌[15],本试验中筛选出抗氧化活性较高的7株酵母中也未发现毕赤酵母。
(3) 关于这78株酵母菌的生理生化特性以及对新疆传统发酵乳制品风味方面的作用有待进一步研究。
[1] 秦艳婷. 新疆地区传统发酵乳制品中乳酸菌的分离鉴定及生物多样性分析[D]. 呼和浩特: 内蒙古农业大学, 2014: 1-15.
[2] BUCHL N R, SEILER H. Yeasts and molds-yeasts in milk and dairy products[M]. Technische Universitat, Munchen, Germ-any, 2011: 2 761-2 769.
[3] GARCIA Hernandez, RODRIGUEZ Y, BRANDAO Z, et al . Identification and in vitro screening of avian yeasts for use as probiotic[J]. Research In Veterinary Science, 2012(93): 798-802.
[4] LABRIE H R, FLISS S. Antimicrobial and probiotic properties of yeasts: from fundamental to novel applications[J]. Frontiers in Microbiology, 2012(3): 416-421.
[5] ARROYO Lopez, ROMERO F N, et al. Potential benefits of the application of yeast starters in table olive processing[J]. Frontiers in Microbiology, 2012(5): 34-38.
[6] VENTRICE R M, VARONE D, SIDARI M A, et al. HPLC determination of phenolics adsorbed on yeasts. [J]. Pharm Biomed Anal, 2006, 42(1): 46-55.
[7] CAMARGO G L, GIANETI F, CAMPOS M. Evaluation of dermatological effects of cosmetic formulations containingSaccharomycescerevisiaeextract and vitamins [J]. Food Chem Toxicol, 2008, 46(11): 3 493-3 500.
[8] RAWAT S. Food spoilage: microorganisms and their prevention[J]. Asian Journal of Plant Science and Researc, 2015, 5(4): 47-56.
[9] ANTUNES J, AGUIAR C. Search for killer phenotypes with potential forbiological control[J]. Annals of Microbiology, 2012, 62: 427-433.
[10] KURTZMAN C P, ROBNEL C J. Identification and phylogeny of ascomycetous yeasts from nalysis of nuclear large subunit (26S) ribosomal DNA partial sequences[J]. Antonie van Leeuwenhoek, 1998, 73: 331-371.
[11] 吴阳. 赛里木酸奶中酵母菌筛选鉴定及发酵特性研究[D]. 南京: 南京农业大学, 2012.
[12] LACHANCE M A, DANIEL H M. The D1/D2 domain of the large_subunit rDNA of the yeast speciesClavisporalusitaniaeisunusually polymorphic[J]. FEMS Yeast Research, 2003, 4:253-258.
[13] 王庆国, 刘天明. 酵母菌分类学方法研究进展[J]. 微生物学杂志, 2007, 27(3): 96-100.
[14] 陈君, 刘红芳, 徐靓, 等. 抗氧化酵母菌对小鼠的抗衰老作用初探[J]. 江西农业大学学报, 2013, 35(6): 1 284-1 289.
[15] CAURE Portugal, PINTO L. Potential spoilage yeasts in winery environments: Characterization and proteomic analysis ofTrigonopsiscantarellii[J]. International Journal of Food Microbiology, 2015: 113-12.
[16]李绍兰, 周斌, 等. 真菌DNA提取方法的改良[J]. 云南大学学报:自然科学版, 2002, 24(6): 471-472.
[17] 谢婕, 赵欣, 等. 传统发酵牦牛酸乳中酵母菌的分子生物学鉴定[J]. 食品科学, 2015, 36(11): 114-118.
[18] 吐汗姑丽·托合提. 拜城赛里木拉丝酸奶微生物多样性分子解析及其益生特性研究[D]. 乌鲁木齐: 新疆师范大学, 2015: 1-39.
[19] KURTZMAN C P. Use of gene sequence analyses and genome comparisons for yeast systematics[J]. International Journal of Systematic and Evolutionary Microbiology, 2014, 64: 325-332.
[20] 尹亚辉, 安文涛, 董亮, 等. 不同世代酿酒酵母胞内抗氧化酶活性变化[J]. 食品科技, 2013, 38(8): 38-41.
[21] 曾文. 疏花水柏枝内生真菌抗氧化能力分析及应用[D]. 宜昌: 三峡大学, 2015: 1-15.
[22] GABRIELA Diosma. DAVID E Romanin. Yeasts from kefir grains: isolation, identification, and probiotic characterization[J]. World J Microbiol Biotechnol, 2014, 30: 43-53.
[23] YANG Jun-jun, GUO Chun-feng. Isolation and identification of yeast in yak milk dreg of Tibet in China[J]. Dairy Sci. & Technol, 2014(94): 455-467.
[24] 李静, 石静. 新疆酸驼乳中酵母菌的生理生化鉴定及初步应用[J]. 中国食物与营养, 2012, 18(1): 22-27.
[25] 戴玥, 余晓斌. 抗氧化菌的筛选及混菌发酵红景天条件优化[J]. 日用化学工业, 2017, 47(7): 408-413.
[26] 韦琰琰. 食品中具有抗氧化活性的酵母菌的筛选及其特性的初步研究[D]. 武汉: 华中农业大学, 2013: 1-28.

