生物表面活性剂Surfactin的界面行为研究
李艳艳 白 晶 张 剑
(1. 山西大学化学化工学院,山西太原,030006;2. 山西勇宁记科技有限公司,山西太原,030006)

生物表面活性剂Surfactin是由微生物枯草芽孢杆菌(Bacillus subtilis)经过发酵产生的具有两亲结构特征的次级代谢产物,属于胞外产物,呈晶状形貌[1,2],是迄今报道的表面活性最强的表面活性剂种类之一。生物表面活性剂Surfactin具有表面活性强大、乳化和发泡性能良好[3-4]、毒性低、易生物降解、环境无污染等优良特性,同时还具有抗真菌和细菌,溶解血液红细胞、原生质体和原生质球等生物活性[5]。如能将水的表面张力从72mN/m降低到27mN/m,将十六烷烃的界面张力降至1mN/m[6];可以有效保持食品的口感和风味,并且可以有效抑制食品中有害微生物的滋生,起到食品防腐的作用[7]。鉴于Surfactin强大的表面活性和生物活性,其在环保行业、石油开采行业、高端化妆品行业、医药行业、食品加工行业等有很广泛的用途[8]。近几年来,Surfactin在医药行业的相关应用研究受到国内外研究者的广泛青睐,这使得Surfactin在抗病毒制剂[9]、抗肿瘤制剂[10]、溶血栓制剂[11]、口服免疫佐剂[12]、乙肝疫苗[13]以及糖尿病治疗[14]等方面的应用研究取得了重大突破。
研究表明,生物活性分子的表面活性和生物活性主要在界面处发生,并受活性分子在亲水-疏水界面上分子形态的影响[15]。因此,关于Surfactin界面行为的研究对于进一步促进Surfactin表面活性和生物活性的应用是非常必要的;关于Surfactin在界面处分子形态的研究对于了解Surfactin的界面行为起着至关重要的作用,有助于从分子水平认识其活性作用机制。而界面处的分子形态主要是指两亲分子在界面定向层的排列方式、分子构型与取向以及在定向层内可能形成的特殊结构如微区和有序分子聚集体等。另一方面,对于Surfactin这类两亲分子在气-液界面的分子组装及其LB膜构筑的研究,将扩展其在分子组装体领域的研究和应用[16]。本文介绍了Surfactin的结构、Surfactin在气-液界面上的分子形态、Surfactin在气-液界面上的分子组装以及LB膜构筑、Surfactin在油-水界面上的界面行为、Surfactin在固-液界面上的界面行为,对了解Surfactin的表面活性以及生物活性的作用机理具有重要意义。
1 Surfactin的结构
生物表面活性剂Surfactin是一系列具有相似基本结构的环状脂肽的总称。其基本结构是b-羟基脂肪酸和多肽以内酯键结合而成的环状脂肽,该肽含有7个氨基酸,排列顺序一般为L-Glu1→L-Leu2→D-Leu3→L-Val4→L-Asp5→D-Leu6→L-Leu7,其中第一位的Glu(谷氨酸)和第五位的Asp(天冬氨酸)是酸性氨基酸,这使得整个Surfactin分子可带负电且容易形成盐类,并且位置7-,4-,2-的氨基酸容易被其他氨基酸替换,另外,b-羟基脂肪酸链的长度为C13-C15,Surfactin的结构示意图如图1[16-19]:
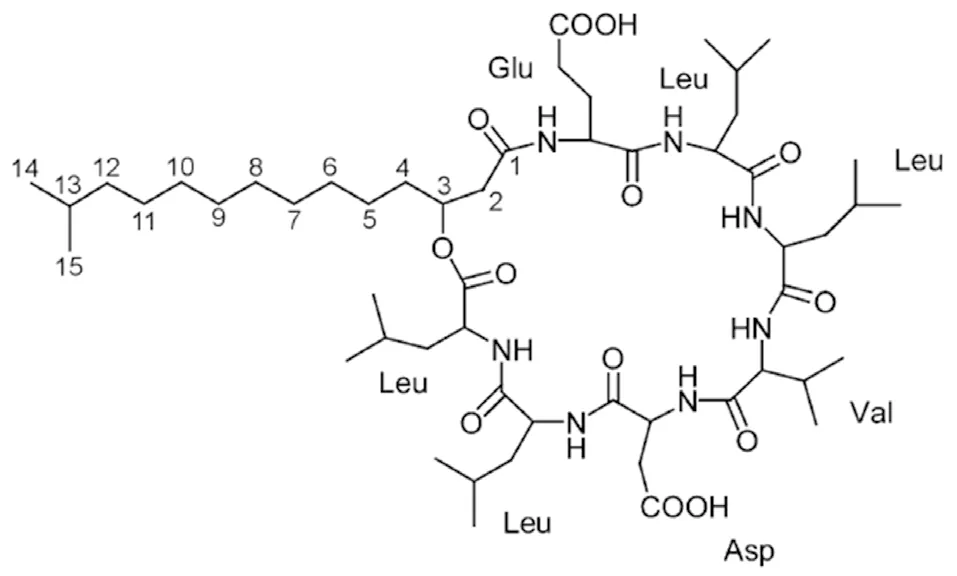
图1 Surfactin的结构示意图[16]
Surfactin系列物结构上的差别就在于几个位置的氨基酸的种类不同以及氨基酸的连接顺序不同,同时碳链的长度及支链位置也不相同。目前,已经被发现并且分离出来的Surfactin结构类似物有以下12种(见表1)[19]。
Surfactin分子的构成决定了它是同时具有亲水性和疏水性的两亲性物质[20]。它的环肽中的谷氨酸(Glu)残基和天冬氨酸(Asp)残基提供了亲水结构域,其他氨基酸残基和脂肪酸链提供了疏水结构域,并且肽环中的氨基酸残基之间可以形成氢键,这促使Surfactin分子在水中形成了b折叠结构,类似于马鞍[21]。马鞍分为两面,其中一面由第1、5位氨基酸残基和相邻的第2、6位氨基酸残基构成:氨基酸残基L-Leu2和D-Leu6彼此面对,氨基酸残基L-Glu1和L-Asp5构成了极性亲水结构域;另一面由第3、4、7位氨基酸残基和脂肪酸链构成:氨基酸残基D-Leu3、L-Val4和L-Leu7与脂肪酸链构成疏水结构域[22-23]。
2 Surfactin的界面行为
2.1 气-液界面处分子的行为
Surfactin在气-液界面处分子形态的研究对于了解Surfactin界面行为起着至关重要的作用。气-液界面的分子形态主要是指两亲分子在表面定向层的排列方式、分子构型与取向以及在定向层内可能形成的特殊结构如微区和有序分子聚集体等,其有助于从分子水平认识其活性作用机制。而在气-液界面的分子组装及其LB膜构筑的研究,将扩展其在分子组装体领域的研究和应用[16]。
2.1.1 气-液界面处分子形态的研究
Hsin-Hui Shen等人[24]使用中子衍射技术研究了空气-水界面处Surfactin在不同pH和一价/二价阳离子存在下的界面行为。中子衍射谱记录了空气-水界面处pH和离子强度对Surfactin结构的影响,结果显示:Surfactin具有疏水性球状结构,并且pH和阳离子的变化导致每个Surfactin分子所占面积的变化和亲水性的变化,但都存在紧凑的球状结构。同时他们还研究了Surfactin在不同的pH和离子的条件下空气-水界面的吸附层结构,研究结果表明:Surfactin具有球形结构和头部基团,比大多数常规合成表面活性剂的疏水基团要小得多,并且观察到两种不同的与头部基团相关的Surfactin结构,但这两种结构并没有太大的差异。另外,由于Surfactin分子之间电荷的排斥作用和带负电的头部基团对脂质体的增溶作用使得Surfactin强烈影响膜结构使平面膜不稳定和形成囊泡,类似于抗生素肽,因此中性Surfactin比在高pH值下带电的Surfactin具有更高的疏水性,这可能会导致中性的Surfactin的表面活性更高且溶血活性更高。

表1 Surfactin的系列物[19]
Maget-Dana等人[25]研究了Surfactin在气-液界面的吸附行为。发现液相的pH值强烈影响Surfactin在气-液界面的吸附参数,如图2所示。在pH=10的碱性环境下,Surfactin稀溶液(5×10-8M)很快在气-液界面达到吸附平衡;当浓度为5×10-8~5×10-7mol/L时,其界面最大吸附量Γmax约为3×1018molecule/m2,这个数值相当于每个分子所占的面积仅为30Å2,表明Surfactin分子在界面上的排列很紧密。他们还发现Surfactin在气-液界面很容易扩散。

图2 液相pH对表面压-分子面积(π-A)曲线的影响[25]
2.1.2 气-液界面处分子组装及其LB膜的研究
Chang-Sheng Song等人[26]用LB膜技术将Surfactin单分子层从空气-水界面转移到云母基质上,用原子力显微镜(AFM)进行了表征,从而研究了沉积压力对SuC14(具有14个C的b-羟基脂肪酸链的Surfactin系列物)的LB膜形貌的影响。原子力显微镜的图像显示在较低的沉积压力下有相分离,表明存在Surfactin结构域。在较高的沉积压力下,云母基质完全被Surfactin单层覆盖,球形聚集体形成于顶部。他们还将Surfactin系列物(相同的极性头,不同的脂肪烃链长度)用于研究疏水链长度对聚集行为的影响,使用AFM和FTIR技术进行表征。AFM可以观察到沉积Surfactin的LB膜中的纳米尺寸的二维分子簇,发现表面簇的形态受到疏水链长度的影响,表面聚集物的形式和大小的差异可能是由于疏水链构象的变化造成的;FTIR研究表明:Surfactin内酯环上羧基氢键参与表面聚集体的形成。他们提出了气-液界面处的表面聚集物的一种形成过程,提出因为疏水相互作用,自组装分子的疏水链聚集在团簇的中心,并凸向空气,而亲水肽环通过氢键进行排列。他们的研究关注于Surfactin的LB膜上的聚集体形成,为两亲性脂肽在空气-水界面的界面行为提供了新的见解。这对于了解Surfactin的显著特性是非常重要的,如驱动阳离子进入生物细胞膜以及Surfactin与细胞膜脂质之间的相互作用。然而,Surfactin的LB膜中的球形团簇的结构以及这些表面聚集体的形成机理尚不明确。因此,可将原位仪器等如布鲁斯特角显微镜和原位红外光谱用于研究空气-水界面上分子聚集行为来获取界面处分子水平上的结构信息。
Maget-Dana等人[25]利用Langmuir膜天平研究了液相pH、温度以及阳离子对表面压-分子面积(π-A)曲线的影响,从而报道了Surfactin在空气-水界面的界面性质。他们发现在酸性的亚相环境下,π-A曲线主要由扩张膜(Ⅰ区)、平台区(Ⅱ区)和固态膜(Ⅲ区)构成,如图3。他们认为在扩张态,Surfactin分子中的肽环和脂肪烃链平躺在气-液界面;在平台区,分子中的肽环和脂肪烃链逐渐直立;而在固态膜中,分子中的肽环和脂肪烃链完全垂直于界面。
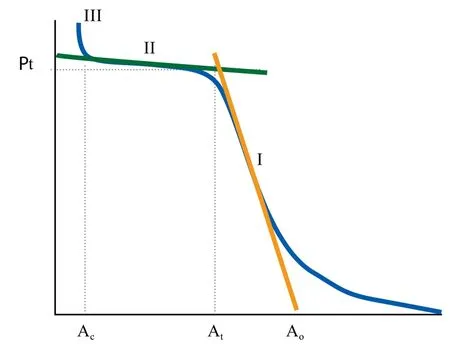
图3 Surfactin在空气-水界面表面压-分子面积(π-A)曲线[25]
Yutaka Ishigami等人[27]研究了Surfactin在酸性亚相上铺展的单分子膜的行为、结构和分子取向,并用暗场电子显微镜(dark- fi eld electron microscope)在Surfactin的LB膜(Langmuir-Blodgett film)上观察到有球形的表面聚集体存在,推测Surfactin分子由于脂肪烃链之间存在疏水相互作用而形成二聚体。在单分子膜的扩张态,二聚体中的脂肪链平躺在界面上,随着表面膜的压缩,二聚体中的脂肪烃链逐渐直立,而肽环始终水平地仰卧在界面,如图4。在平台区,由于分子的b-片层(b-sheet)结构,Surfactin分子可能紧密堆积、形成非均匀的多层膜,并且进一步压缩表面膜有利于二维Surfactin分子的重新定向,使分子之间的接触更加紧密,但会促成多层不均匀薄膜的形成。
2.2 油-水界面处分子的行为

图4 Surfactin在气-液界面的结构示意图[27]
Nicolas等人[28]研究了己烷-水界面处Surfactin分子的界面行为。运用分子动力学研究了亲疏水介质系统己烷-水界面处不同界面浓度下生物表面活性剂Surfactin的动力学性质。记录了Surfactin分子的形状和取向,如氢键和Ramachandran角,用来研究环境对分子结构的影响。证明Surfactin分子的肽环部分在界面采用四面体形状,类似于紧凑的“马鞍形”构象,肽环骨架结构表现出很大的灵活性,构象运动和结构波动强烈依赖于界面浓度,如图5。图5显示了Surfactin的浓度对“马鞍形”构象形状和取向的影响、肽环部分的翻转以及分子的聚集状态(adih表示肽环形成的二面角用来表征肽环的形状,Sheight表示肽环底部到顶部的高度用来表征肽环取向)。此外,他们通过计算界面张力和横向旋转扩散系数来测量Surfactin的表面活性。他们的研究证明了在相同的亲水/疏水界面处Surfactin分子根据其界面浓度采取不同的构象:在高浓度的环境中,分子相互聚集使得疏水残基和亲水介质之间的相互作用最小化,分子间的聚集主要由范德华力和羧酸侧链的氢键维持稳定。此外,当亲水残留被环境屏蔽时,肽部分可以发生一个完整的翻转,这可能与Surfactin分子穿过疏水介质脂质膜的能力有关。他们的研究是首次在原子水平上进行的Surfactin在液体亲水/疏水环境的动力学研究,为Surfactin分子的结构变化性与界面浓度和分子环境的关系研究带来了有趣的见解。
2.3 固-液界面处分子的行为
Sagheer A. Onaizi等人[29]使用表面等离子体共振技术(SPR)研究了亲水性固-液界面以及疏水性固-液界面处Surfactin分子的吸附性质。亲水性固-液界面的固相采用十八烷硫醇官能化的SPR传感器芯片(BME-液),疏水性固-液界面的固相采用b-巯基乙醇功能化的SPR传感器芯片(ODT-液)。在亲水性固-液界面(BME-液体界面),Surfactin平均表面覆盖面积随其体积浓度变化的实验数据使用Langmuir吸附等温线拟合,得出最大值吸附量(Γmax)和亲和常数(Ka)分别为(0.44±0.03)mg/m2和(1.6±0.3)×105M-1,单分子占据面积为(401±27)Å2;在疏水性固-液界面(ODT-液体界面),Surfactin平均表面覆盖面积随其体积浓度变化的实验数据使用Langmuir吸附等温线拟合,得出最大吸附量(Γmax)和亲和常数(Ka)分别为(0.12±0.01)mg/m2和(1.1±0.1)×106M-1,单分子占据面积为(157±2)Å2。可以看出,Surfactin在亲水性固-液界面的吸附量比它在疏水性固-液界面的吸附量低三倍左右。从而证明了疏水相互作用在Surfactin分子吸附过程中特别重要,且Surfactin分子在疏水性固-液界面的堆积比在亲水性固-液界面的堆积更紧凑。
Hsin-Hui Shen等人[24]使用中子衍射技术研究了固-液界面(固相为具有六方晶格的氧化铝Al2O3的结晶形式)处Surfactin在不同pH下的界面行为。发现Surfactin在亲水性固-液界面的界面行为对pH有很强的依赖性,当pH值从7.5到6.5再到5.5,中子反射率增强,当pH值从5.5到6.5再到7.5,中子反射率减弱到起始值,如图6。图6表明,不同pH值条件下,Surfactin分子吸附到固体表面的过程是可逆的。研究结果表明:pH值为7.5时,Surfactin分子呈现疏水球状结构,不容易吸附到固体表面;pH值为6.5时,Surfactin分子在固体表面的吸附膜是不完整的;pH值为5.5或低于5.5时,Surfactin分子在固体表面会形成多层吸附结构。

图5 己烷-水界面处Surfactin浓度对其分子形状和取向的影响
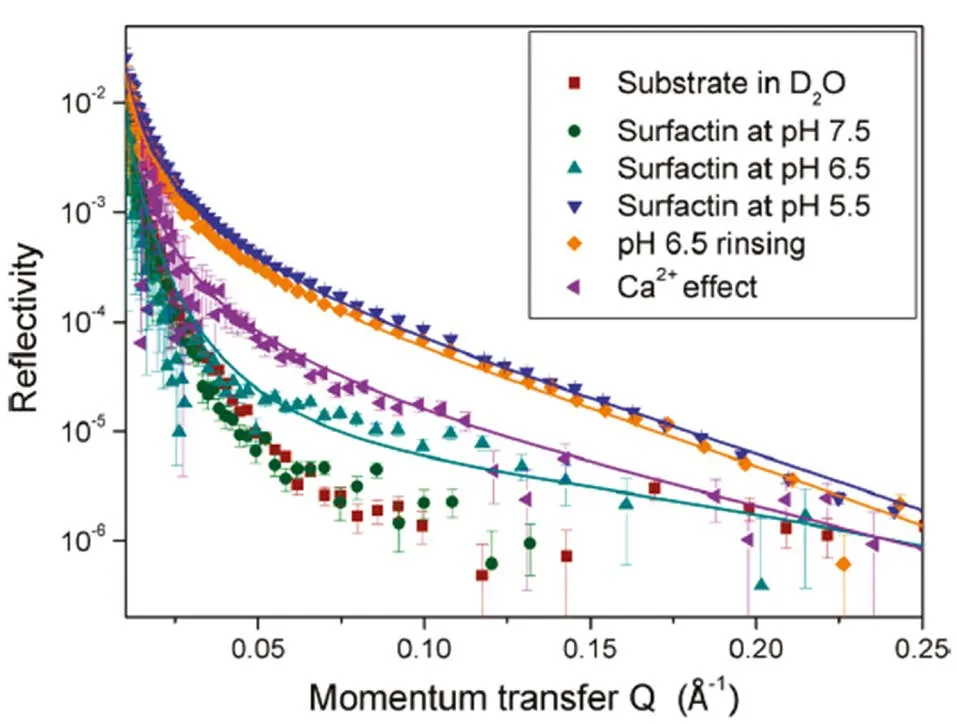
图6 Surfactin在固-液界面处中子反射率随pH的变化[24]
3 总结与展望
生物活性分子的界面行为对于促进其分子表面活性和生物活性的应用具有特殊的意义。研究生物表面活性剂Surfactin在界面上的分子行为对了解Surfactin的表面活性以及生物活性的作用机理具有重要意义。
生物表面活性剂Surfactin在不同界面处的分子形态与其结构有紧密的联系。即对于Surfactin系列物,分子中亲水或疏水基团的差异可导致其分子形态明显不同。因而有必要对Surfactin的结构进行修饰,研究其结构与界面活性的关系,这将有助于了解其活性作用基团并设计合成新型的具有特殊活性的化合物。Surfactin在单分子膜内自组装形成具有二维和三维尺度的表面聚集体结构,但是目前对于其表面聚集机制以及聚集体内部精细结构的了解还比较有限。随着科学技术的发展,出现了许多可用于界面原位在线检测和结构分析的技术和方法,如X射线反射、X射线衍射和中子反射等。相信这些界面原位在线检测及结构分析技术和方法的发展和应用,将为Surfactin在界面上微观结构的研究提供更多信息[16]。
[1]Sen R, Swaminathan T. Application of response-surface methodology to evaluate the optimum environmental conditions for the enhanced production of surfactin[J].Applied Microbiology & Biotechnology, 1997, 47(4):358-363.
[2]李晶, 杨谦. 生防枯草芽孢杆菌的研究进展[J]. 安徽农业科学,2008, 36(1):106-111.
[3]Peypoux F, Bonmatin JM, Wallach J. Recent trends in the biochemistry of surfactin.[J]. Applied Microbiology and Biotechnology, 1999, 51(5):553-563.
[4]丁立孝, 何国庆, 孔青,等. 微生物产生的生物表面活性剂及其应用研究[J]. 生物技术, 2003, 13(5):52-54.
[5]Thimon L, Peypoux F, Maget R D, et al. Interactions of bioactive lipopeptides, iturin A and surfactin from Bacillus subtilis[J].Biotechnology & Applied Biochemistry, 1992, 16(2):144-151.
[6]赵越. 微生物脂肽制备条件优化及其衍生化反应的特征[D]. 华东理工大学, 2012.
[7]Mandal S M, Barbosa A E A D, Franco O L. Lipopeptides in microbial infection control: Scope and reality for industry[J].Biotechnology Advances, 2013, 31(2):338-345.
[8]孙文, 刘洁, 王泽建,等. 一种枯草菌脂肽钠的纯化方法: CN, CN 103059108 A[P]. 2013.
[9]Huang X, Lu Z, Zhao H, et al. Antiviral Activity of Antimicrobial Lipopeptide from Bacillus subtilis, fmbj Against Pseudorabies Virus, Porcine Parvovirus, Newcastle Disease Virus and Infectious Bursal Disease Virus in Vitro[J].International Journal of Peptide Research & Therapeutics,2006, 12(4):373-377.
[10]Lee J H, Nam S H, Seo W T, et al. The production of surfactin during the fermentation of cheonggukjang by potential probiotic Bacillus subtilis CSY191 and the resultant growth suppression of MCF-7 human breast cancer cells[J]. Food Chemistry, 2012, 131(4):1347-1354.
[11]Dehghannoude G, Housaindokht M, Bazzaz B S. Isolation,characterization, and investigation of surface and hemolytic activities of a lipopeptide biosurfactant produced byBacillus subtilis ATCC 6633.[J]. Journal of Microbiology, 2005,43(3):272-276.
[12]Gao Z, Zhao X, Lee S, et al. WH1fungin a surfactin cyclic lipopeptide is a novel oral immunoadjuvant[J]. Vaccine, 2013,31(26):2796-2803.
[13]Pan H, Zhao X, Gao Z, et al. A surfactin lipopeptide adjuvanted hepatitis B vaccines elicit enhanced humoral and cellular immune responses in mice[J]. Protein & Peptide Letters, 2014,21(9):901-910.
[14]Gao Z, Zhao X, Yang T, et al. Immunomodulation therapy of diabetes by oral administration of a surfactin lipopeptide in NOD mice[J]. Vaccine, 2014, 32(50):6812-6819.
[15]Infante M R, Moses V. Synthesis and surface activity properties of hydrophobic/hydrophilic peptides[J]. International Journal of Peptide & Protein Research, 1994, 43(2):173-179.
[16]宋昌盛, 叶汝强, 牟伯中. 微生物脂肽在气/液界面的分子形态[J]. 化学进展, 2009, 21(6):1118-1123.
[17]Onaizi S A, Nasser M S, Twaiq F. Adsorption and thermodynamics of biosurfactant, surfactin, monolayers at the air-buffered liquid interface[J]. Colloid & Polymer Science,2014, 292(7):1649-1656.
[18]Lu J R, Zhao X B, Yaseen M. Biomimetic amphiphiles:Biosurfactants[J]. Current Opinion in Colloid & Interface Science, 2007, 12(2):60-67.
[19]吕应年, 杨世忠, 牟伯中. 脂肽类生物表面活性剂的研究进展[J]. 生物技术通报, 2004(6):11-16.
[20]Tsujii K. Surface Activity: Principles, Phenomena, and Applications[J]. 1998.
[21]Xavier Gallet, Magali Deleu, Hary Razafindralambo, et al. Computer Simulation of Surfactin Conformation at a Hydrophobic/Hydrophilic Interface[J]. Langmuir, 1999,15(7):2409-2413.
[22]张莉. 枯草芽孢杆菌BS1 Surfactin高产菌株的选育研究[D]. 南京农业大学, 2013.
[23]Peypoux F, Bonmatin JM, Wallach J. Recent trends in the biochemistry of surfactin[J]. Applied Microbiology and Biotechnology, 1999, 51(5):553-563.
[24]Shen H H, Lin T W, Thomas R K, et al. Surfactin Structures at Interfaces and in Solution: The Effect of pH and Cations[J].Journal of Physical Chemistry B, 2011, 115(15):4427-35.
[25]Maget-Dana R, Ptak M. Interfacial properties of surfactin[J].Journal of Colloid & Interface Science, 1992, 153(1):285-291.
[26]Song C S, Ye R Q, Mu B Z. Aggregation behavior and surface morphology studies of surfactin in Langmuir—Blodgett films[J].Colloids & Surfaces A Physicochemical & Engineering Aspects,2008, 330(1):49-54.
[27]Ishigami Y, Osman M, Nakahara H, et al. Significance of β-sheet formation for micellization and surface adsorption of surfactin[J]. Colloids & Surfaces B Biointerfaces, 1995,4(6):341-348.
[28]Nicolas J P. Molecular Dynamics Simulation of Surfactin Molecules at the Water-Hexane Interface[J]. Biophysical Journal, 2003, 85(3):1377.
[29]Onaizi S A, Nasser M S, Al-Lagtah N M. Self-assembly of a surfactin nanolayer at solid-liquid and air-liquid interfaces[J].European Biophysics Journal, 2015, 45(4):331-339.

