特异性控制神经元活性法研究睡眠-觉醒机制新进展
杨燕飞 黄志力
复旦大学基础医学院药理学系,医学神经生物学国家重点实验室,脑科学研究院与脑科学协同创新中心,上海,200032,中国
睡眠是高度保守的行为,从低等的动物到高等的人类都需要睡眠,但睡眠-觉醒的调控机制仍是不解之谜。根据脑电图(electroencephalogram,EEG)的波幅和频率,以及肌电图(electromyogram,EMG)的活动度,睡眠被分为快速眼动(rapid eye movement,REM)睡眠和非快速眼动(non-REM,NREM)睡眠二个时相。
目前已知调控睡眠的系统主要包括:下丘脑腹外侧视前区(ventrolateral preoptic area,VLPO)神经丛、基底前脑(basal forebrain,BF)、视前区(preoptic area,POA)、脑 干(brainstem,BS)、丘 脑 网 状 核(thalamic reticular nucleus,TRN)和基底神经节(basal ganglia,BG)的γ-氨基丁酸(gamma aminobutyric acid,GABA)能神经元等。主要觉醒调控系统有:脑干网状结构(reticular formation of brain stem,BSRF)、中缝核(raphe nucleus,RN)5-羟 色 胺(5-hydroxytryptamine,5-HT)能神经元、蓝斑(locus coeruleus,LC)去甲肾上腺素(norepinephrine,NE)能神经元、下丘脑外侧(lateral hypothalamus,LH)食欲素(orexin)能神经元、结节乳头核(tuberomammillary nucleus,TMN)组胺(histamine)能神经元、中脑导水管周围灰质(periaqueductal gray,PAG)多巴胺(dopamine,DA)能神经元、脑桥 -中脑(pons-midbrain)乙酰胆碱(acetylcholine,ACh)能神经元和BF胆碱能和非胆碱能神经元等。
睡眠和觉醒是通过脑内多种神经递质和内源性睡眠促进物质共同作用、相互影响而实现的,同时也受到昼夜节律和内环境稳态的调控[1-3]。睡眠-觉醒行为受大脑中诸多神经系统调节,具有复杂的神经环路,理解其调节机制具有极大的科学价值和临床意义[4]。特异性控制神经元活性技术的广泛应用,为揭示睡眠-觉醒的机制提供了更有力的工具。
1 特异性控制神经元活性法
1.1 光遗传学
2005年斯坦福大学Karl Deisseroth实验室首次将光敏感视紫红质通道蛋白 2(channelrhodopsin-2,ChR2)应用在神经元中,开启了神经生物学的新纪元[5]。目前主要发现三类光控蛋白,包括快速兴奋性、快速抑制性和光控信号通路蛋白三大类。ChR2是最常用的兴奋性光控蛋白,可被473 nm波长的蓝光激活,使胞外阳离子内流,产生内向电流,引起神经元去极化[6-7]。嗜盐菌紫质(halorhodopsin,NpHR)可以被570 nm波长黄光激活,引发氯离子内流,使细胞超极化。此外还有其他类型的抑制性的光控蛋白[6-7]。如,古嗜盐菌紫质(arechaerhodopsin,ArcH)是外向的质子泵,ArcH可以被566 nm蓝绿光激活,将胞内的质子泵出,从而产生外向的电流抑制神经元的电活动[8]。近年来又发现响应632 nm红光的氯离子通道,通过筛选得到蛋白Jaws[9]。
1.2 药理遗传学
北卡罗来纳大学Bryan Roth等通过突变胆碱毒蕈碱型受体,创造了特异性被人工配体激活的人工受体(designer receptors exclusively activated by designer drugs,DREADDs)[10-11]。DREADDs 没 有 基 础 活 性,不能被内源性配体胆碱所活化,但能通过外源给予氧化氯氮平(clozapine oxide,CNO)激活。DREADDs包括兴奋型和抑制型二种,兴奋型系人源化的hM3Dq和鼠源化的rM3Ds,抑制型为人源的hM4Di。M3受体是Gq型G蛋白偶联受体(G protein-coupled receptors,GPCRs),通过磷脂酰肌醇途径增加胞内钙浓度,从而兴奋神经元[12-13]。M4受体是 Gi型 GPCR,通过抑制腺苷酸环化酶或耦联内向整流钾离子通道(inwardly rectifying potassium 3,Kir3)使细胞超极化从而抑制神经元[11]。最近Bryan Roth课题组又通过突变阿片肽受体κ受体获得的 DREADDs(κ-opioid receptor DREADDs,KORD),KORD和hM4Di一样也是介导内向整流钾离子通道,使细胞超极化,从而抑制神经元活性[14-15]。
运用光遗传学和药理遗传学方法,在特异性神经元上选择性表达人工受体,达到高空间分辨率人工控制神经元活性的目的。光遗传学在时间分辨率上更胜一筹,而药理遗传学作用时间更持久,根据实验需求,两者联用,实现互补。
2 调控睡眠的核团
已知睡眠相关脑区,包括VLPO[16-17]和面神经旁核(parafacial zone,PZ)[18-19]等,但变性这些核团,对睡眠量的长期影响都很小,提示可能还有更重要的核团存在。控制睡眠和觉醒的核团是相互联系,具体哪个脑区及哪类神经元在睡眠调控中发挥重要作用,尚不清楚。本课题组长期关注腺苷对睡眠的调控及其作用机制,揭示了腺苷通过作用于TMN组胺能觉醒系统中A1受体 (adenosine A1receptor,A1R)而发挥促眠作用[20-21];发现咖啡因是通过阻断腺苷 A2A受体(adenosine A2Areceptor,A2AR)发挥强效促觉醒作用[22-23],但脑内A2AR阳性神经元是否启动或维持睡眠,仍有待阐明。
2.1 背侧纹状体
背侧纹状体(dorsal striatum,DS)是BG主要的输入核团[24],其神经元密集表达 A2AR[25]。Yuan 等利用药理遗传、光遗传、免疫电镜和电生理等技术,发现小鼠DS头端和中部区域的A2AR阳性神经元,通过控制外侧苍白球(external globus pallidus,GPe)中的小清蛋白阳性(parvalbumin positive,PV+)神经元,调节动物活动期睡眠(Fig.1)[26]。这一调节作用,可能为治疗帕金森病(Parkinson’s disease,PD)患者的白天嗜睡提供新的思路[26]。

Fig.1 A2AR neurons in the rostral and central striatum control sleep
2.2 伏隔核
伏隔核(nucleus accumbens core,NAc)一直被认为在奖赏、成瘾和恐惧等活动中起重要作用[27]。有研究表明NAc能够调节慢波睡眠(slow wave sleep,SWS)[28],另外阻断 NAc中的 A2AR 是咖啡因的促觉醒作用的重要机制[29],但NAc中A2AR阳性神经元在调节睡眠中发挥的作用不明确。。
Oishi等利用转基因小鼠和光遗传学技术,发现光刺激NAc中A2AR阳性神经元诱发快速而强烈的SWS,并增加小鼠睡眠量。当小鼠出现行为动机时,伏隔核内A2AR神经元活性明显被抑制,小鼠觉醒量增加;相反动机行为缺乏时,伏隔核内A2AR神经元活性增加,小鼠出现睡眠。以上研究结果表明,NAc内A2AR阳性神经元直接调节动机行为缺乏性睡眠(Fig.2)[28]。
此外,Fang 等发现,小鼠敲除 A2AR,酒精(3 g·kg-1)所引起的促眠作用消失,提示酒精可能通过增加脑内腺苷水平,发挥促眠作用[30]。
2.3 嗅球
嗅觉功能障碍(嗅觉阈值增加和气味鉴别受损)和REM睡眠障碍症状常出现在PD患者运动症状发生之前[31-32];动物实验发现切除大鼠嗅球(olfactory bulb,OB)后,动物表现出REM睡眠增加[33],此研究提示嗅觉功能的异常和REM睡眠障碍密切相关。此外,OB中有大量A2AR分布[34],但OB中A2AR对睡眠调节的机制目前尚不清楚。
Wang等运用DREADDs法特异性操纵OB的A2AR阳性神经元活性,发现OB中的A2AR参与REM睡眠的调控。当激活OB中A2AR阳性神经元,小鼠REM睡眠降低;抑制该类型神经元,小鼠REM睡眠增加。结合神经元特异性示踪技术的研究发现OB中A2AR阳性神经元调控REM睡眠可能与支配下游的梨状皮层和嗅结节有关[35]。
2.4 面旁核
PZ是近年新发现的与促眠相关的核团[36],该区域的神经元在睡眠期兴奋性上升,当化学毁损该区域的神经元则导致动物觉醒量显著增加,表明PZ可能参与睡眠行为的调控[37],但对PZ-GABA能神经元能否启动和维持SWS尚不清楚。Fuller等利用DREADDs法选择性激活PZ-GABA能神经元,研究发现小鼠NREM睡眠量出现连续3 h的显著增加;光遗传学实验的结果发现PZ-GABA能神经元可能是通过抑制其下游觉醒核团 -臂旁核(parabrachial nucleus,PB),达到启动睡眠的作用。总之,PZ的GABA能神经元能够有效地启动SWS,调节大脑皮层的脑电活动[18]。
2.5 下丘脑腹外侧视前区
VLPO一直被认为是脑内重要的睡眠中枢,该区域通过向脑内多个觉醒脑区进行抑制性投射,从而启动睡眠[38]。
Dan等利用神经元逆行示踪技术锁定VLPO区域内投射到下丘脑重要觉醒中枢TMN的神经元。研究结果揭示了光激活VLPO投射到TMN的GABA(GABAVLPO-TMN)能神经元,可诱发小鼠进入睡眠状态;激活整个VLPO区域其它的GABA能神经元则诱发小鼠出现觉醒。这一结果证实了VLPO在启动睡眠行为中扮演的重要作用,也提示了同一核团内相同类型的神经元对睡眠-觉醒行为的调控可能有着完全不同的作用[39]。
2.6 外侧下丘脑
黑色素浓缩激素(melanin-concentrating hormone,MCH)是LH区域内稀疏分布的神经肽[40]。MCH神经元在睡眠期间活跃,因此药理学研究认为,此类神经元可能参与调控睡眠[41]。
Sonia Jego等在小鼠REM睡眠期,光激活MCH神经元,REM睡眠持续时间增加;抑制MCH神经元,海马θ节律的频率和幅度降低,但不影响REM睡眠持续时间。此外,MCH神经元与觉醒核团TMN存在着功能性连接,激活MCH神经元投射到TMN区域的神经末梢,可诱发TMN区域组胺能神经元出现抑制性突触后电流,小鼠REM睡眠显著延长。此研究结果表明MCH神经元参与REM睡眠调控可能是通过抑制脑内觉醒核团TMN实现的[42]。而Tsunematsu等在NREM睡眠期激活MCH神经元,诱发小鼠REM睡眠,在觉醒期间激活无效;抑制MCH神经元则觉醒增加,NREM睡眠降低,不影响REM睡眠。此研究揭示了只激活MCH神经元足以触发小鼠从NREM到REM睡眠的转变,并在NREM睡眠的起始和维持中起重要作用[43]。综上所述,LH中MCH神经元参与调控NREM和REM睡眠,但还有待更近一步的研究。
2.7 丘脑网状核
TRN位于丘脑白质附近,是大脑皮层和丘脑信息交流的门户,TRN中大量的GABA能神经元在睡眠调节中起着重要作用[44]。BF和脑干中广泛投射的胆碱能神经元在调节REM睡眠、睡眠-觉醒周期和促进觉醒中发挥重要作用,投射到TRN的胆碱能神经元在睡眠中的作用机制尚不明确。

Fig.2 Optogenetic stimulation of A2AR neurons in the NAc evoked a rapid and robust SWS response

Fig.2 (continued)
Ni等借助胆碱能神经元选择性表达ChR2的转基因小鼠和光遗传学技术,发现光刺激投射到TRN的胆碱能神经元,激活局部GABA能神经元,会促进小鼠睡眠并维持NREM睡眠,但REM睡眠不受影响。直接激活TRN中投射的胆碱能,会缩短入睡潜伏期和产生NREM睡眠[45]。此外,Lewis等研究表明TRN可快速调整局部皮层的状态。光激活TRN,会迅速引起皮层产生类似于睡眠中的慢波活动,小鼠的觉醒明显减少[46]。
2.8 未定带
未定带(zona incerta,ZI)是与 LH 相连的脑区,参与调节感觉-运动的整合[47]。刺激丘脑向ZI投射的神经纤维可诱发睡眠样状态[48-49],但ZI中不同类型的神经元在睡眠调控中的作用未知。Liu等研究发现腹侧未定带(ventral ZI,VZI)中的一类GABA能神经元可促睡眠。这类神经元表达LIM同源因子Lhx6,能直接抑制可激活觉醒的下丘脑分泌素细胞和GABA能细胞的活性。小鼠的睡眠期间,选择性的激活或抑制VZI中Lhx6阳性神经元,可直接增加或减少睡眠时间。此研究表明,VZI中GABA能神经元能够促进睡眠[50]。
3 调控觉醒的核团
由Moruzzi和Magoun提出的“网状结构上行激活系统”是经典的觉醒控制模型,电刺激中脑网状结构引起猫觉醒[51]。上行兴奋性冲动在丘脑中央髓板内核换神经元,通过非特异性投射激活整个大脑皮层。尽管中脑网状结构-丘脑-皮层通路是激活大脑皮层的重要结构,但并非唯一激活系统。目前已知调控觉醒的核团还包括 RN[52]、LC[53]、TMN[54]、LH[55]和 BF[56]等,但这些核团调控觉醒的机制尚不明确。
3.1 基底前脑
BF-胆碱能神经元一直被公认在皮层激活和觉醒行为中起关键作用[57-58]。在BF中,胆碱能神经元仅占总细胞数的5%,GABA能和谷氨酸能神经元分别占35%和55%[59]。但由于传统方法对特定类型神经元选择性操控较差,BF中这三类神经元在睡眠-觉醒调节中发挥的确切作用存在争议。
3.1.1 基底前脑胆碱能神经元
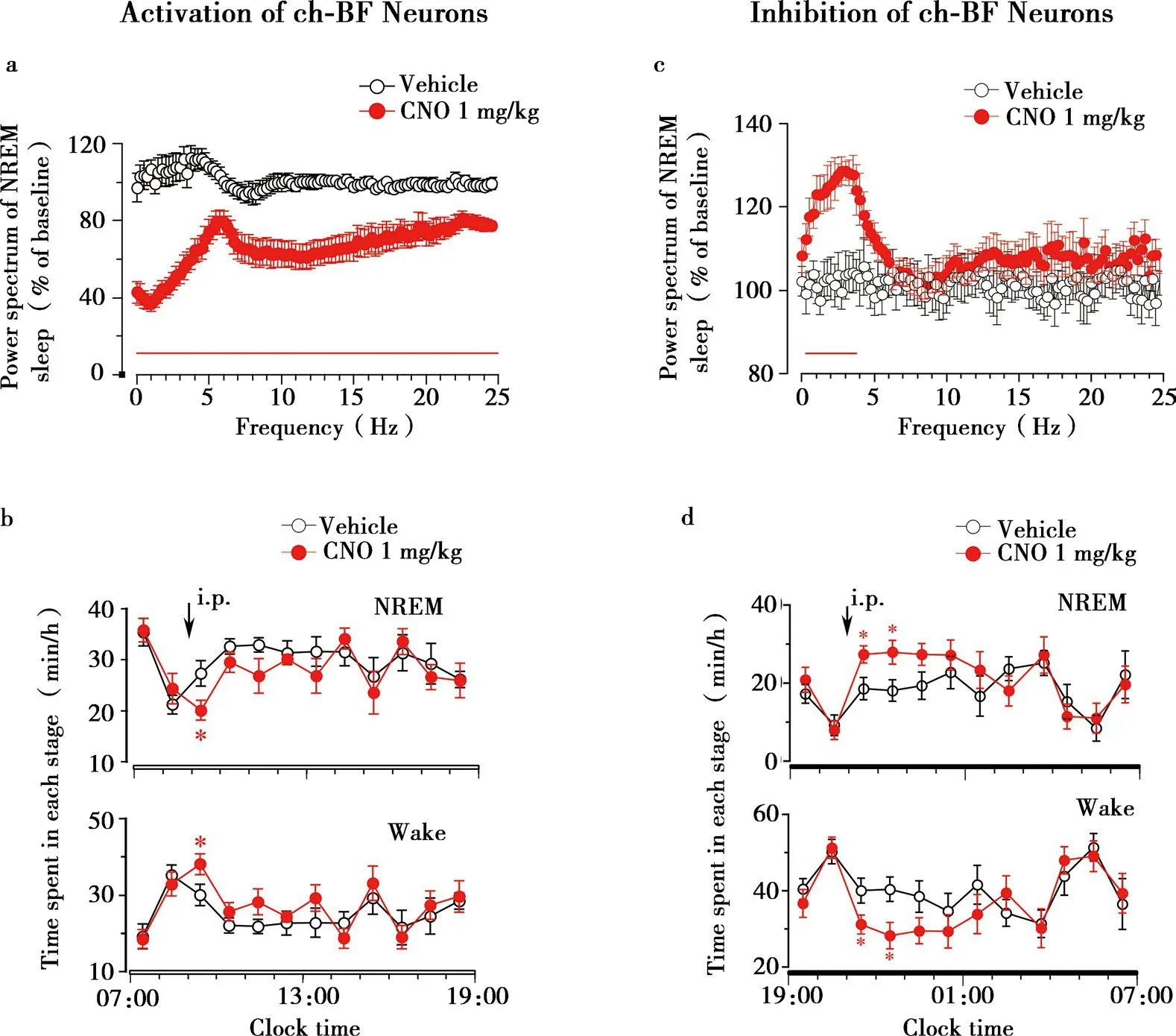
Fig.3 Activation or inhibition of basal forebrain (BF) cholinergic neurons slightly promoted/decreased wakefulness,produced low-delta non-rapid eye movement (NREM) sleep,and decreased/ increased electroencephalogram (EEG) power spectrum of NREM sleep
本课题组通过药理遗传学技术操控BF-胆碱能神经元活性,发现胆碱能神经元通过激活大脑皮层来抑制脑电δ波活动,而不仅是诱导觉醒行为(Fig.3)。DREADDs选择性激活胆碱能神经元,能够显著并持续降低EEG的δ波强度,并产生低δ波的NREM睡眠,增加觉醒的作用短暂;抑制胆碱能神经元,能够显著增加EEG的δ波,轻微减少觉醒。人源化海肾荧光素酶绿色荧光蛋白(humanized renilla green fluorescent protein,hrGFP)示踪BF中胆碱能神经元的投射,发现在次级运动皮层和扣带皮层hrGFP阳性神经纤维密集分布,而在已知与睡眠相关的VLPO区域稀疏。激活BF-胆碱能神经元,c-Fos的表达在次级运动皮层和扣带皮层明显增加,VLPO中c-Fos表达降低[60]。此外,Han等利用光遗传学技术特异性激活BF-胆碱能神经元,会诱导小鼠从SWS状态向清醒或REM睡眠的转化,但不影响SWS的最终转化方向与概率。在清醒或REM睡眠期间激活胆碱能神经元,会维持皮层的活跃;连续刺激1 h后,会导致不活跃期觉醒时间增加,引起类失眠样表现[61]。相比之前激活去甲肾上腺素或丘脑分泌素神经元诱导小鼠从SWS和REM睡眠转换至觉醒的研究,认为在SWS期间光激活胆碱能神经元才最有可能诱导觉醒,在REM睡眠时激活则不能将小鼠唤醒。
3.1.2 基底前脑GABA能和谷氨酸能神经元
觉醒行为被认为依赖于BF中胆碱能神经元,但病变的胆碱能神经元仅引起有限的觉醒和睡眠-觉醒周期变化[56]。提示BF中GABA能和谷氨酸能神经元也可能参与了睡眠-觉醒调控。
Fuller等借助药理遗传学手段研究三种类型神经元在睡眠-觉醒中的调控作用。在小鼠清醒状态下,激活BF-谷氨酸能和胆碱能神经元,均明显巩固觉醒状态,但不影响觉醒量,说明这两类神经元可能在促觉醒方面发挥的作用较小;激活BF-GABA能神经元,产生持续的觉醒和高频的皮层节律,而抑制该类神经元则增加睡眠[62]。Xu等使用光遗传学特异性控制BF神经元,进一步揭示了BF中不同神经元在睡眠-觉醒调节中的相互协作作用,并提供了首个BF中控制睡眠-觉醒的神经环路图。研究表明激活BF中胆碱能、谷氨酸和PV+-GABA能神经元快速诱导觉醒;激活生长抑素阳性(somatostatin positive,SOM+) GABA 能神经元促进NREM睡眠。促觉醒神经元由兴奋性谷氨酸能到胆碱能到PV+神经元连接构成,它们都会受到SOM+神经元的抑制作用[63]。
3.2 腹侧被盖区
腹侧被盖区(ventral tegmental area,VTA)被认为与自主运动和目标导向行为相关[64]。动机行为高度依赖于觉醒,说明VTA神经元可能在睡眠-觉醒行为调节中起作用。
Sun等使用DREADDs法证实了VTA神经元在促觉醒中发挥重要作用。无论是在活动期(21:00)还是非活动期(9:00)激活VTA神经元,小鼠总觉醒率均大幅度增加,NREM和REM睡眠量均明显下降。抑制VTA神经元,不改变NREM睡眠,REM睡眠和觉醒的时间[65]。Eban等进一步揭示了VTA中多巴胺能神经元(VTA dopaminergic neuron,DA-VTA)是觉醒所必需的。使用药理遗传学和光遗传学技术特异性操纵DA-VTA神经元,当DA-VTA神经元受抑制时,即使是面对显著的行为刺激,觉醒也会受到抑制;在小鼠睡眠前,抑制DA-VTA神经元,会促进睡眠相关的筑巢行为。相反,光激活DA-VTA神经元会启动和维持觉醒,抑制睡眠和睡眠相关的筑巢行为。此外,DA-VTA神经元不同的投射,对觉醒调节有差异[66]。以上研究表明VTA神经元在睡眠-觉醒行为中起调节作用。
3.3 脑桥被盖
脑桥被盖核(pedunculopontine tegmental,PPT) /背外侧被盖核(laterodorsal tegmental,LDT)神经元支配的促觉醒区域,包括VTA、LH、BF、额叶皮层和丘脑核[67]。PPT核调节觉醒和REM睡眠一直被认为主要与PPT核胆碱能神经元有关。光激活PPT和LDT的胆碱能神经元,增加小鼠REM睡眠的概率[68];睡眠中电刺激PPT核会导致快速觉醒;损毁猫的PPT核会减少REM睡眠[69]。但PPT核内还有谷氨酸能和GABA能神经元,发挥的作用尚不明确。
Scammell等利用药理遗传学来确定PPT核内这三种类型神经元在调节大脑皮层活动和睡眠-觉醒行为中扮演的角色,并绘制出每个神经元的投射。该研究揭示了PPT-谷氨酸能神经元强烈地促进觉醒,PPT-胆碱能神经元抑制皮层节律,PPT-GABA能神经元略微减少REM睡眠。认为PPT-谷氨酸和胆碱能神经元协同作用产生觉醒。此外,PPT神经元具有不同的投射,对皮层活动和睡眠-觉醒也有不同的影响[70]。研究PPT-谷氨酸能神经元促觉醒本质以及PPT核内各种类型神经元的输入和投射,也是重要的课题。
3.4 外侧下丘脑
促睡眠核团VLPO[71]的突触传入主要来自于与觉醒相关的 LH[55],LH 的病变通常会引起嗜睡[72]。然而,在LH内,这些投射到VLPO神经元的种类及在觉醒网络中的功能仍存在很多疑问。
Venner等认为LH中向VLPO投射的神经元可能含有GABA,而这些神经元在睡眠-觉醒中发挥调节作用。利用药理遗传学方法操控Vgat-ires-Cre小鼠LH的GABA能神经元,证实了LH中向VLPO投射神经元含有GABA,此类神经元在睡眠-觉醒中发挥调节作用。LH中向VLPO投射的神经元表达囊泡GABA转运 体(vesicle GABA transporter,VGAT),这 是 GABA释放神经元的标记物。当激活LH-VGAT神经元可促进觉醒,抑制LH-VGAT阳性神经元则会诱发睡眠,说明LH-VGAT阳性神经元是促睡眠核团VLPO的主要抑制来源。此外,LH投射到VLPO的这些LH-VGAT阳性神经元,也投射到TMN,腹侧中脑导水管周围灰质和 LC[73]。
3.5 终纹床核
终纹床核(bed nucleus of the stria terminalis,BNST)在应激反应、恐惧和焦虑中起重要作用,提高警觉水平和觉醒应答,以应对与压力和危险相关的环境因素[74],但BNST是否参与睡眠-觉醒的调节有待进一步研究。
Kodani等人发现BNST中表达谷氨酸脱羧酶67(glutamate decarboxylase 67,Gad67)的GABA能神经元在小鼠睡眠-觉醒的调节中起至关重要的作用。在NREM睡眠期间,光刺激Gad67-Cre小鼠BNSTGABA能神经元,小鼠立即转向清醒,orexin系统不参与调节;在REM睡眠期间,光刺激BNST-GABA能神经元,对小鼠睡眠-觉醒状态无影响。使用药理遗传学技术长时间刺激BNST-GABA能神经元,会引起持续的觉醒状态,而这种持续觉醒状态可通过提前给予食欲素受体拮抗剂消除。顺行追踪实验揭示了,BNSTGABA能神经元投射到与觉醒密切关联的脑区,包括POA、LH、中脑导水管周围灰质和PB。综上所述,BNST-GABA能神经元在NREM睡眠至觉醒的过渡中发挥重要的作用且orexin神经元不相关,当BNST中GABA能神经元长期受激发时,则会调动orexin系统保持清醒[75]。
4 结语与展望
特异性控制神经元活性技术以及各种转基因动物的出现,突破了传统药理学研究的局限,为睡眠-觉醒的研究提供了极大的便利。
最新研究发现:PZ-GABA能神经元能够有效地启动SWS;激活VLPO至TMN的GABA能神经元可诱发小鼠进入睡眠状态,整体激活VLPO-GABA能神经元则诱发小鼠觉醒;LH中MCH神经元的激活可维持REM睡眠,并在NREM睡眠的起始和维持中也起重要作用;选择性激活TRN-胆碱能神经元末梢后局部激活GABA能神经元,可明显缩短小鼠入睡潜伏期并增加NREM睡眠量,而REM睡眠不受影响;激活OB-A2AR神经元REM睡眠降低,抑制则REM睡眠增加;光刺激NAc中A2AR神经元,会诱发快速而强烈的SWS反应。
对于觉醒调节系统,BF中除了胆碱能神经元,激活BF-GABA能神经元促觉醒;激活VTA神经元增加觉醒,其中DA-VTA在维持清醒中起关键性作用;PPT-谷氨酸能神经元强烈地促进觉醒,PPT-胆碱能神经元抑制皮层慢节律,PPT-GABA能神经元略微减少REM睡眠;激活LH-VGAT阳性神经元可促觉醒,抑制则增加睡眠;GABA-BNST神经元在NREM睡眠至觉醒过渡中发挥作用,当GABA-BNST神经元长期受激发时,则会调动orexin系统保持清醒。
综上所述,GABA能、谷氨酸能和及胆碱能神经元已成为近年来的研究热点。因此,未来的挑战将是揭示这些新发现的调节系统如何协同来调节睡眠和觉醒?内稳态和生物节律因素如何协同调节,影响睡眠和觉醒神经网络?相信随着新技术的不断应用,将会更加深刻而全面地认识到各个睡眠-觉醒核团、不同类型神经元及相关调控网络在睡眠-觉醒中的作用。人工智能及生物物理技术如能实现对这些核团的按需性调控,人为调控人体睡眠将成为可能。
[1] Huang Zhi-li,Yoshihiro Urade,Osamu Hayaishi. The role of adenosine in the regulation of sleep[J]. Current Topics in Medicinal Chemistry,2011,11(8):1047-1057.
[2] Huang Zhi-li,Yoshihiro Urade,Osamu Hayaishi.Prostaglandins and adenosine in the regulation of sleep and wakefulness[J]. Current Topics in Medicinal Chemistry,2007,7(1):33-38.
[3] Michael Lazarus,Chen Jiang-fan,Huang Zhi-li,et al.Adenosine and Sleep[J]. Handbook of Experimental Pharmacology,2017,2017:1-23.
[4] Ravi Allada,Jerome M Siegel. Unearthing the phylogenetic roots of sleep[J]. Current Biology,2008,18(15):R670-R679.
[5] Edward S Boyden,Zhang Feng,Ernst Bamberg,et al.Millisecond-timescale,genetically targeted optical control of neural activity[J]. Nature Neuroscience,2005,8(9):1263.
[6] Yizhar O,Fenno L E,Davidson T J,et al. Optogenetics in neural systems[J]. Neuron,2011,71(1):9-34.
[7] Lief Fenno,Ofer Yizhar,Karl Deisseroth. The development and application of optogenetics[J]. Annual Review of Neuroscience,2011,34:389-412.
[8] Mohamady El-Gaby,Zhang Yu,Konstantin Wolf,et al.Archaerhodopsin selectively and reversibly silences synaptic transmission through altered pH[J]. Cell Reports,2016,16(8):2259-2268.
[9] Chuong A S,Miri M L,Busskamp V,et al. Noninvasive optical inhibition with a red-shifted microbial rhodopsin[J]. Nature Neuroscience,2014,17(8):1123.
[10] Dong Shu-yun,Sarah C Rogan,Bryan Roth. Directed molecular evolution of DREADDs: a generic approach to creating next-generation RASSLs[J]. Nature Protocols,2010,5(3):561.
[11] Blaine N Armbruster,Li Xiang,Mark H Pausch,et al.Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand[J]. Proceedings of the National Academy of Sciences,2007,104(12):5163-5168.
[12] Bryan L Roth. DREADDs for neuroscientists[J].Neuron,2016,89(4):683-694.
[13] Zhu Hu,Bryan L Roth. DREADD: a chemogenetic GPCR signaling platform[J]. International J Neuropsychopharmacology,2014,18(1):pyu007.
[14] Nathan J Marchant,Leslie R Whitaker,Jennifer M Bossert,et al. Behavioral and physiological effects of a novel kappa-opioid receptor-based DREADD in rats[J].Neuropsychopharmacology,2016,41(2):402.
[15] Eyal Vardy,J Elliott Robinson,Li Chia,et al. A new DREADD facilitates the multiplexed chemogenetic interrogation of behavior[J]. Neuron,2015,86(4):936-946.
[16] Mary Ann Greco,Patrick Fuller,Thomas C Jhou,et al.Opioidergic projections to sleep-active neurons in the ventrolateral preoptic nucleus[J]. Brain Research,2008,1245:96-107.
[17] Romain Dubourget,Aude Sangare,Helene Geoffroy,et al. Multiparametric characterization of neuronal subpopulations in the ventrolateral preoptic nucleus[J].Brain Structure and Function,2017,222(3):1153-1167.
[18] Christelle Anaclet,Loris Ferrari,Elda Arrigoni,et al. The GABAergic parafacial zone is a medullary slow wave sleep-promoting center[J]. Nature Neuroscience,2014,17(9):1217.
[19] Christelle Anaclet,Patrick M Fuller. Brainstem regulation of slow-wave-sleep[J]. Current Opinion in Neurobiology,2017,44:139-143.
[20] Huang Zhi-li,Qu Wei-min,Li Wei-dong,et al.Arousal effect of orexin a depends on activation of the histaminergic system[J]. Proceedings of the National Academy of Sciences,2001,98(17):9965-9970.
[21] Shirin Kashfi,Kamran Ghaedi,Hossein Baharvand,et al. A1 adenosine receptor activation modulates central nervous system development and repair[J]. Molecular Neurobiology,2017,54(10):8128-8139.
[22] Huang Zhi-li,Qu Wei-min,Naomi Eguchi,et al. Adenosine A2A,but not A1,receptors mediate the arousal effect of caffeine[J]. Nature Neuroscience,2005,8(7):858.
[23] Bertil B Fredholm,Yang Jiang-ning,Wang Ying-qing.Low,but not high,dose caffeine is a readily available probe for adenosine actions[J]. Molecular Aspects of Medicine,2017,55:20-25.
[24] Ferré S. Adenosine control of striatal function—implications for the treatment of apathy in basal ganglia disorders. in:adenosine receptors in neurodegenerative diseases[J].Elsevier,2017,2017: 231-255.
[25] Michaela Morelli,Nicola Simola,Patrizia Popoli,et al.Role of adenosine in the basal ganglia[J]. In: Handbook of Behavioral Neuroscience,2017,24: 237-256.
[26] Yuan Xiang-shan,Wang Lu,Dong Hui,et al. Striatal adenosine A2Areceptor neurons control active-period sleep via parvalbumin neurons in external globus pallidus[J].Elife,2017,DOI: 10.7554/eLife.29055.
[27] Casey E O’neill,Mckenzie L Le LeTendre,Ryan K Bachtell.Adenosine A2Areceptors in the nucleus accumbens Bi-directionally alter cocaine seeking in rats[J]. Neuropsychopharmacology,2012,37(5):1245.
[28] Oishi Y,Xu Q,Wang L,et al. Slow-wave sleep is controlled by a subset of nucleus accumbens core neurons in mice[J]. Nature Communications,2017,8(1):734.
[29] Sara Valencia Garcia,Patrice Fort. Nucleus Accumbens,a new sleep-regulating area through the integration of motivational stimuli[J]. Acta Pharmacologica Sinica,2018,39(2):165.
[30] Fang Teng,Dong Hui,Xu Xin-hong,et al. Adenosine A2Areceptor mediates hypnotic effects of ethanol in mice[J].Scientific Reports,2017,7(1):12678.
[31] Bradley F Boeve. Idiopathic REM sleep behaviour disorder in the development of Parkinson’s disease[J]. The Lancet Neurology,2013,12(5):469-482.
[32] Richard L Doty. Olfactory dysfunction in neurodegenerative diseases: is there a common pathological substrate ? [J]The Lancet Neurology,2017,16(6):478-488.
[33] Wang Yi-qun,Tu Zhi-cai,Xu Xing-yuan,et al. Acute administration of fluoxetine normalizes rapid eye movement sleep abnormality,but not depressive behaviors in olfactory bulbectomized rats[J]. J Neurochemistry,2012,120(2):314-324.
[34] Huang Zhi-li,Zhang Ze,Qu Wei-min. Roles of adenosine and its receptors in sleep-wake regulation[J]. In:International Review of Neurobiology,2014,119: 349-371.
[35] Wang Yi-qun,Li Rui,Wang Dian-ru,et al. Adenosine A2Areceptors in the olfactory bulb suppress rapid eye movement sleep in rodents[J]. Brain Structure and Function,2017,222(3):1351-1366.
[36] Clifford B Saper,Patrick M Fuller. Wake-sleep circuitry:an overview[J]. Current Opinion in Neurobiology,2017,44:186-192.
[37] Christelle Anaclet,Lin Jian-sheng,Ramalingam Vetrivelan,et al. Identification and characterization of a sleep-active cell group in the rostral medullary brainstem[J]. J Neuroscience,2012,32(50):17970-17976.
[38] Ronald Szymusiak,Noor Alam,Teresa L Steininger,et al. Sleep-waking discharge patterns of ventrolateral preoptic/anterior hypothalamic neurons in rats[J]. Brain Research,1998,803(1-2):178-188.
[39] Shinjae Chung,Franz Weber,Zhong Peng,et al.Identification of preoptic sleep neurons using retrograde labelling and gene profiling[J]. Nature,2017,545(7655):477.
[40] Jamie M Monti,Pablo Torterolo,Patricia Lagos. Melaninconcentrating hormone control of sleep-wake behavior[J].Sleep Medicine Reviews,2013,17(4):293-298.
[41] Roda Rani Konadhode,Dheeraj Pelluru,Carlos Blanco-Centurion,et al. Optogenetic stimulation of MCH neurons increases sleep[J]. Journal of Neuroscience,2013,33(25):10257-10263.
[42] Sonia Jego,Stephen D Glasgow,Carolina Gutierrez Herrera,et al. Optogenetic identification of a rapid eye movement sleep modulatory circuit in the hypothalamus[J]. Nature Neuroscience,2013,16(11):1637.
[43] Tomomi Tsunematsu,Takafumi Ueno,Sawako Tabuchi,et al. Optogenetic manipulation of activity and temporally controlled cell-specific ablation reveal a role for MCH neurons in sleep/wake regulation[J]. J Neuroscience,2014,34(20):6896-6909.
[44] Mircea Steriade. Corticothalamic resonance,states of vigilance and mentation[J]. Neuroscience,2000,101(2):243-276.
[45] Ni Kun-ming,Hou Xiao-jun,Yang Ci-hang,et al.Selectively driving cholinergic fibers optically in the thalamic reticular nucleus promotes sleep[J]. Elife,2016,5: e10382.
[46] Laura D Lewis,Jakob Voigts,Francisco J Flores,et al. Thalamic reticular nucleus induces fast and local modulation of arousal state[J]. Elife,2015,4: 08760.
[47] Mitrofanis J. Some certainty for the “zone of uncertainty”?Exploring the function of the zona incerta[J].Neuroscience,2005,130(1):1-15.
[48] Liu Jia,Hyun Joo Lee,Andrew J Weitz,et al. Frequencyselective control of cortical and subcortical networks by central thalamus[J]. Elife,2015,4: e09215.
[49] Jurkowlaniec E,Trojniar W,Tokarski J. The EEG activity after lesions of the diencephalic part of the zona incerta in rats[J]. Acta Physiologica Polonica,1990,41(7):85-97.
[50] Liu Kai,Juhyun Kim,Dong Won Kim,et al. Lhx6-positive GABA-releasing neurons of the zona incerta promote sleep[J]. Nature,2017,548(7669):582.
[51] Lindsley D B,Bowden J,Magoun H. Effect upon the EEG of acute injury to the brain stem activating system[J].Electroencephalography and Clinical Neurophysiology,1949,1(1):475-486.
[52] Sakai Kazuya,Crochet Sylvain. Increase in antidromic excitability in presumed serotonergic dorsal raphe neurons during paradoxical sleep in the cat[J]. Brain Research,2001,898(2):332-341.
[53] Matthew E Carter,Ofer Yizhar,Sachiko Chikahisa,et al. Tuning arousal with optogenetic modulation of locus coeruleus neurons[J]. Nature Neuroscience,2010,13(12):1526.
[54] Huang Zhi-li,Sato Yo,Takatoshi Mochizuki,et al.Prostaglandin E2 activates the histaminergic system via the EP4 receptor to induce wakefulness in rats[J]. J Neuroscience,2003,23(14):5975-5983.
[55] Lu Jun,Alvhild A Bjorkum,Xu Man,et al. Selective activation of the extended ventrolateral preoptic nucleus during rapid eye movement sleep[J]. J Neuroscience,2002,22(11):4568-4576.
[56] Satvinder Kaur,Adrienne Junek,Michelle A Black,et al.Effects of ibotenate and 192IgG-saporin lesions of the nucleus basalis magnocellularis/substantia innominata on spontaneous sleep and wake states and on recovery sleep after sleep deprivation in rats[J]. J Neuroscience,2008,28(2):491-504.
[57] Barbara E Jones. From waking to sleeping: neuronal and chemical substrates[J]. Trends Pharmacol Sci,2005,26(11):578-586.
[58] Thomas E Scammell,Elda Arrigoni,Jonathan O Lipton.Neural circuitry of wakefulness and sleep[J]. Neuron,2017,93(4):747-765.
[59] Gritti Ivana,Pablo Henny,Galloni F,et al. Stereological estimates of the basal forebrain cell population in the rat,including neurons containing choline acetyltransferase,glutamic acid decarboxylase or phosphate-activated glutaminase and colocalizing vesicular glutamate transporters[J]. Neuroscience,2006,143(4):1051-1064.
[60] Chen Li,Yin Dou,Wang Tian-xiao,et al. Basal forebrain cholinergic neurons primarily contribute to inhibition of electroencephalogram delta activity,rather than inducing behavioral wakefulness in mice[J].Neuropsychopharmacology,2016,41(8):2133.
[61] Han Yong,Shi Yu-feng,Xi Wang,et al. Selective activation of cholinergic basal forebrain neurons induces immediate sleep-wake transitions[J]. Current Biology,2014,24(6):693-698.
[62] Christelle Anaclet,Nigel Paul Pedersen,Loris L Ferrari,et al. Basal forebrain control of wakefulness and cortical rhythms[J]. Nature Communications,2015,6:8744.
[63] Xu Min,Chung Shinjae,Zhang Si-yu,et al. Basal forebrain circuit for sleep-wake control[J]. Nature Neuroscience,2015,18(11):1641.
[64] John D Salamone,Merce Correa. The mysterious motivational functions of mesolimbic dopamine[J].Neuron,2012,76(3):470-485.
[65] Sun Huan-xin,Wang Dian-ru,Ye Chen-bo,et al. Activation of the ventral tegmental area increased wakefulness in mice[J]. Sleep and Biological Rhythms,2017,15(2):107-115.
[66] Ada Eban-Rothschild,Gideon Rothschild,William J Giardino,et al. VTA dopaminergic neurons regulate ethologically relevant sleep-wake behaviors[J]. Nature Neuroscience,2016,19(10):1356.
[67] El Mansari M,Sakai K,Jouvet M. Unitary characteristics of presumptive cholinergic tegmental neurons during the sleep-waking cycle in freely moving cats[J].Experimental Brain Research,1989,76(3):519-529.
[68] Christa J Van Dort,Daniel P Zachs,Jonathan D Kenny,et al. Optogenetic activation of cholinergic neurons in the PPT or LDT induces REM sleep[J]. Proceedings of the National Academy of Sciences,2015,112(2):584-589.
[69] Soufiane Boucetta,Youssouf Cissé,Lynda Mainville,et al. Discharge profiles across the sleep-waking cycle of identified cholinergic,GABAergic,and glutamatergic neurons in the pontomesencephalic tegmentum of the rat[J]. J Neuroscience 2014,34(13):4708-4727.
[70] Daniel Kroeger,Loris L Ferrari,Gaetan Petit,et al.Cholinergic,glutamatergic,and GABAergic neurons of the pedunculopontine tegmental nucleus have distinct effects on sleep/wake behavior in mice[J]. J Neuroscience,2017,37(5):1352-1366.
[71] Sherin J E,Priyattam J Shiromani,R W McCarley,et al.Activation of ventrolateral preoptic neurons during sleep[J]. Science,1996,271(5246):216-219.
[72] Dmitry Gerashchenko,Matthew D Kohls,MaryAnn Greco,et al. Hypocretin-2-saporin lesions of the lateral hypothalamus produce narcoleptic-like sleep behavior in the rat[J]. Journal of Neuroscience 2001,21(18):7273-7283.
[73] Anne Venner,Christelle Anaclet,Rebecca Y Broadhurst,et al. A novel population of wake-promoting GABAergic neurons in the ventral lateral hypothalamus[J]. Current Biology,2016,26(16):2137-2143.
[74] Maya Lebow,Chen A. Overshadowed by the amygdala:the bed nucleus of the stria terminalis emerges as key to psychiatric disorders[J]. Molecular Psychiatry,2016,21(4):450.
[75] Shota Kodani,Shingo Soya,Takeshi Sakurai. Excitation of GABAergic neurons in the bed nucleus of the stria terminalis triggers immediate transition from non-rapid eye movement sleep to wakefulness in mice[J]. J Neurosci,2017,37(30):7164-7176.

