接种量和通气量对生物反应器中金线莲丛生芽生长和酚及黄酮积累的影响
高 原, 金美玉, 廉美兰, 朴炫春
(延边大学农学院,吉林 延吉 133002)
金线莲(Anoectochilusroxburghii)为兰科开唇植物,属多年生珍稀中药材,具有很高的药用价值和经济价值[1]。研究表明,金线莲含有黄酮、酚、多糖、生物碱、强心苷等成分[2]。金线莲全草皆可入药,其味甘性平微寒,具有清热解毒的功效。并且它还是一种珍稀药材,目前在临床上广泛地应用于肺炎、肝炎、糖尿病、高血压和风湿病等[3]。其中,黄酮类化合物是天然的抗氧化剂,除了有抗菌、消炎、护肝、利尿等作用外,在抗氧化、抗癌、防癌、抑制脂肪酶、预防心血管疾病等方面也有显著效果[4-6]。酚类物质是体内具有较强生理学效应的内源性活性物质,除了具有抗氧化、抗诱变和抗衰老等作用外,还有潜在的降血糖活性[7-8]。金线莲又有“药王”、“乌人参”等美称[9]。我国福建、广东、广西、台湾、四川、贵州、云南均有野生金线莲[10]。其株型小巧美观,叶型优美,叶脉金黄色呈网状排列,也是观赏价值极高的室内观叶珍品。因此,金钱莲具有广阔的开发利用前景[11]。但是自然条件下金线莲种子的萌发率极低。由于市场需求量大,毁灭性的开采已造成金线莲野生资源的枯竭。而人工栽培因环境制约、生长缓慢、管理不便等原因,其产量难以满足市场需求[12]。目前植物细胞或器官培养被认为是一种可替代植物材料传统生产的有效途径,结合生物反应器的应用,可实现短期内大量生产代谢产物的目的。目前,金线莲组培研究很广泛[13],主要目的是生产种苗用于田间栽培,但通过丛生芽培养生产代谢产物的研究很少见。因此,本研究利用生物反应器研究了接种量和通气量对金线莲丛生芽培养的影响,旨在通过丛生芽培养生产酚和黄酮,为今后金线莲产品生产提供参考依据。
1 材料与方法
1.1 材料
参照刘冠甫等[14]的方法诱导出金线莲丛生芽。取诱导的丛生芽在MS+6-苄氨基嘌呤(BA)3.0 mg/L+激动素(KT)0.3 mg/L+萘乙酸(NAA)0.3 mg/L+蔗糖30 g/L+琼脂7 g/L(pH值5.8)的培养基上增殖培养,并每隔30 d进行1次继代。将增殖的丛生芽切成0.5 cm左右的单芽作为本研究的试验材料。
1.2 方法
1.2.1 接种量对金线莲丛生芽生长和黄酮及酚积累的影响
选用3 L球型生物反应器,在生物反应器球体下部设支持网。将10.0、12.5和15.0 g/L外植体分别接入反应器中。每个生物反应器加入2 L培养基,培养基为3/4 MS+BA 2.0 mg/L+NAA 0.5 mg/L+KT 0.2 mg/L+蔗糖35 g/L,pH值5.8。生物反应器中通入400 mL/min混合气体,在温度(25±2) ℃,湿度70 %,光照强度1 600 lx,每天光照16 h的条件下培养。培养30 d后,调查丛生芽鲜物重并计算出增殖系数,测定丛生芽中总酚和总黄酮含量,并计算生产量。
增殖系数= [鲜物重/g- 接种量/g]/接种量/g
物质生产量/(g/L)=物质含量/(mg/g)×干物重/(g/L)
1.2.2 通气量对金线莲丛生芽生长和黄酮及酚积累的影响
在3 L生物反应器中,加入2 L培养基(3/4 MS+BA 2.0 mg/L+NAA 0.5 mg/L+KT 0.2 mg/L+蔗糖35 g/L),培养pH值调节为5.8。每个生物反应器接种12.5 g/L外植体。将通气量设为200、300、400、500和600 mL/min。培养30 d后,调查丛生芽鲜物重,测定丛生芽中总酚和总黄酮含量,并计算生产量。其他条件同试验1.2.1。
1.3 测定方法
1.3.1 总酚含量的测定
参照Folin和Ciocallteu的方法测定总酚含量[15]。为测定丛生芽样品中的总酚含量,称取样品丛生芽的干燥粉末100 mg,加入80 %甲醇15 mL,80 ℃煮2 h,冷却后导入离心管中,4 ℃,5 000 r/min离心15 min,抽取上层液定容至25 mL。利用紫外分光光度计,在波长760 nm下测定吸光值。
1.3.2 总黄酮含量的测定
黄酮的提取及其含量的测定采用硝酸铝比色法[16]。称取0.1 g磨碎的丛生芽干品放于50 mL三角瓶中,加入70%乙醇10 mL,在60 ℃下水浴2 h。冷却后,在4 ℃,转速5 000 r/min条件下离心15 min,取上清并定容至25 mL。用紫外分光光度计,在波长510 nm下,测定吸光值。
1.4 数据分析
试验为完全随机设计。用Excel进行分析,数据为3次重复的平均值±标准误差;利用SAS 6.12软件进行分析,采用邓肯氏新复极差法在显著水平为0.05上进行比较。
2 结果与分析
2.1 接种量对金线莲丛生芽生长和黄酮及酚积累的影响
接种量对金线莲丛生芽生长和有效物质的积累有显著影响(图1)。随着接种量的增加,丛生芽鲜物量增加,在15.0 g/L接种量处理中达到180.0 g,但增殖系数则下降(表1)。然而对有效物质含量进行测定的结果,发现接种量为12.5 g/L时,总酚含量明显高于其他接种量,为6.03 mg/L,并得到最多的生产量,为62.74 mg/L(图2A)。而黄酮的含量和生产量在12.5和15.0 g/L接种处理高于10.0 g/L接种处理,但两者间无显著性差异(图2B)。因此,以接种量12.5 g/L作为生物反应器培养金线莲丛生芽的初始接种量较为适宜。

图1 接种量对金线莲丛生芽生长的影响

接种量/(g/L)鲜物重/g增殖系数10.0144.7±1.6 c13.712.5156.6±1.8 b11.515.0180.0±2.8 a11.0
注:数值为平均值±标准偏差(n=3)。不同字母表示0.05水平上差异显著。下同。
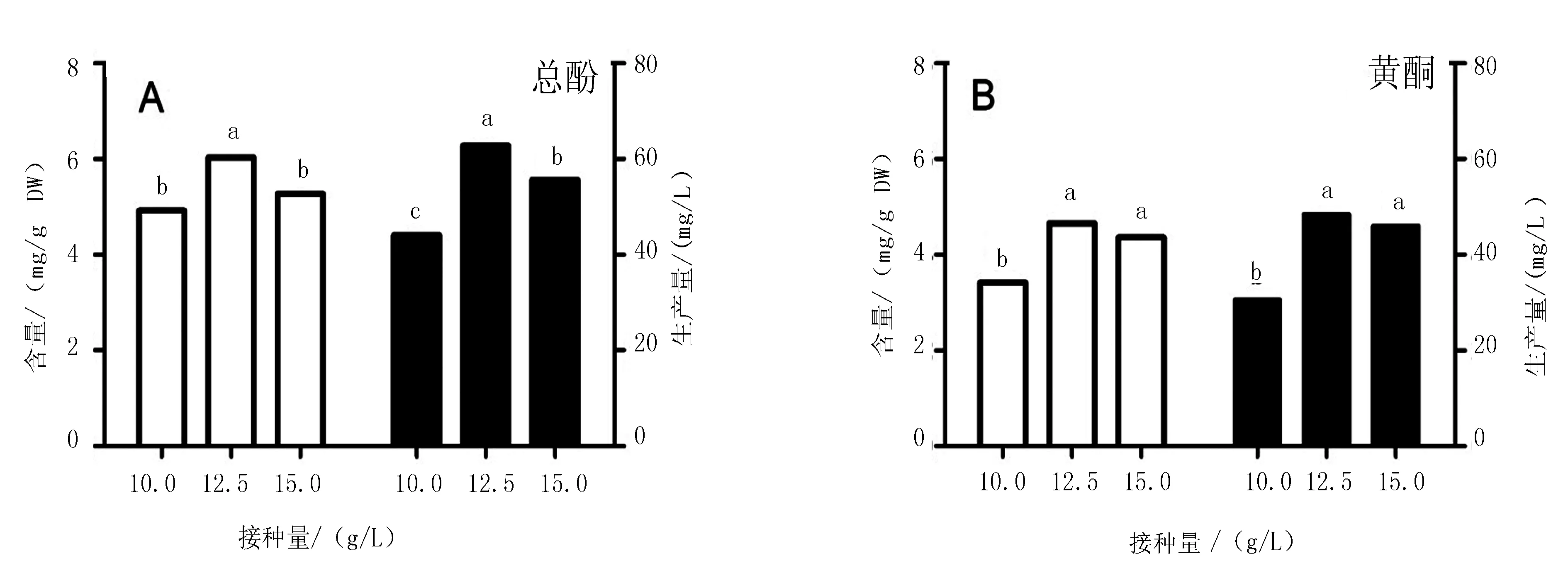
图2 接种量对金线莲丛生芽有效物质积累的影响。
2.2 通气量对金线莲丛生芽生长和黄酮及酚积累的影响
在反应器培养过程中,适宜的通气量对植物自身生长发育以及物质代谢有积极的作用。由表2和图3可知,通气量为400 mL/min时,丛生芽鲜物重(158.30 g)明显高于其他通气量处理,增殖系数也在此通气量下出现最高值。
通气量对不同物质合成的影响不同。总酚含量在500和600 mL/min处理时达到最大值,2种通气量处理间无显著性差异,但酚生产量在500 mL/min通气量处理好于600 mL/min,达到68.64 mg/L(图4 A)。通气量对黄酮含量无明显影响,黄酮生产量在400~500 mL/min时,3种通气量处理间无明显差异,但显著高于200和300 mL/min通气量处理(图4 B)。因此,为了生产酚和黄酮,可选定500 mL/min通气量来进行金线莲丛生芽反应器培养。
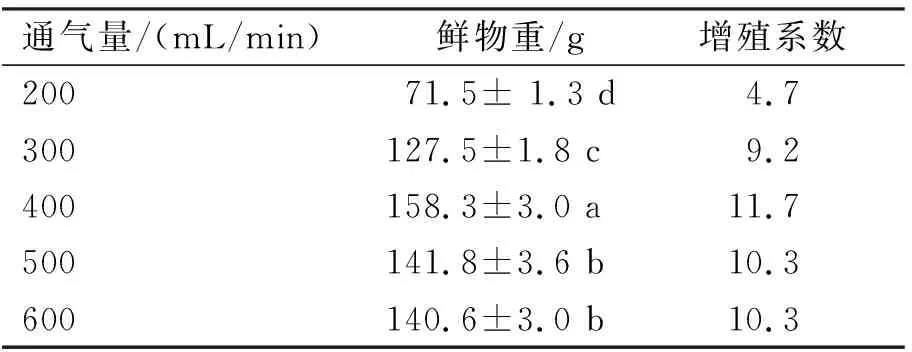
表2 通气量对金线莲丛生芽生物量的影响

图3 通气量对金线莲丛生芽生长的影响
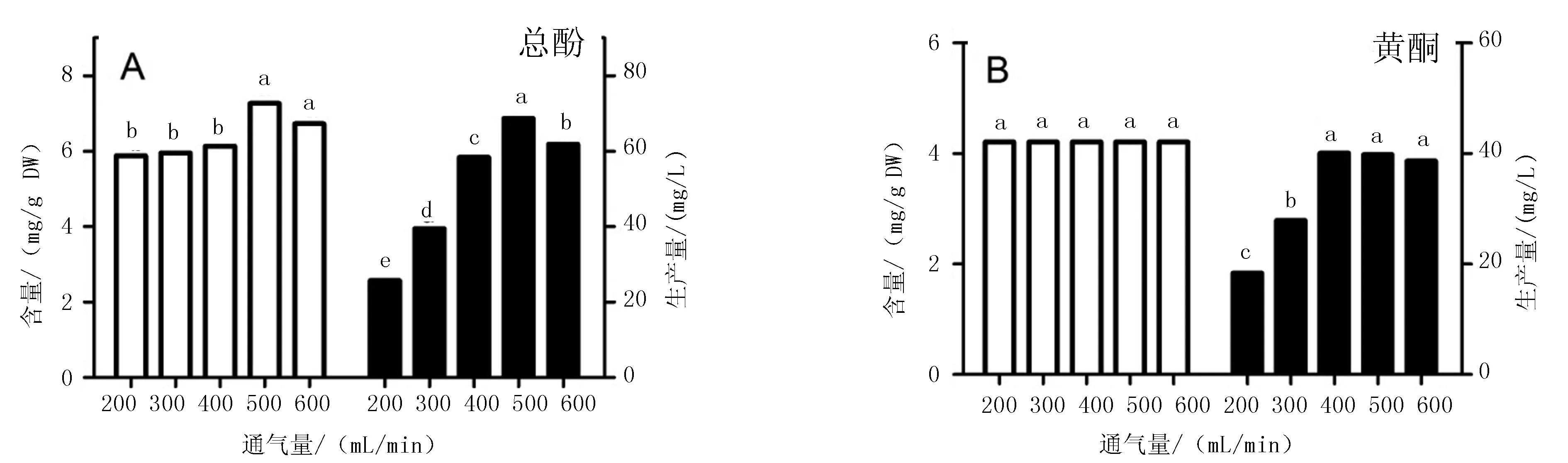
图4 通气量对金线莲丛生芽有效物质积累的影响
3 讨论
在利用生物反应器进行植物细胞或器官培养过程中,接种密度起重要作用。接种密度过高会限制营养成分和氧气的利用率,加快培养物达到生长极限,影响其正常生长;而接种密度过低,浪费培养空间和成本,并延长培养时间,不利于培养物的正常生长[17-18]。适宜接种量在不同植物种和不同外植体间不同。因此,许多研究通过探明接种量影响以确定最佳接种量,达到最佳的培养效果。李旭[19]发现,在5 L反应器内培养大花蕙兰圆球茎时,接种量为20 g的处理圆球茎鲜重显著优于10和30 g的接种量处理。李铁军等[20]利用生物反应器对驾斯越橘丛生苗进行增殖培养,发现当反应器中接入60个芽时,收获的总苗数最多,好于每个反应器中接入45和75个芽的处理。在该试验中,在对金线莲丛生芽进行生物反应器培养时,接种量对金线莲丛生芽生长和酚及黄酮积累也有很大影响,在接种量为12.5 g/L时,总酚和黄酮含量高于其他接种量,并得到最多的生产量,适宜于丛生芽培养。
除了适宜接种量的选择,对生物反应器培养过程中通气量的调节也显得非常重要。反应器的通气量也是影响植物生长和有效物质积累的重要因素之一,注入气体中的氧气可为植物正常的代谢活动提供溶解氧,同时起到搅拌的作用,促使培养物和培养基充分的混合,以利于培养物对养分的充分吸收[21]。通气量过高将导致氧毒性,同时也会加大剪切力,产生气泡,这对细胞或器官的生长有不利的影响[22]。通气量过低使溶氧不足及不能够充分进行料液混合。不同反应器培养体系对通气量的要求不同,于晓坤[23]研究表明,在贯叶连翘不定根反应器培养中,最大生物量出现在通气量为75 mL/min的处理中,但金丝桃素最大积累量在通气量为100 mL/min条件下出现。本试验在对金线莲丛生芽进行培养中发现,当通气量为400 mL/min时,丛生芽生长良好,总酚和黄酮生产量在通气量为500 mL/min时达到最大值,且显著优于杨帆[24]研究发现的不同激素浓度生物反应器培养金线莲的黄酮生产量12.2 mg/L。因此,进行金线莲丛生芽培养时可将通气量调节为500 mL/min。
4 结论
在利用生物反应器进行金线莲丛生芽培养时,将接种量设置为12.5 g/L而通气量则调节为500 mL/min时,有利于丛生芽生长及酚和黄酮的生产。反应器培养的丛生芽可作为一种新的原材料用于金线莲相关产品生产中。
参考文献:
[1] 沈廷明,吴仲玉,黄春情,等.金线莲化学成分、药理、组培及栽培研究进展[J].海峡药学,2016,28(12):26-30.
[2] 朱美瑛.金线莲种质资源评价及组培快繁体系研究[D].南京:南京农业大学,2014.
[3] 吴萍萍.金线莲活性物质分析及药材质量评价[D].福州:福建医科大学,2013.
[4] 谢远红,谢乐芳.竹叶黄酮的超声波提取及稳定性研究[J].内蒙古民族大学学报(自然科学版),2017,32(4):302-307.
[5] 李执坤,陈虹竹,冯艳钰,等.5种芽苗菜黄酮提取物的体外抗氧化活性研究[J].黑龙江八一农垦大学学报,2017,29(2):48-51.
[6] 孙天宇,杨宏志.超声波法提取沙棘叶总黄酮最佳工艺的研究[J].黑龙江八一农垦大学学报,2012,24(3):45-50.
[7] 龙梅.儿茶酚胺类物质的分离分析方法研究进展[J].赤峰学院学报(自然科学版),2011,21(3):1-3.
[8] 马萍,郭希娟,李思荻.响应面法优化红小豆中总酚的提取[J].黑龙江八一农垦大学学报,2011,23(5):64-68.
[9] 吴东凡,丁莹,金樱叶.多糖的提取及其含量测定[J].河南化工,2010,27(2):58-59.
[10] 王建明,王松良,詹巧杰,等.金线莲组织培养的条件优化研究[J].中国现代中药,2013,15(1):45-49.
[11] 杨红丽,胡靖峰,徐学忠,等.金线莲的组织培养与快速繁殖研究[J].西南农业学报,2013,26(6):2485-2488.
[12] 范子南,肖华山,范晓红,等.金线莲的组织培养研究[J].福建师范大学学报,1997,13(2):82-87.
[13] 刘伟,王牛柱.金线莲组织培养增殖培养基的筛选[J].安徽农业科学,2009,37(4):1475-1476.
[14] 刘冠甫,金善玉,李贺,等.悬浮培养福建金线莲丛生芽中酚及黄酮积累影响因素研究[J].延边大学农学学报,2017,39(2):23-27.
[15] Folin O,Ciocalteu V.On tyrosine and tryptophane determination in proteins[J].J Biol Chem,1927,73:627-650.
[16] 吴荣志,徐莲英,陶建生.银杏叶总黄酮提取工艺探讨[J].中成药研究,1987(10):13-14.
[17] Lee C W,Shuler M L.The effct of inoculum density and conditioned medium on the production of ajmalicine and catharanthine from immobilizedCatharanthusroseuscells[J].Biotechnology and Bioengineering,2000,67(1):61-71.
[18] Huang S Y,Hung C H,Chou S N.Innovative strategies for operation of mist trickling reactors for enhanced hairy root proliferation and secondary metabolite productivity[J].Enzyme and Microbial Technology,2004,35(1):22-32.
[19] 李旭.利用生物反应器大量生产大花蕙兰圆球茎及再生体系的建立[D].延吉:延边大学,2010.
[20] 李铁军,朴炫春,廉家盛,等.利用生物反应器接触培养法增殖笃斯越橘丛生苗[J].林业科学,2012,48(11):130-133.
[21] Ahmed S,Hahn E J,Paek K Y.Aeration volume anf photosynynthetic photon fiux affect cell growth and secondary metabolite content in bioreactor cultures of Morinda citrifolia[J].Journal of Plant Biology,2008,51(3):209-212.
[22] Baque M A,Moh S H,Lee E J,et al.Production of biomass and useful compounds from adventitious roots of high-value added medicinal plants using bioreactor[J].Biotechnology Advances,2012,30(6):1255-1267.
[23] 于晓坤.贯叶连翘不定根反应器培养及金丝桃素积累的研究[D].延吉:延边大学,2013.
[24] 杨帆.金线莲丛生芽培养及有效物质生产研究[J].中草药,2016,47(18):3284-3288.

