大豆籽粒硬实加性和上位性QTL定位
艾丽娟 陈 强 杨春燕 闫 龙 王凤敏 葛荣朝张孟臣,*
大豆籽粒硬实加性和上位性QTL定位
艾丽娟1,2,**陈 强2,**杨春燕2闫 龙2王凤敏2葛荣朝1,*张孟臣2,*
1河北师范大学生命科学学院, 河北石家庄 050024;2河北省农林科学院粮油作物研究所/ 国家大豆改良中心石家庄分中心/ 农业部黄淮海大豆生物学与遗传育种重点实验室/ 河北省遗传育种重点实验室, 河北石家庄 050035
硬实是植物种子的普遍特性, 是影响大豆种子发芽率、生存能力及储存期的重要数量性状, 同时影响着大豆的加工品质。本实验通过对大豆籽粒硬实性状的加性和上位性互作QTL (quantitative trait locus)分析, 明确控制大豆籽粒硬实的重要位点及效应, 旨在为进一步解析硬实性状复杂的遗传机制提供理论依据。以冀豆12和地方品种黑豆(ZDD03651)杂交构建的包含186个家系的F6:8和F6:9重组自交系群体为材料, 采用WinQTL Cartographer V. 2.5的复合区间作图法(composite interval mapping, CIM)定位不同年份的籽粒硬实性状相关的加性QTL, 同时采用IciMapping 4.1软件中的完备区间作图法(inclusive composite interval mapping, ICIM)检测籽粒硬实性状的加性及上位性QTL。共检测到3个籽粒硬实性状相关的加性QTL, 分别位于第2、第6和第14染色体, 遗传贡献率范围为5.54%~12.94%。同时检测到4对上位性互作QTL, 分别位于第2、第6、第9、第12和第14染色体, 可解释的表型变异率为2.53%~3.47%。同时检测到籽粒硬实性状加性及上位性互作QTL, 且上位性互作多发生在主效QTL间或主效QTL与非主效QTL间, 表明上位性互作效应在大豆籽粒硬实性状的遗传基础中具有重要的作用。
大豆; 硬实; QTL; 上位性互作
硬实是种子休眠类型之一, 普遍存在于豆科作物中[1]。硬实主要是由于种皮的不渗透性吸水导致, 而种皮迅速均匀的渗透性吸水是许多豆科作物驯化的关键特征之一[2-5]。在农业生产中, 硬实严重影响种子的发芽率和出苗率[6-7]; 在大豆食品加工过程中, 硬实对大豆食品的感观品质及碾磨品质产生影响[8-9]; 在品种改良中, 硬实严重阻碍种质资源的利用。硬实对种子的休眠萌发和延长种子寿命起着重要作用, 因此有利于种质保存[1]; 硬实也被认为是野生物种长期生存所需的重要特性[10-11]。此外, 硬实种子与种皮中的钙含量相关[12-13], 可以潜在增强大豆食品的营养价值。目前, 关于种子硬实遗传控制的信息较少, 因此有必要对大豆籽粒硬实特性的遗传机制进一步解析。硬实特性是受多基因控制的复杂数量性状[1], 通过QTL (quantitative trait locus)定位分析, 检测与种子硬实相关的QTL, 对解析硬实形成相关分子机制及分子标记辅助选择(marker-assisted selection, MAS)育种具有重要的指导意义。
前人利用经典遗传学方法研究硬实性状, 发现大豆籽粒硬实性状受少数基因控制, 但在显隐性关系和基因数目上具有争议[14-16]。近年来, 随着分子标记技术的快速发展, 国内外学者对大豆籽粒硬实性状QTL定位分析发现, 籽粒硬实QTL主要分布在第2、第3、第6、第8、第10、第19和第20等[9,17-18]连锁群上。Sun等[19]在第2染色体上定位到控制野生大豆籽粒种皮渗透性的QTL (), 通过精细定位及基因功能分析发现, 在编码钙调磷酸跨膜蛋白与种皮钙含量有关的基因上的点突变导致了硬实, 而在该基因附近, Jang等[20]通过精细定位、基因表达和测序分析发现,同样可导致籽粒硬实, 它编码内切- 1,4-b-葡聚糖酶可在栅栏细胞的外层上产生1,4-b-葡聚糖衍生物使得种皮更硬, 导致大豆种皮不渗透性吸水从而产生硬实。随着研究的深入, QTL间的上位性互作逐渐受到重视, 前人相继研究证明上位性效应在复杂数量性状的遗传中起着重要的作用[21]。上位性效应的机制分析和作用效果对于品种改良至关重要, 2017年Soyk等[22]在番茄研究中发现, 负向的上位性效应会阻碍优势性状的表现, 该研究利用基因编辑手段控制负向上位性效应, 从而培育出高产番茄品种。与进化和自然选择相比, 强烈的人工选择可能会推动更频繁的上位性发生, 上位性效应普遍存在。前人研究大豆籽粒硬实性状多分析加性效应影响, 虽已有籽粒硬实相关基因报道, 对上位性效应检测研究涉及较少, 仅Liu等[23]通过双因素方差分析检测到位于第2和第6染色体上的籽粒硬实QTL间存在上位性互作效应, 但上位效应值尚不明确, 因此解析QTL之间的上位性互作并估算其效应, 明确现有QTL间的上位性互作关系及效应, 发掘上位性互作QTL新位点可为进一步解析大豆籽粒硬实遗传基础及辅助育种提供依据。
本研究利用高世代重组自交系群体及WinQTL Cartographer V. 2.5和IciMapping 4.1软件对不同年份的大豆籽粒硬实性状进行加性检测。并使用IciMapping 4.1软件对籽粒硬实性状进行上位性QTL分析, 探明加性和上位性互作效应对籽粒硬实性状的影响, 为QTL的精细定位及基因克隆奠定基础, 为分子标记辅助育种提供依据。
1 材料与方法
1.1 供试材料
以育成品种冀豆12和农家种黑豆(ZDD03651)杂交通过单粒传法构建的包含186个家系的F6:8和F6:9重组自交系为材料。其中冀豆12是河北省农林科学院粮油作物研究所育成的百粒重为22 g的大粒品种, 黑豆(ZDD03651)为百粒重7 g的小粒农家种。将该群体F6:8(2011年)和F6:9(2013年)重组自交系及其亲本播种于石家庄田间, 采用3 m行长, 3行区, 随机区组实验设计, 行距0.5 m, 株距0.1 m。分别从自然成熟的亲本和重组自交系群体每个株系随机收获10株, 研究其籽粒。
1.2 实验方法
分别从亲本和重组自交系每个株系中随机选取60粒正常籽粒, 设每份材料3个重复, 将20粒籽粒浸泡在盛有20 mL蒸馏水的培养皿中, 于室温下浸泡7 d。每天统计籽粒硬实数, 硬实率=Y/20× 100%, 其中Y为籽粒硬实数。
1.3 数据分析
采用SPSS 17.0软件完成籽粒硬实性状的均值、偏度、峰度及正态分布检验等分析。
1.4 QTL定位
本研究所用分子遗传连锁图谱由本实验室前人[24-25]构建完成, 包含SSR标记154个, 总长度为1516.1 cM, 标记间的平均遗传距离为9.3 cM。采用Windows QTL Cartographer 2.5软件中的复合区间作图法(CIM)检测不同年份下大豆籽粒硬实性状相关的主效QTL; 以IciMapping 4.1软件中的完备区间作图法(ICIM)进行籽粒硬实性状的加性及上位性QTL定位分析。显著主效QTL的LOD阈值为2.5, 显著上位性QTL的LOD阈值为5.0。采取McCouch等[26]的方式命名QTL。
2 结果与分析
2.1 籽粒硬实测定的种子浸泡时间
浸泡1 d后群体籽粒大部分表现为非硬实状态, 随着浸泡天数的增加, 硬实率的变化差异不显著(<0.05)。不同年份的RIL (recombinant inbred lines)群体籽粒硬实率平均值随浸泡天数的变化略有差异, 但总体趋势基本一致(图1)。因此以浸泡1 d后群体的籽粒硬实率进行后续分析及QTL定位。
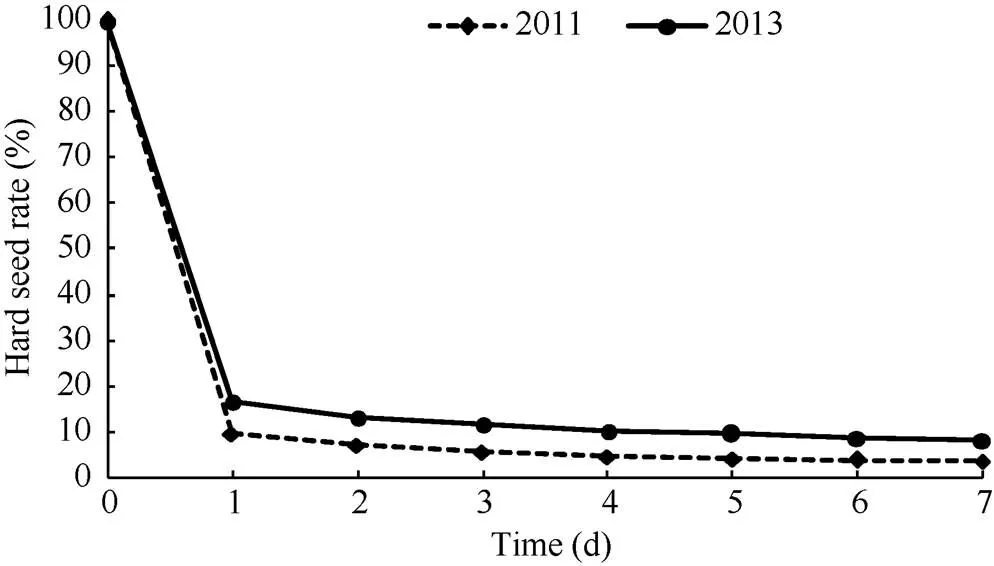
图1 籽粒硬实率变化情况
2.2 表型数据分析
由表1可知, 浸泡1 d后, 亲本冀豆12的硬实率为0, 黑豆的硬实率在71.65%~83.33%左右, 两亲本间籽粒硬实率存在明显差异, 为QTL定位分析提供了较好的遗传背景。RIL群体各家系籽粒硬实率的分离程度较大, 变异范围为0~96.67%, 变异系数介于56%~75%之间, 且RIL群体的籽粒硬实性状存在超高亲分离。由其频率分布图可知籽粒硬实性状的表型值呈连续性变异(图2)。
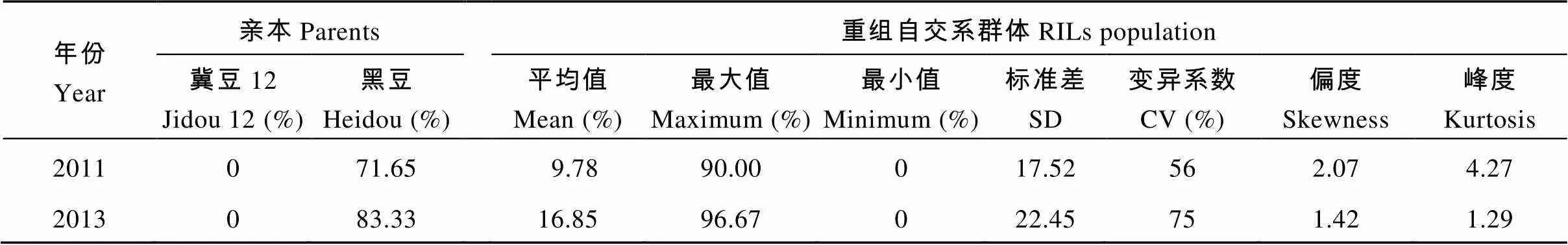
表1 不同环境下大豆亲本及RIL群体的籽粒硬实率的表型值
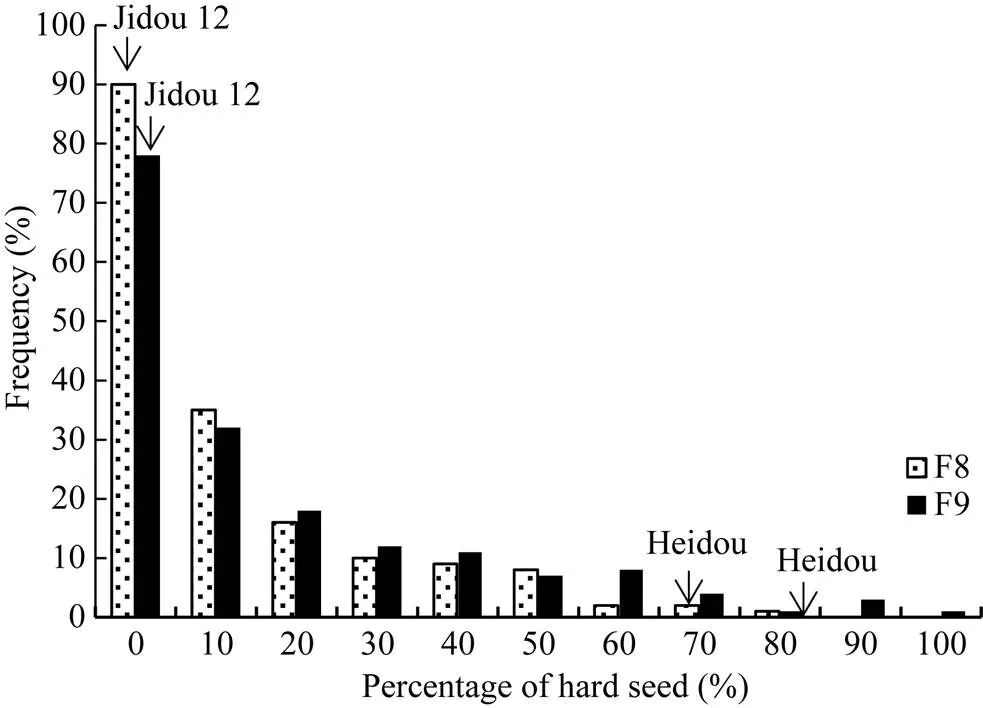
图2 大豆籽粒硬实性状频率分布图
2.3 籽粒硬实加性QTL分析
由表2可知, 两年中共检测到3个籽粒硬实性状相关的加性QTL, 分别位于第2 (D1b)、第6 (C2)和第14 (B2)染色体, 可解释的表型变异率在5.54%~ 12.94%之间。其中位于第2染色体的Sat_069– Sat_183标记之间的和位于第6染色体的Sat_402–Satt460标记之间的用两种方法均能被检测到, 且和在CIM法中两年环境下均能被检测到, 为稳定的QTL位点, 贡献率最大, 分别为6.82%和12.94%, 加性效应最大, 分别为5.16和7.92, 增效基因来自黑豆。用两种方法均仅在2013年检测到, 贡献率分别为8.25%和9.39%, 加性效应分别为-6.26和-7.47, 位于第14染色体的Satt577–Sat_287标记之间, 其增效基因来源于冀豆12。
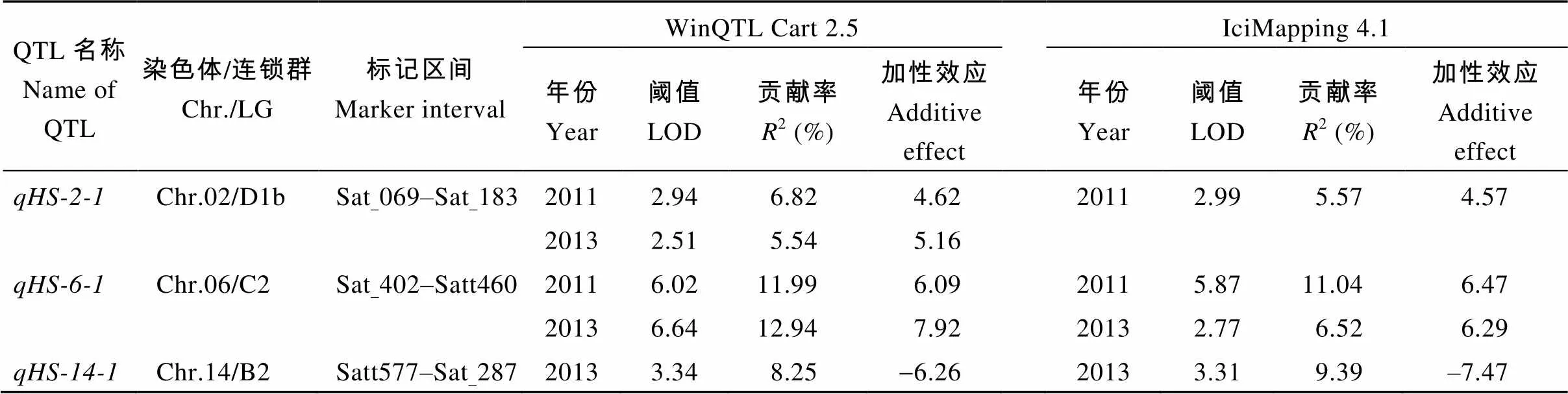
表2 用不同方法检测到的不同环境下大豆籽粒硬实加性QTL
2.4 籽粒硬实上位性QTL分析
对于两年环境下的大豆籽粒硬实性状共检测到4对上位性互作QTL (表3和图3)。上位性效应值在-10.08~11.64之间, 贡献率在2.53%~3.47%之间。其中第6染色体上的和第2染色体上的、第9染色体上的以及第12染色体上的均存在上位性互作。和之间的互作仅在2011年中被检测到, 贡献率为2.69%, 上位性效应为8.66, 为亲本型大于重组型互作。和以及间的互作在两年中均能被检测到, 贡献率最大, 分别为3.36%和3.47%, 上位性效应最大, 分别为11.64和-8.15。另外, 第14染色体上和第12染色体上的也存在上位性互作, 仅在2013年被检测到, 贡献率为3.13%, 上位性效应为10.10, 表现为亲本型大于重组型。
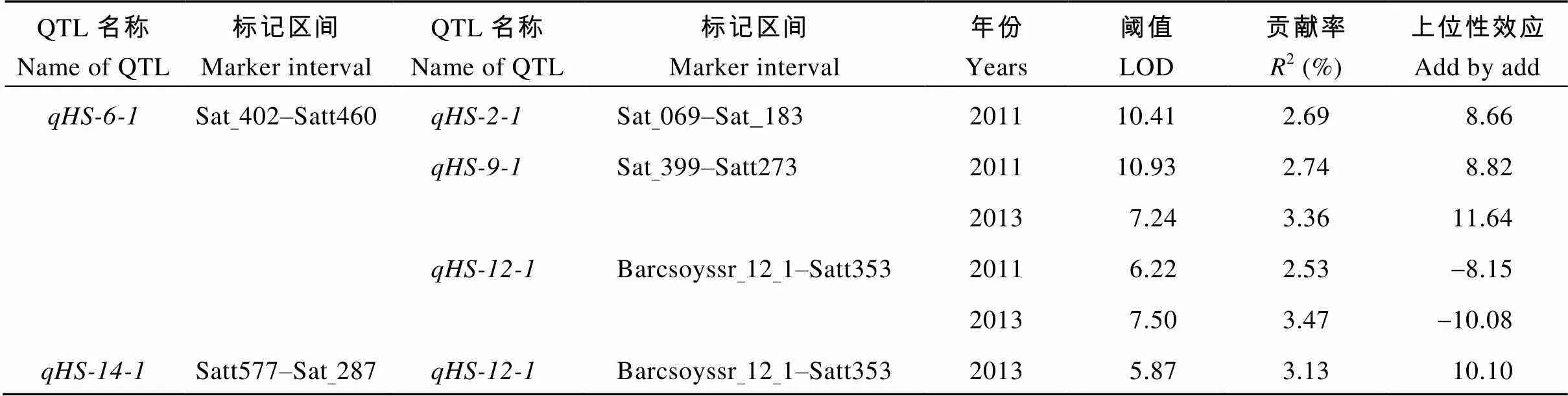
表3 不同环境下大豆籽粒硬实性状的上位性效应
3 讨论
3.1 与前人QTL定位结果的比较
本研究检测到籽粒硬实性状相关的加性QTL 3个, 分别位于第2、第6和第14染色体。与QTL和与前人所报道标记区间相同或相近, 这两个位点在前人研究中多次被检测到, 且在本研究中的不同年份间稳定表达, 表明和为籽粒硬实的稳定主效QTL。Liu等[23]研究中检测到第2染色体上的硬实相关QTL位于标记Satt456附近, 与本研究得到的位点的标记区间(Sat_096–Sat_183)区域相近, 且Jang等[20]和Sun等[19]分别在该区域附近发现与大豆种皮渗透性相关的基因, 分别为和。本研究所检测到的位于第6染色体的Sat_402–Satt460标记区间, 与Watanabe等[17]检测到的籽粒硬实QTL区间Satt489–Satt100部分重叠。本研究所检测到的位于第14染色体的Satt577–Sat_287标记区间, 前人研究中均没检测到该位点, 因只在一年中检测到, 该位点是否为新位点需进行进一步的研究。此外, Keim等[18]和Watanabe等[17]在第3、第8、第19和第20染色体上也检测到籽粒硬实相关的加性QTL, 而在本研究与Liu等[23]研究中均没检测到, 可能是由于定位群体遗传背景或环境差异造成。
QTL间的上位性互作是数量性状遗传基础的重要组成部分, 上位性互作对解析复杂性状的遗传基础具有十分重要的意义[27-30]。本研究检测到4对籽粒硬实性状相关的上位性互作QTL, 其中位于第6染色体上的分别与第2染色体上的, 第9染色体上的及第12染色体上的间均存在上位性互作。与间的互作发生在加性QTL间, Liu等[23]同样检测到位于第2和第6染色体上控制籽粒硬实性状相关的加性QTL间发生互作。与及间的互作发生在加性效应QTL与非加性效应QTL之间, 且在不同年份间均被检测到。另外,还与存在上位性互作。说明除加性QTL起作用外, QTL之间的上位性互作也是影响性状的重要因素。
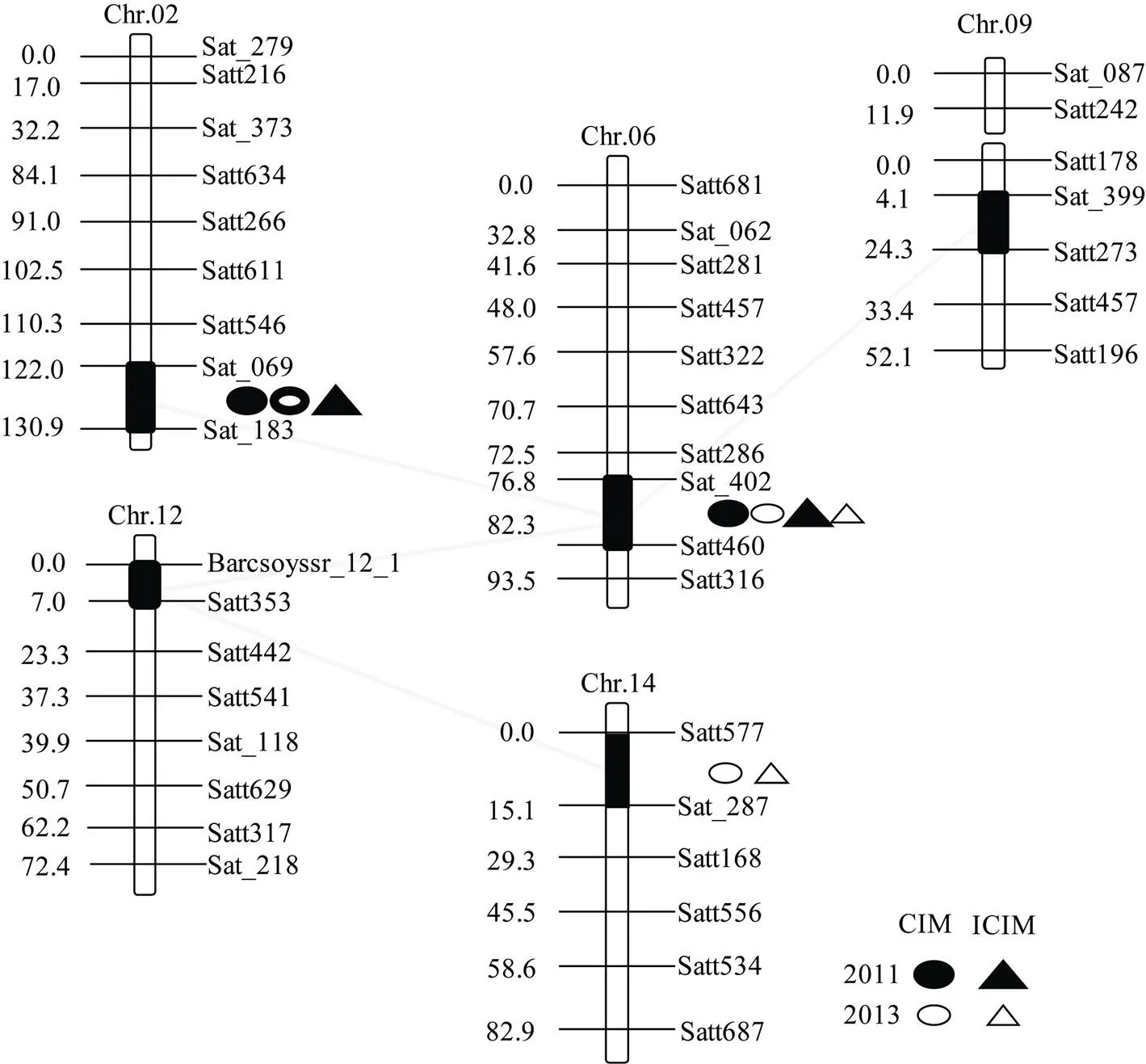
图3 检测到的加性QTL及上位性互作QTL在连锁群上的分布
黑色区段为QTL所在区域, 虚线代表上位性互作QTL位点。
The black bars show the support interval of QTL position, the dotted line represents epistatic QTLs.
3.2 籽粒硬实上位性互作的遗传机制
在遗传学领域, 上位性效应(epistasis)是指某基因的表达受到另一非等位基因的作用, 这种非等位基因间的抑制或遮掩作用叫上位效应。在不同的生物体中各种各样的上位相互作用的分子机制被研究发现[31]。最近Cho等[32]研究表明, 控制大豆种皮色的位点和位点间的互作主要是由于位点的功能基因编码Argonaute类蛋白, 该蛋白可以结合到小RNA上, 进而通过剪切mRNA、抑制翻译、促进DNA甲基化等各种形式实现RNAi干扰的效果, 影响了小RNA的分布从而调节位点的基因的表达, 最终控制大豆种皮颜色的调控过程。因此, 小RNA在QTL间的上位性互作中起着非常重要的作用。另外QTL间的上位性互作可能与基因的调控网络有关, 即QTL间主要是通过基因间的正向诱导表达或负向反馈抑制的调控网络来实现上位性互作[33]。本研究检测到4对上位性互作QTL, 其中第2染色体上的和第6染色体上的间存在上位性互作, 且第2染色体上已报道了2个与大豆种皮渗透性相关的基因, 分别为和。若上位性互作QTL的遗传机制可能与上述遗传机制相一致, 即与和两个基因的表达有关。因此可以这2个已报道的基因为出发点, 寻找与其表达过程中相关的酶或调控因子, 进而确定第6染色体上QTL位点区域内与其互作的基因位点。同样另外3对上位性互作位点也可通过以上方法进一步研究, 从而确定互作的基因。因此我们可以将基因的表达及调控网络作为解析籽粒硬实遗传机制的突破口, 研究这4对互作QTL之间的遗传机制, 探究籽粒硬实形成机制, 挖掘出与籽粒硬实相关的基因。
4 结论
首次报道了籽粒硬实相关的4对上位性互作QTL。确定了加性效应及QTL间的上位性互作效应在大豆籽粒硬实性状的遗传基础中均具有重要的作用。因此, 在大豆籽粒硬实性状分子标记辅助育种中, 既要考虑具有加性效应的QTL, 也要考虑具有上位性互作的QTL。
[1] 孙星邈, 王政, 李曙光, 孟凡凡, 王曙明, 张井勇. 大豆硬实形成机制与破除技术的研究进展. 大豆科技, 2014, (3): 23–27 Sun X M, Wang Z, Li S G, Meng F F, Wang S M, Zhang J Y. Progress on formation mechanism and breaking methods of hard seed in soybean.,2014, (3): 23–27 (in Chinese with English abstract)
[2] Ladizinsky G. The origin of lentil and its wild genepoo., 1979, 28: 179–187
[3] Abbo S, Shtienberg D, Lichtenzveig J, Lev-Yadun S, Gopher A. The chickpea, summer cropping, and a new model for pulse domestication in the ancient near east.2003, 78: 435
[4] Weeden N F. Genetic changes accompanying the domestication of pisum sativum: is there a common genetic basis to the ‘domestication syndrome’ for legumes?, 2007, 100: 1017–1025
[5] Andargie M, Pasquet R S, Gowda B S, Muluvi G M, Timko M P. Molecular mapping of QTLs for domestication-related traits in cowpea [(L.) Walp.]., 2014, 200: 401–412
[6] Potts H C, Duangpatra J, Hairston W G, Delouche J C. Some influences of hardseededness on soybean seed quality., 1978, 18: 221–224
[7] Meyer C J, Steudle E, Peterson C A. Patterns and kinetics of water uptake by soybean seeds., 2007, 58: 717–732
[8] Mullin W J, Xu W. Study of soybean seed coat components and their relationship to water absorption.2001, 49: 5331–5335
[9] Zhang B, Chen P Y, Chen C Y, Wang D C, Shi A N, Hou A F, Ishibashi T. Quantitative trait loci mapping of seed hardness in soybean., 2008, 48: 1341–1349
[10] Rolston M P. Water impermeable seed dormancy., 1978, 44: 365–396
[11] Foley M E. Seed dormancy: an update on terminology, physiological genetics, and quantitative trait loci regulating germinability., 2017, 49: 305–317
[12] Saio K, Arai K, Watanabe T. Fine structure of soybean seed coat and its changes on cooking., 1973, 18: 197–201
[13] Saio K. Soybeans resistant to water absorption., 1976, 21: 168–173
[14] Ting C L. Genetic studies on the wild and cultivated soybeans., 1946, 38: 381–393
[15] Kilen T C, Hartwig E E. An inheritance study of impermeable seed in soybean.1978, 1: 65–70
[16] Marjushkin V F, Sichkar V I, Michailov V G, Polivoda V G. Inheritance of hard seedness in soybean., 1988, 15: 294–297
[17] Watanabe S, Tajuddin T, Yamanaka N, Hayashi M, Harada K. Analysis of QTLs for reproductive development and seed quality traits in soybean using recombinant inbred lines., 2004, 54: 399–407
[18] Keim P, Diers B W, Shoemaker R C. Genetic analysis of soybean hard seededness with molecular markers., 1990, 79: 465–469
[19] Sun L J, Miao Z Y, Cai C M, Zhang D J, Zhao M X, Wu Y Y, Zhang X L, Swarm S A, Zhou L W, Zhang Z J Y, Nelson R L, Ma J X., encoding a calcineurin-like protein, controls hard-seededness in soybean., 2015, 47: 939
[20] Jang S J, Sato M, Sato K, Jitsuyama Y, Fujino K, Mori H, Takahashi R, Benitez E R, Liu B H, Yamada T, Abe J. A single-nucleotide polymorphism in an endo-1,4-β-glucanase gene controls seed coat permeability in soybean., 2015, 10: e0128527
[21] 雷东阳, 谢放鸣, 徐建龙, 陈立云. 稻米粒形和垩白度的QTL定位和上位性分析. 中国水稻科学, 2008, 22: 255–260 Lei D Y, Xie F M, Xu J L, Chen L Y. QTLs mapping and epistasis analysis for grain shape and chalkiness degree of rice., 2008, 22: 255–260 (in Chinese with English abstract)
[22] Soyk S, Lemmon Z H, Oved M, Fisher J, Liberatore K L, Park S J, Goren A, Jiang K, Ramos A, Van der Knaap E, Van Eck J, Zamir D, Eshed Y, Lippman Z B. Bypassing negative epistasis on yield in tomato imposed by a domestication gene., 2017, 169: 1142–1155
[23] Liu B, Fujita T, Yan Z H, Sakamoto S, Xu D, Abe J. QTL mapping of domestication-related traits in soybean ()., 2007, 100: 1027–1038
[24] 陈强. 大豆籽粒相关性状QTL定位分析. 河北科技师范学院硕士学位论文, 河北秦皇岛, 2014 Chen Q. QTL Mapping for Seed Related Traits in Soybean (L. Merr.). MS Thesis of Hebei Normal University of Science & Technology, Qinhuangdao, Hebei, China, 2014 (in Chinese with English abstract)
[25] 雷雅坤, 闫龙, 杨春燕, 宋晓坤, 张孟臣, 黄占景. 大豆公共遗传图谱C1连锁群SSR标记空白区段的填补. 华北农学报, 2012, 27: 5–10 Lei Y K, Yan L, Yang C Y, Song X K, Zhang M C, Huang Z J. Complete the blank section with SSR markers on linkage group C1 of public genetic map in soybean., 2012, 27: 5–10 (in Chinese with English abstract)
[26] McCouch S R, Chen X L, Panaud O, Temnykh S, Xu Y B, Cho Y G, Huang N, Ishii T, Blair M. Microsatellite marker development, mapping and application in rice genetics and breeding., 1997, 35: 89–99
[27] 牛远, 谢芳腾, 布素红, 谢尚潜, 韩世凤, 耿青春, 刘兵, 章元明. 大豆粒形性状QTL的精细定位. 作物学报, 2013, 39: 609–616 Niu Y, Xie F T, Bu S H, Xie S Q, Han S F, Geng Q C, Liu B, Zhang Y M. Fine mapping of quantitative trait loci for seed shape traits in soybean., 2013, 39: 609–616 (in Chinese with English abstract)
[28] Hagiwara W E, Onishi K, Takamure O I, Sano Y. Transgressive segregation due to linked QTLs for grain characteristics of rice., 2006, 150: 27–35
[29] Zhang Z H, Yu S B, Yu T, Huang Z, Zhu Y G. Mapping quantitative trait loci (QTLs) for seedling-vigor using recombinant inbred lines of rice (L)., 2005, 91: 161–170
[30] Zhuang J Y, Lin H X, Lu J, Qian H R, Hittalmani S, Huang N, Zheng K L. Analysis of QTL´environment interaction for yield components and plant height in rice., 1997, 95: 799–808
[31] Lehner B. Molecular mechanisms of epistasis within and between genes., 2011, 27: 323–331
[32] Cho Y B, Jones S I, Vodkin L O. Mutations in argonaute5 illuminate epistatic interactions of the K1 and I loci leading to saddle seed color patterns in,2017, 29: 708
[33] Carlborg O, Haley C S. Epistasis: too often neglected in complex trait studies?, 2004, 5: 618
Mapping Main-effect and Epistatic QTL for Hard Seededness in Soybean
AI Li-Juan1,2,**, CHEN Qiang2,**, YANG Chun-Yan2, YAN Long2, WANG Feng-Min2, GE Rong-Chao1,*, and ZHANG Meng-Chen2,*
1College of Life Science, Hebei Normal University, Shijiazhuang 050024, Hebei, China;2Institute of Cereal and Oil Crops, Hebei Academy of Agriculture and Forestry Sciences / Shijiazhuang Branch of National Soybean Improvement Center / Huang-Huai-Hai Key Laboratory of Biology and Genetic Improvement of Soybean, Ministry of Agriculture / Hebei Key Laboratory of Crop Genetics and Breeding, Shijiazhuang 050035, Hebei, China
Hardness is a common characteristic of plant seeds, which is an important quantitative trait affecting germination rate, viability and storage life, and also processing quality of soybean seeds. In this study QTL analysis of the additive and epistatic interaction was used to reveal the important loci and effects controlling soybean hard seededness, and to provide theoretical basis for further analysis of the complex genetic mechanism of hard seededness. F6:8and F6:9populations of 186 recombinant inbred lines (RIL) derived from a cross of Jidou 12 and native variety Heidou (ZDD03651) were used to determine the additive QTLs for hard seededness in different years by the composite interval mapping (CIM) method in WinQTL Cartographer V. 2.5 software. The inclusive complete interval mapping (ICIM) method in IciMapping 4.1 software was used for analysing the interaction of additive and epistatic QTLs for hard seededness. Three QTLs for hard seededness were identified on Chr. 02, Chr. 06, and Chr. 14, respectively, with the genetic contribution rate of 5.54%–12.94%. Four pairs of epistatic interaction QTLs were detected on Chr. 02, Chr. 06, Chr. 09, Chr. 12, and Chr. 14, respectively, with explained 2.53%–3.47% of the phenotypic variation. The QTLs of additive and epistatic interactions were also detected in the hard seeds of soybean, and the epistasis was performed between the main effect QTLs or between the main effect QTL and the non-main effect QTL. The results indecate that the epistatic interaction effect plays an important role in the genetic basis of hard seededness of soybean.
soybean; hard seededness; QTL; epistasis
): 2017-09-05;
2018-01-08;
2018-01-23.
10.3724/SP.J.1006.2018.00852
张孟臣, E-mail: mengchenzhang@hotmail.com; 葛荣朝, E-mail: grcgp@sina.com
**同等贡献(Contributed equally to this work)
艾丽娟, E-mail: ailijuanalj@163.com; 陈强, E-mail: chenqiangwsm@163.com
本研究由国家重点研发计划项目(2016YFD0100201), 国家现代农业产业技术体系建设专项(CARS-004-PS06)和河北省重点研发计划(16227516D)资助。
This study was supported by the National Key Research and Development Program of China (2016YFD0100201), the China Agriculture Research System (CARS-004-PS06), and Key Research and Development Projects of Hebei Provence (16227516D).
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20180122.1429.032.html

