小麦近缘属植物1-FFT基因的克隆及功能分析
王建伟 贺晓岚,* 李文旭 陈新宏
小麦近缘属植物基因的克隆及功能分析
王建伟1贺晓岚1,*李文旭3陈新宏2
1凯里学院大健康学院, 贵州凯里 556011;2西北农林科技大学农学院 / 陕西省植物遗传工程育种重点实验室, 陕西杨凌 712100;3河南省农业科学院小麦研究所, 河南郑州 450002
果聚糖与植物碳素分配和抗逆性有关, 在逆境胁迫中具有保护植物细胞免受伤害的作用。为明确不同来源的果聚糖1-果糖基转移酶基因在植物抗逆中的作用, 本研究分别以小麦近缘属植物华山新麦草(, 2= 2x = 14, NsNs)、簇毛麦(, 2= 2x = 14, VV)、大赖草(, 2= 4x = 28, NsNsXmXm)为材料, 利用RACE技术克隆获得3个果聚糖1-果糖基转移酶基因, 分别命名为、和。3个基因的完整开放阅读框长度分别为1989、1950和1989 bp, 编码662、649和662个氨基酸, 其编码氨基酸序列均含有果糖基转移酶保守结构域。氨基酸序列比对及进化树分析表明, Ph-1-FFT和Lr-1-FFT高度同源, 与Dv-1-FFT位于不同的分支, 而Dv-1-FFT与普通小麦、圆锥小麦、西尔斯山羊草和乌拉尔图小麦1-FFT具有高度同源性。采用基因重组技术构建p1300-35SN-//表达载体, 利用农杆菌介导法将3个载体分别转入烟草品种W38中。对经过抗性筛选、PCR和RT-PCR验证的转基因植株鉴定发现, 其抗旱和抗寒性明显高于对照, 不同来源的转基因植株的抗逆性差异不明显; 在逆境胁迫条件下, 转基因株系的果聚糖、可溶性糖、脯氨酸含量都显著高于对照, 而丙二醛的含量显著低于对照, 不同来源的转基因植株的果聚糖、可溶性糖、脯氨酸和丙二醛含量差异不显著。本研究表明,、和基因均是典型的基因家族成员, 其表达可能对提高烟草抗旱和抗寒性起作用。
基因; 抗旱性; 抗寒性; 小麦近缘属植物; 转基因烟草
干旱、低温、高盐等非生物胁迫是影响植物生长发育的重要环境胁迫因子, 严重影响着作物的产量和品质[1]。果聚糖既是温带和寒带地区植物组织中重要的能量贮藏物质, 又是提高植物抗逆性(抗旱、抗寒、抗盐等)的重要成分[2-3]。基于糖苷键的连锁类型植物中的果聚糖可划分为5个类型, 在高等植物中, 主要有4种不同的果聚糖基转移酶参与果聚糖的合成[4]。其中1-FFT的主要功能是促进果聚糖碳链的进一步延伸, 产生高聚合度果聚糖[5]。除1-FFT之外, 果聚糖:果聚糖6G-果糖基转移酶(fructan: fructansyltrans 6G-fructosyltcallsferase 6G-FFT)和蔗糖:果聚糖6-果糖基转移酶(sucrose:fructan-6- fructosyltransferase 6-SFT)也参与糖苷键进一步延伸的生化反应, 但是不同酶催化可能形成不同的糖苷键类型[6]。对小麦族果聚糖合成酶的克隆和功能研究, 可为定向调控植物果聚糖的含量和组分, 提高植物抗逆性提供遗传依据。
早在1966年就有关于菊芋的报道[7], 但直到20世纪80年代才从菊芋中分离纯化得到[8-9], 随后在蓝刺头[5]、维氏菊[10]、圆锥小麦[11]、普通小麦[11]、乌拉尔图小麦[11]等植物中克隆得到, 并且对其结构和功能进行了深入研究。小麦族基因在进化上相对较保守, 除节节麦外, 乌拉尔图小麦、西尔斯山羊草、圆锥小麦和普通小麦基因的开放阅读框(ORF)长度相等, 均为1947 bp, 并且不同物种基因所编码氨基酸均含有3个高度保守的活性结构域, 即NDPNG、RDP和ECID[2]。对增强植物的抗旱和抗寒性起重要作用[2], 但是是如何提高植物抗逆性的机制还不明确。转入冰草基因的黑麦草, 其果聚糖积累量和可溶性总糖含量显著增加[12]。Knipp和Honermeier[13]报道果聚糖合成酶基因的表达可能对脯氨酸的积累具有多向性效应。Li等[14]报道果聚糖合成酶基因能增强转基因植株氧化胁迫抗性, 降低植株电解质渗漏率和丙二醛含量。在逆境胁迫条件下, 可溶性糖和脯氨酸等抗逆重要调节物质的积累有利于增强植物对旱胁迫和冷胁迫等的抗性[15-16]。因此, 在非果聚糖积累植物中表达果聚糖合成相关基因对改良植物抗旱及抗寒性具有重要意义。
不同物种基因的功能不尽相同, 且的聚合度具有物种特异性[17]。华山新麦草(, 2= 2x = 14, NsNs)是多年生异花授粉植物, 属禾本科小麦亚家族, 具有早熟、耐旱、抗寒、抗盐、抗病等优异性状[18]; 簇毛麦(,2=2x=14, VV)是一年生异花授粉植物[19], 属禾本科小麦亚家族[20], 具有抗旱、抗寒、抗盐、抗多种病害、分蘖力强、小穗数多、蛋白质含量高等优良性状[20-21]; 大赖草(, 2=4x=28,NsNsXmXm)属禾本科赖草属多年生根茎型草本植物, 具有大穗、多花、抗旱、抗寒、抗多种病害及高耐盐碱性[22]。目前, 关于果聚糖酶基因的研究主要集中于挖掘来源于细菌[23]、真菌[24]、植物[25]等的果聚糖合成相关基因, 并转化非果聚糖植物, 研究转基因植株的果聚糖积累效应、相关生理生化指标及非生物胁迫抗性等。本研究从华山新麦草、簇毛麦和大赖草中分别克隆基因, 比较序列间结构差异, 并在转基因烟草中初步验证该基因的抗逆功能, 以期为深入研究不同来源基因在干旱和寒冷逆境中的作用, 以及利用转基因技术创制抗逆作物新种质奠定基础。
1 材料与方法
1.1 cDNA全长克隆
1.1.1保守区的克隆 将华山新麦草、簇毛麦和大赖草材料种植于西北农林科技大学试验地(陕西杨凌), 用总RNA提取试剂盒(RNeasy Plant Mini kit, Qiagen, Germany)从叶片中提取总RNA。使用SuperScript III Reverse Transcriptase cDNA第1链合成试剂盒(Invitrogen)合成cDNA第1链。参照乌拉尔图小麦、普通小麦、粗山羊草、大麦和圆锥小麦5种植物的1-FFT蛋白氨基酸保守区序列设计1对简并引物(Dp1-FFTsen: 5′-AYGAYCCNAAYGGN CCNGT-3′, DP1-FFTantisen: 5′-NSWRTCCATRTCR TGNAC-3′; Y=CT, N=ACGT, R=AG), 并用LA(TaKaRa)扩增小麦近缘属植物基因的cDNA中间保守区。反应程序为94°C预变性3 min; 94°C变性30 s, 55°C退火30 s, 72°C延伸2 min, 35个循环; 72°C延伸10 min。扩增产物经琼脂糖凝胶电泳后回收纯化目的片段, 与pMD19-T载体(TaKaRa)连接, 转化至大肠杆菌DH5α感受态细胞, 将菌落PCR和质粒单双酶切鉴定正确的5个重组质粒送生工生物工程(上海)有限公司测序。
1.1.2 3¢端和5¢端序列的克隆 按照3¢-Full RACE Core Set Ver.2.0试剂盒和5¢-Full RACE Kit试剂盒(TaKaRa)说明书分别克隆小麦近缘属植物基因cDNA的3¢和5′端序列, 特异引物序列为GSOP3¢-PDL: 5′-TCCAGTCGATTCCGAG AACG-3′, GSIP3¢-PDL: 5′-TACCCTCCGCATCAAC ACC-3′; GSOP5¢-PDL: 5′-GGTCATCCTGCTCTACA CG-3′, GSIP5¢-PDL: 5′-ATTGGTACGACATCGAG GGC-3′。小麦近缘属植物不同组织总RNA提取、PCR产物的克隆和测序方法如前所述。
1.2 cDNA编码区的获得及生物信息学分析
根据5¢和3¢-RACE的结果, 并参考小麦基因cDNA序列设计克隆基因的引物(PDL-1-FFT-F: 5¢-CATGGAGTCGTCACGCGGC ATC-3¢; PDL-1-FFT-R: 5¢-CCGACCGAGCAAACAG TCCATAAC-3¢), 通过PCR法扩增基因编码区序列, 并测序验证。
采用National Center for Biotechnology Information (NCBI)网站(http://www.ncbi.nlm.nih.gov/)的在线工具DNAMAN 4.0、MegAlign软件和多序列比对程序ClustalX2进行cDNA序列BLAST分析, 用WebLogo (http://weblogo.threeplusone.com/create.cgi)分析残基保守性。蛋白质1-FFT结构域及核定位信号预测软件分别为2ZIP (http://www.expasy.org/)和PSORT II (http://www.genscript.com/cgi-bin/tools/- psort2.pl)。采用ExPASy proteomics server (http:// www.expasy.ch/tools/dna.html)氨基酸的翻译工具; 应用Conserved Domains数据库分析氨基酸序列的保守区域; 使用NCBI的ORF Finder (http://www. ncbi.nlm.nih.gov/gorf/gorf.html) 进行基因ORF分析, 借助ClustalX2和MEGA5.0软件构建系统进化树。
1.3 叶盘法转化烟草及转基因植株的验证
分别将、和的完整编码区序列插入植物表达载体p1300-35SN的d III-R I位点, 构建表达载体p1300-35SN-(图1), 通过测序确保目的基因在载体中的插入方向及完整性。采用冻融法[27]将重组质粒转入农杆菌GV3101 (本实验室保存), 再利用叶盘法[28]转化烟草W38, 最后将经过10 mg L–1潮霉素筛选的抗性植株移入温室培养。

图1 植物表达载体p1300-35SN-Ph-1-FFT/Dv-1-FFT/Lr-1-FFT示意图
LB和RB: T-DNA的左、右边界; 35S¢: CaMV 35S poly A; 35S2: 含双增强子的CaMV 35S启动子; p35S1: CaMV 35S启动子; Tnos: 终止子。
LB and RB: left and right border of T-DNA; 35S¢: CaMV 35S poly A; p35S2: CaMV 35S promoter with double enhancer sequences; p35S1: CaMV 35S promoter; Tnos: terminator.
采用CTAB法提取烟草叶片基因组DNA, 利用特异引物1-FFT (F: 5¢-CATGGAGTCGTCACGC GGCATC-3¢; R: 5¢-CCGACCGAGCAAACAGTCCA TAAC-3¢)进行PCR扩增, 检测目的基因。反应条件为94°C 5 min; 94°C 30 s, 60°C 30 s, 72°C 2 min, 35个循环; 72°C 10 min。扩增产物经1.0 %琼脂糖凝胶电泳、染色并照相。
为了分析不同来源基因在RNA水平的表达情况, 对PCR阳性转基因植株进行转录分析。按前述方法提取烟草总RNA, 并合成cDNA第1链。以测试烟草叶片cDNA为模板, 首先以烟草基因特异引物(ActF: 5¢-TGGCATCATACCTTTTACA A-3¢; ActR: 5¢-TCCGGGCATCTGAACCTCT-3¢)对各样本进行扩增, 根据扩增结果调整模板浓度, 以使模板cDNA浓度均一化。反应程序为95°C预变性3 min; 94°C 30 s, 55°C 30 s, 72°C 30 s, 35个循环; 72°C延伸10 min。然后用基因的特异引物(Rp1-FFT-F: 5¢-GCATCATCATCGGCTCCAA-3¢; Rp1- FFT-R: 5¢-TCGTCAAGCTCCACCGTTCT-3¢)进行半定量RT-PCR分析, 反应条件为95°C预变性3 min; 94°C 45 s, 55°C 35 s, 72°C 30 s, 35个循环; 72°C延伸10 min。重复3次。
1.4 转基因烟草的抗旱及抗寒性分析
按He等[26]、贺晓岚等[27]描述的方法鉴定转基因植株的抗旱和抗寒性。选择基因表达量相对较高的T0代植株, 采集逆境胁迫前及干旱胁迫(20 d)或冷胁迫(10°C 10 d或–20°C 5 min)后T0植株和对照植株的叶片, 用蒽酮比色法测定可溶性糖含量[28], 用茚三酮法测定脯氨酸含量[29], 用植物丙二醛测定试剂盒(南京建成)测定丙二醛含量, 并用Plant Fructan Colorimetric Assay Kit (GenMed Scientifics Inc., USA)测定果聚糖含量, 重复测定4次。
用SAS V8.1软件统计分析数据, 用检验法比较均数(<0.05), 用OriginPro 2015软件作图。
2 结果与分析
2.1 基因克隆
以华山新麦草叶片、簇毛麦根、大赖草叶片的cDNA为模板进行PCR扩增, 3个基因的保守区扩增产物均约1300 bp (图2)。电泳结果显示3′端和5′端片段长约450 bp和500 bp, 而测序结果显示3′端的片段长度均为448 bp, 华山新麦草和簇毛麦该基因5′端片段长514 bp, 簇毛麦该基因5′端片段长475 bp (图2)。通过PCR扩增获得3条约2000 bp的全长cDNA序列(图2)。回收目的片段, 测序结果证明3个片段为、和的编码区。
2.2 基因序列分析
cDNA序列分析表明,和的ORF长度相等, 均为1989 bp;的ORF为1950 bp, 等电点为4.87~5.00, 分子量预测为71.3~ 72.2 kD (表1)。经Blast比对, 发现、和基因与普通小麦基因序列相似度分别为86%、85%和91%。与已知序列比对发现,、和均存在3个高度保守的结构域; 与其他植物不同的是,和基因的蔗糖结合框由“NDPNG”变为“NDPCG”, 但是仍然包含一个活跃的天冬氨酸(D)残基, 在YECID保守区包含一个谷氨酸(E)残基, 在YRDP框包含一个天门冬氨酸(D)残基(图3)。Ph-1-FFT和Lr-1-FFT序列相似性最高, 在进化树上聚为一类; Dv-1-FFT与小麦族其他物种的1-FFT序列相似性最高, 在进化树上聚为一类(图4)。、和的序列相似度高达96%,除缺失长度为9 nt (5¢-CCTCGGCCG-3¢)和30 nt (5¢-ACGGAGTTCCC GAGGAGCAGGGGCAAGGAC-3¢)的2个序列片段外, 还存在207个单碱基变异, 但这些单碱基变异大多属同义突变, 未改变编码蛋白, 即在氨基酸水平上, Dv-1-FFT比Ph-1-FFT和Lr-1-FFT在N端缺失两处共13个氨基酸。编码的氨基酸序列与小麦族其他物种编码的氨基酸序列相似度较高。和与小麦族其他物种编码的氨基酸序列在N-端差异较大, 但功能区域较保守。
2.3 转基因植株的获得与鉴定
通过叶盘转化法获得T0代转基因烟草, 经抗生素筛选后, 首先利用1-FFT-F/1-FFTR引物进行PCR验证, 共获得195株阳性植株(图5-A), 再用Rp1- FFT-F/Rp1-FFT-R引物分析验证基因表达, 鉴定获得172株阳性植株。RT-PCR分析结果显示,//在转基因烟草中均能正常表达, 而在对照植株中未检测到转录信号(图5-B)。
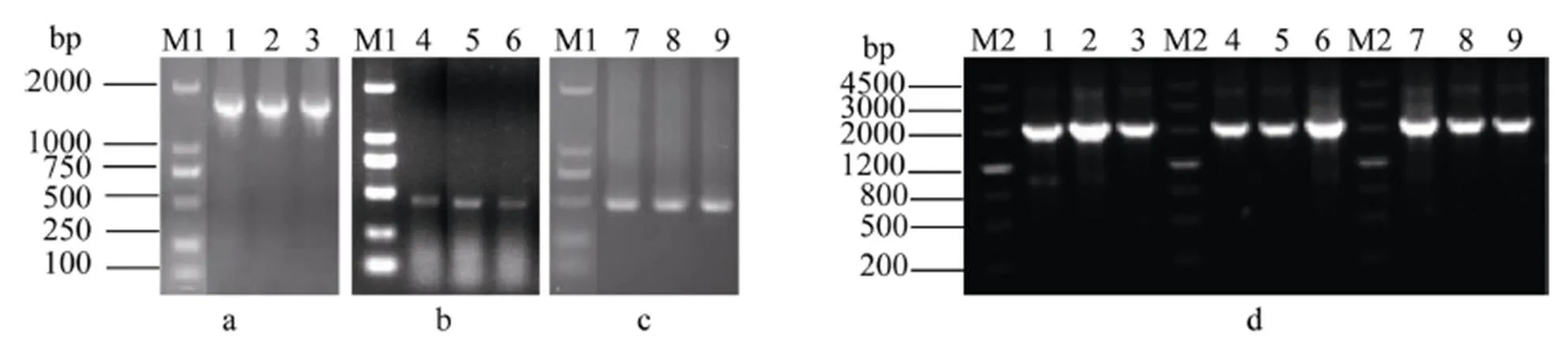
图2 华山新麦草、簇毛麦和大赖草1-FFT基因PCR扩增产物电泳分析
M1: DL2000; M2: marker Ш. a: 基因保守区段扩增产物; b: 3¢RACE扩增产物; c: 5¢RACE 扩增产物; d:(1~3泳道)、(4~6泳道)和(7~9泳道)的cDNA。
M1: DL2000; M2: marker Ш.a: amplification of gene conserved fragment;b: PCR product of 3¢RACE; c: PCR product of 5¢RACE; d: cDNA of(lanes 1–3),(lanes 4–6), and(lanes 7–9).
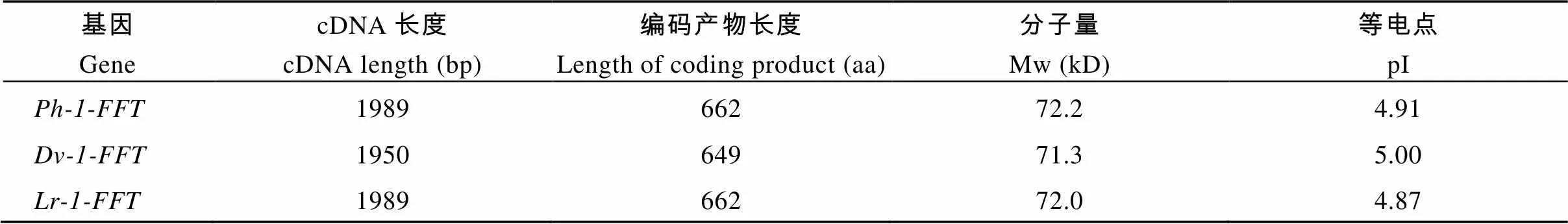
表1 不同来源1-FFT基因的cDNA及其编码产物的长度、分子量和等电点比较

(图3)

图3 华山新麦草、簇毛麦、大赖草及其他物种1-FFT序列分析
方框显示序列保守区; 星号(*)表示相同残基; 冒号(:)表示保守替换; 点号(.)表示半保守替换。比对物种有普通小麦(Ta)、圆锥小麦(Tt)、西尔斯山羊草(As)、乌拉尔图小麦(Tu)、簇毛麦(Dv)、华山新麦草(Ph)、粗山羊草(AE)、大麦(BA)和大赖草(Lr)。
Conserved regions are boxed. Asterisks (*), colons (:), and periods (.) show the identical residues, conserved substitutions, and semiconserved substitutions, respectively. The 1-FFT sequences were obtained from(Ta),subsp.(Tt),(As),(Tu),(Dv),(Ph),(AE),subsp.(BA), and(Lr).
2.4 转基因烟草逆境胁迫前后表型分析
在正常生长条件下, 转、和基因的烟草植株之间及转基因植株与对照植株的生长无明显差异。干旱胁迫35 d后, 对照植株全部干枯, 而转基因植株的心叶仍然保持绿色, 转不同来源基因的植株间无明显差异(图6-a); 复水后, 对照植株未能复活, 而转基因植株在14 d后有少许新叶长出, 转不同来源的基因的植株间生长状态无明显差异。
低温胁迫处理后, 对照全部枯萎, 而转基因植株心叶仍然保持正常生长势, 转基因的植株间生长状态无明显差异(图6-b); 转移至室温继续培养7 d, 对照植株全部死亡, 转基因植株能够恢复生长, 只是生长发育迟缓, 且转不同基因的植株间生长状态无明显差异。
各节点处数值表示bootstrap值(迭代1000次)。比对物种为华山新麦草(Ph)、大赖草(Lr)、簇毛麦(Dv)、圆锥小麦(Tt)、西尔斯山羊草(As)、乌拉尔图小麦(Tu)、普通小麦(Ta)、粗山羊草(AE)和大麦(BA)。
The bootstrap percentages (>50%) are shown next to the branches (based on 1000 replicates). The 1-FFT sequences were obtained from(Ph),(Lr),(Dv),subsp.(Tt) ,(As),(Tu),(Ta),(AE), andsubsp(BA).
2.5 转基因植株逆境胁迫前后生理指标分析
正常条件下, 转基因T0植株的果聚糖含量显著高于对照植株, 转华山新麦草、簇毛麦和大赖草基因植株的果聚糖含量分别为5.37~5.52、5.86~6.40和5.40~5.80 mg g–1, 差异不显著, 而在对照植株中没有检测到果聚糖; 转基因植株可溶性糖、脯氨酸的含量均略高于对照植株, 丙二醛的含量略低于对照植株, 未达显著差异(图7)。
干旱胁迫20 d后, 转基因植株的果聚糖含量显著增加, 转华山新麦草、簇毛麦和大赖草基因植株的果聚糖含量分别为12.84、12.27和12.97 mg g-1, 是胁迫前的2.0~2.2倍, 而在对照植株中没有检测到果聚糖; 转基因植株的可溶性糖为0.20%~ 0.21%, 脯氨酸含量为21.94~22.52 μg g-1, 均显著高于对照植株; 转基因植株的丙二醛含量仅为17.50~ 18.64 nmol g-1, 显著低于对照植株的28.95~29.64 nmol g-1(图7)。
与干旱胁迫相似, 冷胁迫后转华山新麦草、簇毛麦和大赖草基因植株的果聚糖含量分别为13.08、13.36和12.96 mg g-1, 是胁迫前的2.0~2.4倍, 而在对照植株中没有检测到果聚糖; 转基因植株的可溶性糖和脯氨酸含量也均显著高于对照植株, 而丙二醛含量(17.31~18.53 nmol g–1)却显著低于对照植株(图7)。
总之, 干旱和冷胁迫后, 转不同来源基因植株中丙二醛的含量略有提高, 而对照植株中丙二醛的含量显著增加。在胁迫条件下, 转不同来源基因植株中的碳水化合物和脯氨酸含量都显著高于对照植株, 无论在正常条件还是在胁迫条件下, 转不同来源基因植株之间果聚糖、可溶性糖、脯氨酸和丙二醛含量无显著差异。
3 讨论
3.1 Ph-1-FFT/Dv-1-FFT/Lr-1-FFT基因的cDNA及其编码氨基酸序列的特征分析
植物中果聚糖合成相关基因广泛参与植物抗性逆境胁迫[30]。本研究克隆获得的3个小麦近缘属基因与其他物种的相似性在85%以上, 蛋白质结构分析表明这3个基因编码产物属于GH32家族。簇毛麦1-FFT的氨基酸序列包含NDPNG、RDP和ECID保守结构域; 与其他植物不同, 华山新麦草和大赖草基因的蔗糖结合框由NDPNG变为NDPCG, 表明华山新麦草和大赖草可能属于基因家族F型的FT类[31]。在1-FFT蛋白系统进化树上, 小麦近缘属植物1-FFT序列与小麦族其他物种的同源序列处于不同分支, 华山新麦草与大赖草1-FFT序列处于同一分支(图4)。簇毛麦1-FFT序列与小麦族其他物种1-FFT序列相似度较高, 华山新麦草和大赖草1-FFT序列虽然与小麦族其他物种在N-端差异较大, 但功能区域相对较保守。因此推测,可能在果聚糖合成路径中起重要作用, 在进化过程中保持着较高的遗传稳定性。
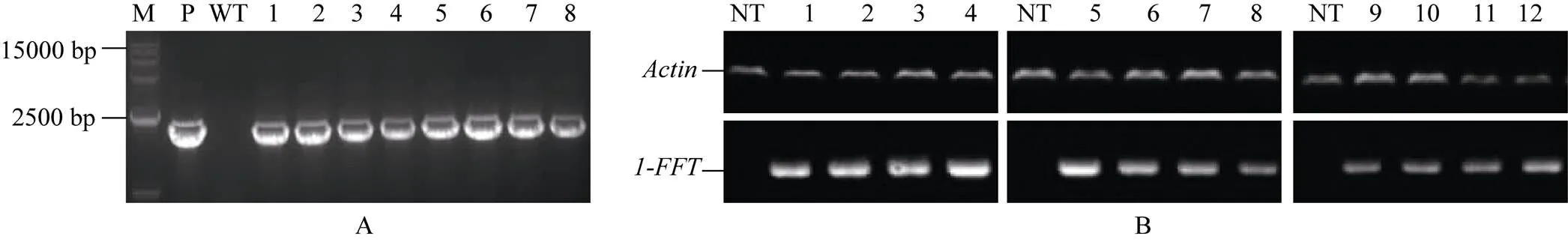
图5 T0代转基因植株的鉴定
A: 转基因植株的PCR鉴定; B: 转基因植株的表达鉴定。M: D15000 marker; P: 阳性对照(质粒); WT: 阴性对照; NT: 转空载体的阴性对照; 1~12: 转基因植株。
A: PCR analysis of transgenic plants; B:expression patterns ofgene; M: D15000 marker; P: positive control (plasmid); WT: negative control plants; NT: negative control (non-transgenic plants); 1–12: T0-tobacco transgenic plants.

图6 转华山新麦草(Ph)、簇毛麦(Dv)和大赖草(Lr) 1-FFT基因烟草干旱和冷胁迫后的表型
a: 干旱胁迫处理35 d后; b: 冷胁迫(10°C 10 d, –20°C 35 min)处理后转移至温室培养7 d。NT为转空质粒对照。
a:after thirty-five days of drought stress; b: recovery growth at room temperature for seven days after cold stress (10°C for 10 days and –20°C for 35 min). NT indicates the non-transgenic tobacco plant.
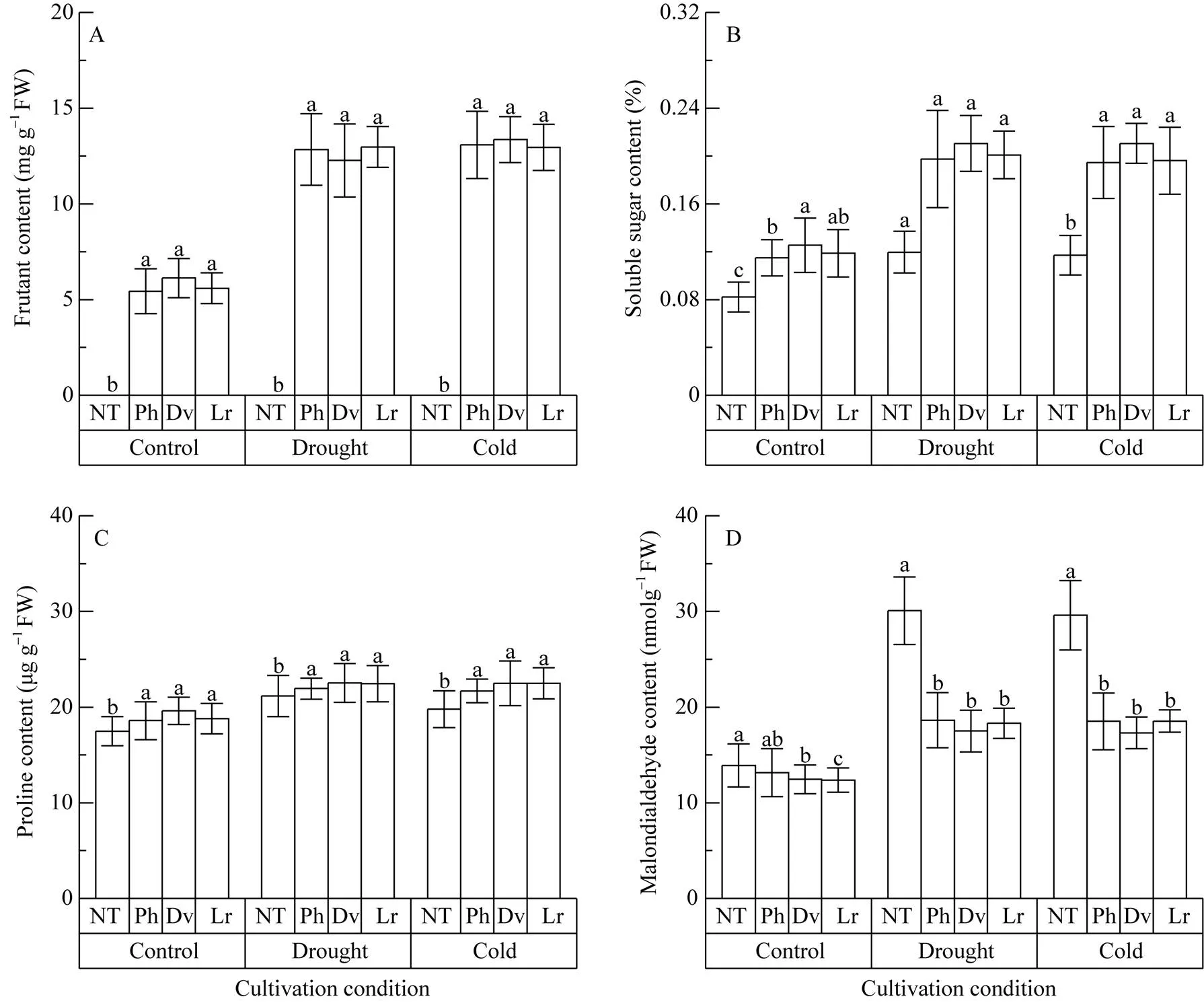
图7 转华山新麦草(Ph)、簇毛麦(Dv)和大赖草(Lr) 1-FFT基因烟草干旱和冷胁迫后的生理指标变化
NT为转空质粒对照。在相同条件下, 误差线上不同字母表示4类转基因植株间差异显著(< 0.05)。
NT indicates the non-transgenic tobacco plant. Different letters above the error bars indicate significant difference among the four types of transgenic plants (< 0.05).
华山新麦草和大赖草基因的cDNA序列长度相等, 但其推导氨基酸存在较大序列差异, 暗示华山新麦草和大赖草基因的cDNA序列差异较大, 因此推测大赖草的可能来自Xm基因组。另外, 本研究克隆的小麦近缘属植物基因与Gao等[11]从小麦族中分离到的多个基因cDNA序列长度不等, 说明本研究克隆的小麦近缘属植物基因可能是该家族的新基因。
3.2 Ph-1-FFT、Dv-1-FFT和Lr-1-FFT表达对转基因烟草果聚糖含量和抗逆性的影响
Suárez-González等[30]报道,或基因在龙舌兰中表达可以提高其对逆境胁迫的抗性, 说明基因对提高作物抗逆性起一定作用。本研究中, 在干旱和寒冷胁迫后, 转不同材料烟草植株表现出明显高于对照植株的抗逆性, 转基因植株叶片的平均果聚糖含量为5.40~5.86 mg g–1, 逆境胁迫后, 转不同来源基因植株的果聚糖含量显著增加, 提高植株的抗旱、抗寒性, 这些结果与前人报道[2, 32]相似。
可溶性糖含量增加对提高植物活性氧清除能力有重要作用[33], 脯氨酸含量也与抗逆性密切相关。无论在逆境胁迫前或逆境胁迫后, 转不同来源的阳性植株, 叶片中可溶性糖和脯氨酸含量均高于对照植株, 说明不同来源的基因均能提高植株的抗旱、抗寒性。碳水化合物代谢的改变可能对脯氨酸的积累起诱导作用[13], 但二者之间的关系很复杂, 其机制有待深入研究。
通过对转基因烟草丙二醛含量的测定, 发现正常条件下转基因植株丙二醛含量较对照植株略低; 干旱和冷胁迫后, 对照的丙二醛含量显著增加, 转基因植株略有增加, 显著低于对照。这表明本研究克隆的3个基因, 在转基因烟草中合成的果聚糖降低了逆境胁迫下的膜脂质过氧化程度, 减轻了细胞膜受损。因为小麦属果聚糖合成植物, 将外源果聚糖合成相关基因导入小麦是否可以提高其抗旱和抗寒性尚不清楚, 但是小麦果聚糖合成相关基因在水稻中表达可以使转基因水稻叶片中积累大量的果聚糖, 并且明显提高转基因水稻苗期的抗寒性[34]。
无论是否存在胁迫条件, 3个不同来源的基因在转入烟草后, 所观测的生理指标均没有显著差异, 因此还需设计新的实验来比较这3个基因的功能, 如合成果糖成分、参与非生物胁迫过程及生物学功能等。
4 结论
通过RT-PCR结合RACE技术, 克隆获得小麦3个近缘属植物的果聚糖合成相关基因, 生物信息学分析表明它们都属于糖基水解酶第32家族, 在转基因烟草中初步验证了3个基因能够显著提高抗旱和抗寒性。3个不同来源的基因的编码产物相似度较高, 转入烟草后生理指标差异不显著。
[1] Zhang S J, Song G Q, Li Y L, Gao J, Liu J J, Fan Q Q, Huang C Y, Sui X X, Chu X S, Guo D, Others. Cloning of 9--epoxy-carote- noid dioxygenase gene () from wheat and its heterologous expression in tobacco., 2014, 58: 89–98
[2] Bie X M, Wang K, She M Y, Du L, Zhang S X, Li J R, Gao X, Lin Z S, Ye X G. Combinational transformation of three wheat genes encoding fructan biosynthesis enzymes confers increased fructan content and tolerance to abiotic stresses in tobacco., 2012, 31: 2229–2238
[3] Khoshro H H, Taleei A, Bihamta M R, Shahbazi M, Abbasi A, Ramezanpour S S. Expression analysis of the genes involved in accumulation and remobilization of assimilates in wheat stem under terminal drought stress., 2014, 74: 165–176
[4] Ritsema T, Joling J, Smeekens S. Patterns of fructan synthesized by onion fructan: fructan 6G-fructosyltransferase expressed in tobacco BY2 cells-is fructan: fructan 1-fructosyltransferase needed in onion?, 2003, 160: 61–67
[5] Van den Ende W, Clerens S, Vergauwen R, Boogaerts D, Le Roy K, Arckens L, Van Laere A. Cloning and functional analysis of a high DP fructan: fructan 1-fructosyl transferase from(Asteraceae): comparison of the native and recombinant enzymes., 2006, 57: 775–789
[6] 胡翠. 果糖基转移酶融合基因转化玉米胚乳中果聚糖的积累. 四川农业大学硕士学位论文, 四川成都, 2009 Hu C. Fructan Accumulation in Maize Endosperm Transformed with Fused Fructosyltransferase Genes. MS Thesis of Sichuan Agricultural University, Chengdu, Sichuan, China 2009 (in Chinese with English abstract)
[7] Edelman J, Dickerson A G. The metabolism of fructose polymers in plants: transfructosylation in tubers ofL., 1966, 98: 787–794
[8] Chalmers J, Johnson X, Lidgett A, Spangenberg G. Isolation and characterisation of a sucrose: sucrose 1-fructosyltransferase gene from perennial ryegrass ()., 2003, 160: 1385–1391
[9] Van Den Ende W, Van Wonterghem D, Verhaert P, Dewil E, Van Laere A. Purification and characterization of fructan: fructan fructosyl transferase from chicory (L.) roots., 1996, 199: 493–502
[10] Van den Ende W, Van Laere A, Le Roy K, Vergauwen R, Boogaerts D, Figueiredo-Ribeiro R C, De Carvalho M A M. Molecular cloning and characterization of a high DP fructan: fructan 1-fructosyl transferase from(Asteraceae) and its heterologous expression in., 2005, 125: 419–429
[11] Gao X, She M Y, Yin G X, Yu Y, Qiao W H, Du L P, Ye X G. Cloning and characterization of genes coding for fructan biosynthesis enzymes (FBEs) in Triticeae plants., 2010, 9: 313–324
[12] 张小芸, 何近刚, 孙学辉, 吴金霞. 转果聚糖合成关键酶基因多年生黑麦草的获得及抗旱性的提高. 草业学报, 2011, 20(1): 111–118 Zhang X Y, He J G, Sun X H, Wu J X. Transformation ofwith a fructan:fructan 1-fructosyltransferase gene fromand enhancement of drought tolerance in transgenic plants., 2011, 20(1): 111–118 (in Chinese with English abstract)
[13] Knipp G, Honermeier B. Effect of water stress on proline accumulation of genetically modified potatoes (L.) generating fructans., 2006, 163: 392–397
[14] Li H J, Yang A F, Zhang X C, Gao F, Zhang J R. Improving freezing tolerance of transgenic tobacco expressing sucrose: sucrose 1-fructosyltransferase gene from., 2007, 89: 37–48
[15] Ruelland E, Vaultier M, Zachowski A, Hurry V. Cold signalling and cold acclimation in plants. In: Jacquot J, Delseny M, eds. Advances in Botanical Research, Salt Lake City: Academic Press, 2009. pp 35–150
[16] Szabados L, Savouré A. Proline: a multifunctional amino acid., 2010, 15: 89–97
[17] Hellwege E M, Raap M, Gritscher D, Willmitzer L, Heyer A G. Differences in chain length distribution of inulin fromandare reflected in a transient plant expression system using the respectivecDNAs., 1998, 427: 25–28
[18] 陈漱阳, 张安静, 傅杰. 普通小麦与华山新麦草的杂交. 遗传学报, 1991, 18: 508–512 Chen S Y, Zhang A J, Fu J. The hybridization betweenand., 1991, 18: 508–512 (in Chinese with English abstract)
[19] Zhang W, Zhang R, Feng Y, Bie T, Chen P. Distribution of highly repeated DNA sequences inand its application in the identification of alien chromatin., 2013, 58: 890–897
[20] 刘成. 多年生簇毛麦基因组新重复序列的分离及其在小麦抗病新种质鉴定中的应用. 电子科技大学博士学位论文, 四川成都, 2010 Liu C. Isolate New Repetitive DNA Sequence from Daypyrum breviaristatum Genome and Its Application in Identifying New Resistant Wheat Germplasm. PhD Dissertation of Electronic Science and Technology of China, Chengdu, Sichuan, China 2010 (in Chinese with English abstract)
[21] De Pace C, Snidaro D, Ciaffi M, Vittori D, Ciofo A, Cenci A, Tanzarella O A, Qualset C O, Mugnozza G S. Introgression ofchromatin into common wheat improves grain protein quality., 2001, 117: 67–75
[22] Mcguire P E, Dvorak J. High salt-tolerance potential in wheatgrasses., 1981, 21: 702–705
[23] Pilon-Smits E A, Ebskamp M J, Paul M J, Jeuken M J, Weisbeek P J, Smeekens S C. Improved performance of transgenic fructan-accumulating tobacco under drought stress., 1995, 107: 125–130
[24] Heyer A G, Wendenburg R. Gene cloning and functional characterization by heterologous expression of the fructosyltransferase ofIAM 2544., 2001, 67: 363–370
[25] Chen H, Nelson R S, Sherwood J L. Enhanced recovery of transformants ofafter freeze-thaw transformation and drug selection., 1994, 16: 664–668
[26] He X L, Chen Z Z, Wang J W, Li W X, Zhao J X, Wu J, Wang Z H, Chen X H. A sucrose:fructan-6-fructosyltransferase () gene fromconfers abiotic stress tolerance in tobacco., 2015, 570: 239–247
[27] 贺晓岚, 王建伟, 李文旭, 陈真真, 赵继新, 武军, 王中华, 陈新宏. 大赖草基因的克隆及其转基因烟草抗旱和抗寒性分析. 作物学报, 2016, 42: 389–398 He X L, Wang J W, Li W X, Chen Z Z, Zhao J X, Wu J, Wang Z H, Chen X H. Cloning of 6-SFT gene fromand analysis of tolerance to drought and cold stresses in transgenic tobacco., 2016, 42: 389–398 (in Chinese with English abstract)
[28] Fales F W. The assimilation and degradation of carbohydrates by yeast cells., 1951, 193: 113–124
[29] Bates L S, Waldren R P, Teare I D. Rapid determination of free proline for water-stress studies., 1973, 39: 205–207
[30] Suárez-González E M, López M G, Délano-Frier J P, Gómez-Leyva J F. Expression of theandgenes and consequent fructan accumulation inandis differentially induced by diverse (a)biotic-stress related elicitors., 2014, 171: 359–372
[31] Lasseur B, Schroeven L, Lammens W, Le Roy K, Spangenberg G, Manduzio H, Vergauwen R, Lothier J, Prud’Homme M P, Van den Ende W. Transforming a fructan:fructan 6G-fructosyltransferase from perennial ryegrass into a sucrose:sucrose 1-fructosyltransferase., 2009, 149: 327–339
[32] Chazen O, Neumann P M. Hydraulic signals from the roots and rapid cell-wall hardening in growing maize (L.) leaves are primary responses to polyethylene glycol-induced water deficits., 1994, 104: 1385–1392
[33] Ravikumar G, Manimaran P, Voleti S R, Subrahmanyam D, Sundaram R M, Bansal K C, Viraktamath B C, Balachandran S M. Stress-inducible expression oftranscription factor greatly improves drought stress tolerance in transgenicrice., 2014, 23: 421–439
[34] Kawakami A, Sato Y, Yoshida M. Genetic engineering of rice capable of synthesizing fructans and enhancing chilling tolerance., 2008, 59: 793–802
Molecular Cloning and Functional Analysis ofin Wheat Relatives
WANG Jian-Wei1, HE Xiao-Lan1,*, LI Wen-Xu3, and CHEN Xin-Hong2
1School of Life and Health Science, Kaili University, Kaili 556011, Guizhou, China;2Shaanxi Provincial Key Laboratory of Plant Genetic Engineering Breeding / College of Agronomy, Northwest A&F University, Yangling 712100, Shaanxi, China;3Wheat Research Institute, Henan Academy of Agricultural Sciences, Zhengzhou 450002, Henan, China
Fructan is closely related to carbon distribution and the response to adverse stresses in plant, protecting plant cell membrane stabilization in stress conditions. To determine the effects of fructan:fructan-1-fructosyltransferase genes from different species, we cloned three genes of full-length cDNA from(2= 2x = 14, NsNs),(2= 2x = 14, VV) and(2= 4x = 28, NsNsXmXm), designated,, and, respectively, usingreverse transcriptase PCR (RT-PCR) and rapid-amplification of cDNA ends (RACE) techniques. The full-length open reading frames (ORF) are 1989, 1950, and 1989 bp in length, encoding 662, 649, and 662 amino acids, respectively. The predicted protein contains a conserved fructosyltransferase domain. Multiple sequences alignment and phylogenetic analysis indicated that the Dv-1-FFT shared a high similarity with 1-FFT from,subsp.,and, Ph-1-FFT and Lr-1-FFTwere clustered into the same evolutionary branch, which was different from those of Dv-1-FFT. Furthermore, the plant expression vector pCAMBIA1300-35SN-was constructed and transferred into tobacco () cv. W38 via-mediated transformation. The validation with PCR and RT-PCR assay showed that drought and cold tolerance was obviously improved in all types of transgenic tobacco compared with the wild type, and no significant difference between transgenic genotypes. Under drought and cold stresses, the contents of carbohydrate and proline were significantly higher in the transgenic tobacco lines than in the wild type, whereas, malondialdehyde content was significantly lower in the transgenic lines, which was no significant difference between the transgenic plants withfrom different species. These results suggest that,, andare typical members of the gene family coding glycoside hydrolase 32 (GH32) and play a role in drought and cold resistance in tobacco.
gene; drought tolerance; cold tolerance; wheat relatives; transgenic tobacco
2017-08-26;
2018-03-26;
2018-04-08.
10.3724/SP.J.1006.2018.00814
贺晓岚, E-mail: helingzhi123@126.com
E-mail: agan1982@126.com
本研究由凯里学院博士专项基金(BS201606)和贵州省教育厅科技拔尖人才支持计划项目(黔教合KY字[2017]094)资助。
This study was supported by the Special Fund for the Doctoral Program of Kaili University (BS201606) and the Science and Technology Top Talents Support Program of Guizhou Provincial Education Department (Guizhou Education KY [2017]094).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20180408.0718.002.html

