清解扶正颗粒对大肠癌细胞增殖和凋亡的影响*
杨弘 李煌 林露敏 曾建伟 ,3 魏丽慧 , 彭军, 林久茂,3#
(1福建中医药大学中西医结合研究院 福州350122;2福建中医药大学药学院 福州350122;3福建省中西医结合老年性疾病重点实验室 福州350122)
大肠癌作为世界上一种常见的恶性消化道肿瘤,其发病率和死亡率高,严重危害人类健康[1]。据统计在恶性肿瘤中,我国大肠癌患者每年的病死率居第三位[2]。目前临床上大肠癌的主要治疗方法是以手术切除为主结合放疗、化疗等综合治疗,但经综合治疗后仍有50%以上的患者在5年后发生复发及转移。同时,以5-FU为基础的化疗能够有效控制大肠癌的发展,但化疗所产生的毒副反应及多药耐药严重影响患者的生存质量及预后,这成为亟待解决的临床难题[3]。而中医药治疗大肠癌等多种肿瘤疗效确切,它具有整体调节作用,且毒副作用小,受到广大医疗科研工作者的青睐。清解扶正颗粒(Qingjiefuzheng Granules,QFG)是由白花蛇舌草、半枝莲、炙黄芪、炒麦芽等组成,具有清热解毒、益气健脾消食等功效的中成药颗粒剂,临床辅助化疗药物治疗大肠癌等恶性肿瘤,具有改善患者的生活质量、减轻胃肠不良反应等作用,但其抑制大肠癌细胞的作用机制尚不清楚。为探讨QFG对大肠癌的抑制作用机制,本研究通过体外细胞实验观察QFG对大肠癌HCT-116和HCT-8细胞增殖和凋亡的影响。现报告如下:
1 材料与方法
1.1 药物与细胞株 清解扶正颗粒由福建中医药大学药学院制剂室提供,用磷酸盐缓冲液(PBS)配成200 mg/ml储存溶液,超声30 min助溶,用0.45 μm过滤器过滤,再用培养基配成所需要的浓度(对照组为 0 mg/ml,实验组分别为 0.5、1、2 mg/ml)。大肠癌细胞株(HCT-116、HCT-8)购自中国科学院上海生科院细胞资源中心。
1.2 试剂 RPMI 1640培养基、双抗(青霉素-链霉素)、胎牛血清(FBS)、0.25%胰蛋白酶(Trypsin)、二甲亚砜(DMSO)均购自美国Gibco公司;四甲基偶氮唑蓝(MTT)干粉购自北京索莱宝科技有限公司;PBS购自美国Hyclone公司;细胞周期试剂盒、Annexin V/PI染色试剂盒购自南京凯基生物技术有限公司。1.3 仪器 超净工作台(苏州净化设备公司);二氧化碳培养箱、-80℃超低温冰箱(美国Thermo公司);倒置显微镜系统(德国Leica仪器有限公司);形态学显微图像分析系统LAS V4.1、Countes全自动细胞计数仪(美国Life公司)。
1.4 细胞培养 将大肠癌细胞株HCT-116、HCT-8分别培养于含10%FBS、1%双抗(含100 U/ml青霉素和100 μg/ml链霉素)的RPMI 1640完全培养基中,并于37℃、5%CO2和饱和湿度的细胞培养箱中培养。待细胞单层贴壁生长至汇合度为80%~90%时,加入1 ml的胰蛋白酶消化1~3 min,随后加入2 ml完全培养基终止消化,于离心机中1 000 r/min离心3 min后,吸弃上清并收集沉淀细胞用于后续实验。
1.5 MTT法检测细胞增殖 收集HCT-116、HCT-8细胞,加入完全培养基,分别制备密度为1×105个/ml的细胞悬液,并按100 μl/孔的原则均匀地接种于96孔培养板中,培养于细胞培养箱中,当每孔细胞的汇合度达到50%~60%时,轻轻吸走原孔中培养基,随后每孔分别加入100 μl不同浓度QFG(终浓度分别为 0 mg/ml、0.5 mg/ml、1 mg/ml、2 mg/ml),干预24 h或48 h后再次吸走原孔中溶液,并加入等体积的 MTT 溶液(100 μl/孔,0.5 mg/ml),继续培养 4 h后吸弃各孔中的液体,每孔加入等体积DMSO并振荡混匀,于酶标仪570 nm波长处测定各孔吸光度值(A值),计算细胞生长抑制率。细胞生长抑制率(%)=(1-实验组A值/对照组A值)×100%。
1.6 细胞形态观察 收集HCT-116、HCT-8细胞,加入完全培养基,分别制备密度为2.0×105个/ml的细胞悬液,并按2 ml/孔的原则接种于6孔板中,培养于细胞培养箱,待每孔细胞汇合度达到50%~60%时,吸弃孔中原培养基,并重新加入等体积不同浓度的 QFG(0mg/ml、0.5mg/ml、1mg/ml、2mg/ml)干预24 h,并在倒置显微镜下观察细胞形态变化,拍照记录。
1.7 细胞周期检测 收集HCT-116、HCT-8细胞,加入完全培养基,分别制备密度为2.0×105个/ml的细胞悬液,并按2 ml/孔的原则接种于6孔板中,培养于细胞培养箱,待每孔细胞汇合度达到50%~60%时,吸弃孔中原培养基,并重新加入等体积不同浓度的 QFG(0mg/ml、0.5mg/ml、1mg/ml、2mg/ml)干预24 h后,收集每孔细胞并用PBS清洗2次后,分别加入预冷的4℃75%酒精固定4 h,PBS清洗3遍后加入PI 500 μl,4℃避光染色30 min,流式细胞仪检测细胞周期。
1.8 细胞凋亡检测 收集HCT-116、HCT-8细胞,加入完全培养基,分别制备密度为2.0×105个/ml的细胞悬液,并按2 ml/孔的原则接种于6孔板中,培养于细胞培养箱,待每孔细胞汇合度达到50%~60%时,吸弃孔中原培养基,并重新加入等体积不同浓度的 QFG(0mg/ml、0.5mg/ml、1mg/ml、2mg/ml)干预24 h后,收集每孔细胞并用PBS清洗2次后,分别加入Annexin V/FITC和PI各5 μl,避光染色15 min后,流式细胞仪检测细胞各时期凋亡情况。
1.9 统计学分析 实验数据均用SPSS22.0统计学软件进行处理。计量资料以()表示,采用t检验;计数资料用比率表示,采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 QFG对 HCT-116、HCT-8细胞增殖的影响MTT检测结果显示不同浓度的QFG可显著抑制大肠癌细胞HCT-116和HCT-8的增殖,具有明显的剂量依赖和时间依赖作用,与对照组(0 mg/ml)比较,差异均有统计学意义(P<0.05)。见表1。
表1 QFG对HCT-116、HCT-8细胞抑制率比较()
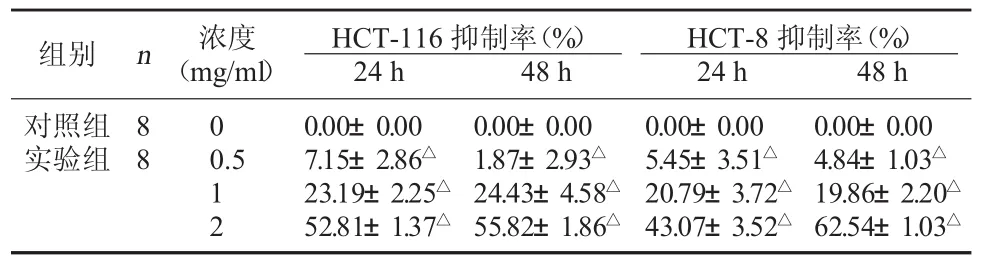
表1 QFG对HCT-116、HCT-8细胞抑制率比较()
注:与对照组比较,△P<0.05。
?
2.2 QFG对 HCT-116、HCT-8细胞形态的影响倒置显微镜观察结果显示大肠癌细胞HCT-116和HCT-8经不同浓度的QFG干预24 h后,随着药物浓度的增加,HCT-116和HCT-8细胞密度逐渐减小,悬浮细胞增多,部分细胞皱缩变圆。该结果进一步证实QFG对HCT-116和HCT-8细胞生长具有显著的抑制作用,并呈明显的剂量效应。见图1。
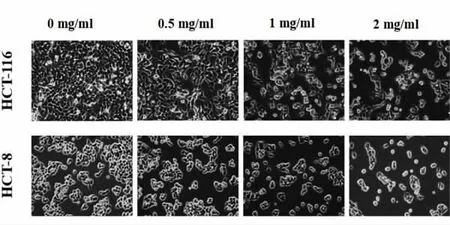
图1 QFG干预HCT-116、HCT-8细胞24 h形态图(200×)
2.3 QFG对 HCT-116、HCT-8细胞周期的影响细胞周期分析结果显示,与对照组比较,实验组QFG对大肠癌细胞HCT-116和HCT-8的S期有明显的抑制作用,G0/G1期细胞比例显著增多(P<0.05),说明QFG能阻止大肠癌细胞由G0/G1期向S期的进程,该作用具有明显的剂量依赖性。该结果表明QFG可通过调控大肠癌细胞HCT-116和HCT-8的细胞周期进程而发挥其抑制大肠癌细胞增殖的作用。见表2。
表2 QFG对HCT-116、HCT-8细胞周期的影响()
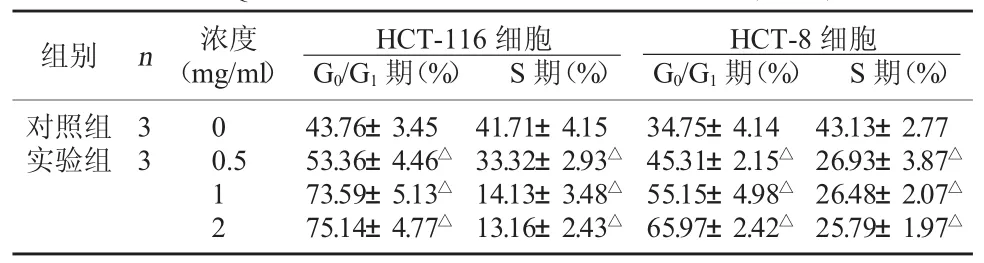
表2 QFG对HCT-116、HCT-8细胞周期的影响()
注:与对照组比较,△P<0.05。
组别 n 浓度(mg/ml)HCT-8细胞G0/G1期(%) S期(%)对照组实验组HCT-116细胞G0/G1期(%) S期(%)3 3 0 0.5 1 2 43.76±3.45 53.36±4.46△73.59±5.13△75.14±4.77△41.71±4.15 33.32±2.93△14.13±3.48△13.16±2.43△34.75±4.14 45.31±2.15△55.15±4.98△65.97±2.42△43.13±2.77 26.93±3.87△26.48±2.07△25.79±1.97△
2.4 QFG对 HCT-116、HCT-8细胞凋亡的影响Annexin V/PI染色结果显示,与对照组比较,QFG各剂量组的早期凋亡比例均有明显增加(P<0.05),且QFG各剂量组的晚期凋亡比例及总凋亡比例均高于对照组(P<0.05),凋亡比例随着QFG浓度增加而逐渐增多,呈现明显的剂量依赖作用。该结果表明QFG具有诱导大肠癌细胞HCT-116和HCT-8凋亡的作用。见表3。
表3 QFC对HCT-116、HCT-8细胞凋亡的影响()

表3 QFC对HCT-116、HCT-8细胞凋亡的影响()
HCT-8凋亡率早期(%) 晚期(%) 总凋亡(%)对照组实验组组别 n 浓度(mg/ml) HCT-116凋亡率早期(%) 晚期(%) 总凋亡(%)3 3 0 0.5 1 2 0.55±0.34 2.42±0.55△1.45±3.11△9.68±2.43△3.52±0.23 9.45±0.37△11.32±0.91△21.45±0.89△4.07±0.45 11.87±0.78△12.77±4.32△31.13±3.03△0.52±1.39 3.71±2.01△10.16±3.63△15.54±2.12△1.71±2.21 5.63±1.17△7.03±2.41△18.39±2.99△2.23±3.25 9.34±3.33△17.19±4.99△33.93±3.01△
3 讨论
大肠癌归属于中医学“积聚、肠蕈、脏毒”等病范畴。脾虚气弱是大肠癌的发病基础,而瘀毒留滞是引发本病的重要因素,是肿瘤形成、生长、转移的直接病理基础[4]。故该病是因虚致积、因积而逾虚的病证。湿热、火毒、瘀滞是病之标,脾虚、肾亏、正气不足是病之本[5]。因而正虚邪实、脾虚、湿毒、瘀滞是病理关键所在。所以,大肠癌的中医治则主要为益气固本、清热解毒、补肝益肾。由白花蛇舌草、半枝莲、炙黄芪、炒麦芽等组成的QFG是经复方白花蛇舌草剂型改制而成,其中白花蛇舌草、半枝莲归大肠经,具有清热解毒、消肿化瘀等功效,临床上常用于治疗大肠癌等各种恶性肿瘤且疗效确切[6~7];黄芪归肺、脾经,兼有益气健脾、托毒生肌等功效,现代研究表明它有显著的抗肿瘤作用[8];炒麦芽具有行气消食、健脾开胃等功效,临床用于辅助肿瘤术后化疗疗效确切[9]。诸药合用具有清热解毒、益气健脾、消食和胃等功效,主要用于湿热壅盛、脾胃虚弱型大肠癌等消化道肿瘤的治疗,临床疗效显著,但其抗肿瘤的作用机制仍不清楚。为研究QFG的抗肿瘤作用机制,本实验采用体外培养两株不同的大肠癌细胞HCT-116和HCT-8,同时探讨QFG对大肠癌细胞生长的抑制作用。
肿瘤是由内外因素共同作用下,以局部形成瘤块为特征的系统性疾病,肿瘤细胞的无限增殖和凋亡抵抗,即增殖/凋亡失衡不受控制是其重要特征[10~11]。因此,抑制大肠癌细胞增殖和促进大肠癌细胞凋亡仍是防治大肠癌的主要方式和途径。本研究MTT结果显示,QFG对大肠癌细胞HCT-116和HCT-8的增殖均有显著的抑制作用;通过细胞形态学观察发现大肠癌细胞经QFG干预后细胞密度明显减小,并出现细胞变圆、体积缩小和脱落现象,进一步证实了QFG具有显著抑制大肠癌细胞增殖的作用。此外,采用Annexin V/PI染色,流式细胞检测分析结果表明QFG对大肠癌HCT-116和HCT-8细胞均有显著诱导凋亡的作用。
细胞周期调节失控是导致肿瘤细胞过度增殖的重要生物学特点。细胞生长周期分为G0期、G1期、S期、G2期和M期,其中最重要的是由G1期进入S期这一过程且受G1期限制点(Restrictionpoint)调控[12]。肿瘤细胞过度增殖与G1期限制点异常调控关系密切,通过调控G1期限制点阻止细胞由G1期进入S期是发挥药物抑制肿瘤增殖的重要作用靶点。本研究发现,QFG可阻止大肠癌HCT-116和HCT-8细胞由G1期进入S期,初步揭示QFG抑制大肠癌细胞增殖的作用机制。
综上所述,QFG通过阻止细胞周期进程和诱导细胞凋亡是其抗大肠癌的重要作用机制。但细胞增殖周期和细胞凋亡的调控是由各种细胞表面受体、细胞内信号分子、周期调控蛋白和细胞凋亡调控蛋白协同作用共同完成的,QFG精确的抗肿瘤作用机制仍需进一步深入研究。
[1]汪露,江滨.大肠癌筛查方法研究进展[J].辽宁中医药大学学报,2014,16(5):236-239
[2]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61:69-90
[3]Soerjomataram I,Lortet-tieulent J,Parkin DM,et al.Global burden of cancer in 2008:a systematic analysis of disability-adjusted life-years in 12 world regions[J].Lancet,2012,380(9856):1840-1850
[4]王小宁,霍介格.中医治疗大肠癌的思路与方法探讨[J].中国中医基础医学杂志,2007,13(9):681-682
[5]丁金芳,黄云胜,李明花.施志明治疗大肠癌经验举要[J].上海中医药杂志,2007,41(5):43-44
[6]靳祎祎,李琼瑜,赖子君,等.白花蛇舌草通过调控Hedgehog通路增加大肠癌耐药细胞的药物蓄积研究[J].康复学报,2016,26(3):34-39
[7]张铃,林久茂,蔡巧燕,等.半枝莲不同极性部位提取物体外抗结肠癌活性研究[J].福建中医药,2012,43(6):54-56
[8]邓晓霞,李清宋,陈中,等.黄芪抗肿瘤作用机制的研究进展[J].中药新药与临床药理,2016,27(2):307-312
[9]陈云云.刘尚义治疗恶性肿瘤经验[J].中医杂志,2010,51(S1):109-110
[10]Lin J,Chen Y,Cai Q,et al.Scutellaria Barbata D Don Inhibits Colorectal Cancer Growth via Suppression of Multiple Signaling Pathways[J].Integr Cancer Ther,2014,13(3):240-248
[11]Han S,Yang X,Pan Y.Can Mitochondria DNA Provide a Novel Biomarker for Evaluating the Risk and Prognosis of Colorectal cancer?[J].Dis Markers,2017,2017:5189803
[12]Lin M,Lin J,Wei L,et al.Hedyotis diffusa Willd extract inhibits HT-29 cell proliferation via cell cycle arrest[J].Exp Ther Med,2012,4(2):307-310

