miR- 207在大鼠纤维化肾组织及尿液中表达上调
石变华,孙佳增,张 尚,史 娟
(中国医学科学院 北京协和医学院 基础医学研究所 医学分子生物学国家重点实验室, 北京 100005)
肾脏纤维化(renal fibrosis, RF)是慢性肾脏疾病终末期的主要病理改变,表现为正常肾单位被成纤维细胞及肌成纤维细胞代替,细胞外基质(extracellular matrix, ECM)堆积等[1]。转化生长因子β(transforming growth factor β, TGF-β)在肾脏纤维化发生中有关键作用[2]。microRNA(miRNA)是进化保守的非编码小分子RNA,可由细胞和组织释放入循环系统[3],可作为多种疾病和组织损伤生物标志物。目前通过活体组织诊断肾脏纤维化,因此寻找简便、准确的生物标志物对诊断与监测肾间质纤维化至关重要。
在前期研究中构建了大鼠肾脏纤维化模型,利用第2代高通量测序方法,筛选尿液中差异表达的转录本[4],发现lncRNA NONRATT042796表达上调,而且是rno-miR- 207的前体序列。本研究分析了rno-miR- 207的表达及功能,为肾脏纤维化诊断提供潜在靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级雄性SD大鼠,8 周龄,体质量190~230 g[北京维通利华实验动物技术有限公司 SCXK(京)2015- 0001]。
1.1.2 主要试剂:胎牛血清(10270)、胰蛋白酶和DMEM培养液(Gibco公司);Trizol、LipofectamineTM2000转染试剂(Invitrogen公司);M-MMV反转录酶、RNA酶抑制剂以、转录缓冲液和RNase-free 水(Promega公司);dNTP Mix和real-time PCR mix(TaKaRa公司);TGF-β(Peprotech公司);miR- 207模拟物mimics及其阴性对照、miR- 207抑制剂及其阴性对照(上海吉玛制药技术有限公司)。
1.2 方法
1.2.1 动物模型制备:腹腔注射戊巴比妥钠(50 mg/kg)麻醉。实验组大鼠(unilateral ureteral obstruction, UUO)于近肾门处结扎右侧输尿管,再于输尿管远离肾门处做2次结扎。假手术组只分离右侧输尿管,不结扎。腹腔注射等量青霉素后关闭腹腔。
1.2.2 细胞转染:将miR- 207模拟物mimics及其阴性对照,miR- 207抑制剂及其阴性对照的冻干粉分别用无RNase水溶解。将铺于6孔板中的细胞换成新鲜完全培养基,取246 μL无血清RPMI1640培养基加入4 μL脂质体LipofectamineTM2000,吹打混匀后静置5 min。另取250 μL无血清RPMI 1640培养基加20 nmol/L RNA片段。混匀后,静置20 min。将转染液加入增殖于6孔板的细胞中,置细胞培养箱中,细胞转染36 h后加入LPS(1 mg/L),继续培养12 h。
1.2.3 RNA抽提及质检:收集肾脏组织或尿液,采用Trizol法提取总RNA,使用Nanodrop测定RNA的吸光度值,以计算浓度并评估纯度。用甲醛电泳进行变性琼脂糖凝胶电泳,检测RNA纯度及完整性。
1.2.4 实时定量PCR检测RNA表达:采用Trizol法提取细胞总RNA(按说明书操作),紫外分光计测定RNA浓度,计算纯度,取A260/A280比值为1.8~2.0的RNA样品进行反转录。cDNA第一条链的合成按照说明书进行。以新合成的cDNA为模板。建立PCR反应体系。PCR程序如下:95 ℃ 5 min,40个PCR循环(95 ℃ 10 s,55 ℃ 20 s,72 ℃ 34 s)。数据采用2-ΔΔCt法进行分析。引物序列见表1。肾脏组织及细胞的RT-qPCR 结果由GAPDH 作为内参,尿液样本中的RT-qPCR 结果由cel-miR- 39 作为内参。

表1 引物序列Table 1 The primer sequences
1.3 统计学分析
2 结果
2.1 miR- 207在肾纤维化大鼠肾脏和尿液中表达均上调
肾纤维化大鼠的肾脏和尿液中miR- 207的表达均上调 (图1)。
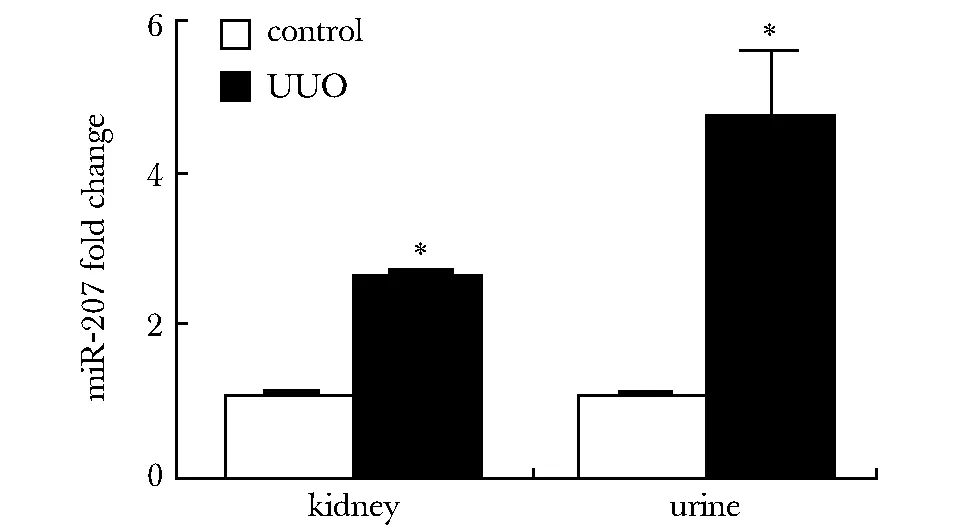
*P<0.05 compared with control图1 实时定量PCR检测miR- 207表达Fig 1 Analysis of miR- 207 expression by real-time
2.2 TGF-β 通路对miR- 207的表达调控
TGF-β显著上调了miR- 207在大鼠肾小管上皮NRK- 52E 细胞中的表达,并呈现出时间依赖性和剂量依赖性(作用时间为12 h) (图2)。
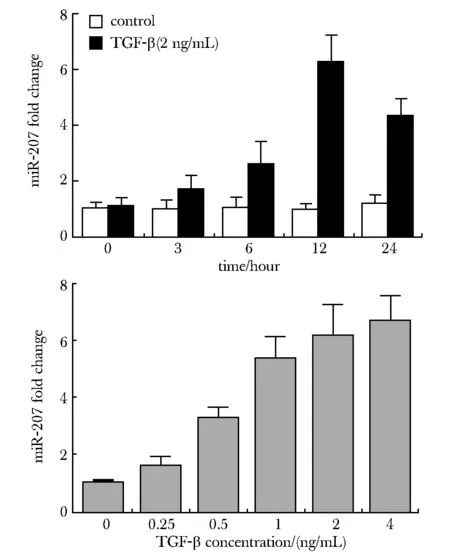
图2 在大鼠肾小管上皮NRK52E细胞中,TGF-β诱导miR- 207的表达Fig 2 TGF-β induced miR- 207 expression in NRK52E cells
2.3 对纤维化相关基因表达的影响
分别将miR- 207模拟物mimics、抑制剂inhibitor转染大鼠肾小管上皮NRK- 52E细胞,二者可有效影响细胞中miR- 207的表达水平(图3)。细胞中转染miR- 207 mimics后TGF-β诱导的Col1a1, Col3a1, Ctgf和Fn1的基因表达增加,而敲低miR- 207后TGF-β诱导的Col1a1, Col3a1, Ctgf和Fn1的基因表达被抑制(图4)。

图3 miR- 207 mimics和inhibitor对大鼠肾小管上皮NRK52E细胞中miR- 207的影响Fig 3 miR- 207 mimics and inhibitor affected the expression of miR- 207 in NRK52E cells

图4 miR- 207对肾纤维化相关基因表达的影响Fig 4 miR- 207 affected the expression of gene related to renal fibrosis
3 讨论
肾脏纤维化程度与慢性肾脏疾病的治疗及预后密切相关。目前判定肾脏组织纤维化的金标准是活体组织检查。寻找方便、精确的生物标志物,对诊断与监测肾间质纤维化至关重要[5]。miRNA是一类具有介导基因转录后表达调控功能的非编码小分子RNA,lncRNA是碱基数大于200个核苷酸的非翻译转录本,通过基因印迹、染色质重塑、剪接调控等多种机制发挥功能。
在前期研究中构建了大鼠肾脏纤维化模型,利用第2代高通量测序的方法,筛选肾脏纤维化发生发展过程中尿液中差异表达的转录本,发现lncRNA NONRATT042796表达上调,是rno-miR- 207的前体序列。利用Targetscan数据库预测miR- 207的靶分子,发现其与TGIF2 3′UTR区存在相互结合位点。TGIF2可作为共转录因子抑制TGF-β信号通路,后者与纤维化疾病的发生发展密切相关,能诱导细胞内Smad蛋白活化[6- 9]。此外,研究发现TGIF2可抑制角膜基质细胞的纤维化表型[10]。上述研究提示miR- 207可能与肾脏纤维化相关。本实验通过研究rno-miR- 207的表达及功能,为肾脏纤维化的诊断提供潜在生物标志物。
首先利用RT-qPCR方法检测肾纤维化大鼠肾脏和尿液中miR- 207的表达水平,发现miR- 207的表达水平均上调。还发现TGF-β能显著上调miR- 207在大鼠肾小管上皮NRK- 52E 细胞中的表达,并有时间和剂量依赖性。说明TGF-β通路可能参与了对miR- 207的表达调控。
肾脏纤维化表现为正常肾单位丢失,成纤维细胞增生,功能缺失以及胶原蛋白和纤连蛋白等细胞外基质堆积等。TGF-β在纤维化过程中能够诱导纤维化相关蛋白Col1a1, Col3a1, Ctgf和Fn1的表达[8,11]。向NRK- 52细胞中转染miR- 207 mimics或inhibitor观察miR- 207对纤维化相关基因的影响。发现转染miR- 207 mimics后TGF-β诱导的Col1a1,Col3a1,Ctgf和Fn1的基因表达增加,而敲低miR- 207后TGF-β诱导的基因表达被抑制。说明miR- 207在TGF-β调控的纤维化过程中有重要的作用。
以上结果表明miR- 207在肾脏纤维化发生过程中的功能可能由TGF-β/Smad 信号调控,并对纤维化相关基因的表达进行调控,可能形成一个肾脏纤维化调节反馈回路,为肾脏纤维化诊断提供新的方法。
参考文献:
[1] Duffield JS. Cellular and molecular mechanisms in kidney fibrosis[J]. J Clin Invest, 2014, 124: 2299- 2306.
[2] Meng XM, Nikolic-Paterson DJ, Lan HY. TGF-β: the master regulator of fibrosis[J]. Nat Rev Nephrol, 2016, 12: 325- 338.
[3] Saikumar J, Ramachandran K, Vaidya VS.Noninvasive micromarkers[J]. Clin Chem, 2014, 60: 1158- 1173.
[4] Sun J, Zhang S, Shi B,etal. Transcriptome identified lncrnas associated with renal fibrosis in UUO rat model[J]. Front Physiol, 2017, 8: 658- 667.
[5] Wong MG, Pollock CA. Biomarkers in kidney fibrosis: are they useful[J]. Kidney Int Suppl, 2014, 4: 79- 83.
[6] Hamabe A, Konno M, Tanuma N,etal. Role of pyruvate kinase M2 in transcriptional regulation leading to epithelial-mesenchymal transition[J]. Proc Natl Acad Sci U S A, 2014, 111: 15526- 15531.
[7] Shen Y, Miao N, Wang B,etal. c-Myc promotes renal fibrosis by inducing integrin α v-mediated transforming growth factor-β signaling[J]. Kidney Int, 2017, 92: 888- 899.
[8] Verrecchia F, Mauviel A.Transforming growth factor-beta and fibrosis[J]. World J Gastroenterol, 2007, 13: 3056- 3062.
[9] Derynck R, Zhang YE. Smad-dependent and Smad-independent pathways in TGF-beta family signalling[J]. Nature, 2003,425: 577- 584.
[10] Sharma A, Sinha NR, Siddiqui S,etal. Role of 5′TG3′-interacting factors (TGIFs) in vorinostat (HDAC inhibitor)-mediated corneal fibrosis inhibition[J]. Mol Vis, 2015, 21: 974- 984.
[11] Verrecchia F, Chu ML, Mauviel A. Identification of novel TGF-beta/Smad gene targets in dermal fibroblasts using a combined cDNA microarray/promoter transactivation approach[J]. J Biol Chem, 2001, 276: 17058- 17062.

