Auto-Planning在肺癌调强放疗计划中的剂量学研究
李慧君,王琳婧,王锐濠,张书旭
广州医科大学附属肿瘤医院 放疗中心,广东 广州 510095
引言
随着放疗技术的不断发展,调强放射治疗[1-2](Intensity Modulated Radiation Therapy,IMRT)已经成为非小细胞肺癌的主要治疗手段之一[3-5],其能够在提高靶区剂量的同时保护正常组织,有效提高患者的肿瘤控制率及生存质量。计划设计作为精确放疗实现的中枢环节,其质量直接影响放疗疗效[7-9]。常规IMRT计划是物理师根据临床要求对靶区和危及器官进行限量的逆向优化过程,优化过程中物理师根据剂量分布情况反复补充调整限量条件,最终得到临床满意的治疗计划,因此物理师的经验对常规计划质量至关重要。Auto-Planning(AP)作为一种新的计划设计方法[10-13],将以往的治疗经验融入到计划优化中,由计划系统自动生成剂量成形结构(Dose Shaping Structure,DSS),并根据限量条件反复优化目标函数[14],使其无限接近最优解,在无需物理师外加干预的情况下得到临床可用的治疗计划。本研究选取16例肺癌患者,分别进行手动计划和AP计划,比较两种计划的剂量学差异[15-16],探讨AP自动优化计划在肺癌放疗中可行性,以期更好的为临床服务。
1 材料与方法
1.1 病例选择
随机选取2017年6月至2017年12月在我院接受调强放疗的16例肺癌患者,其中右肺癌7例,左肺癌7例,中央型肺癌2例,年龄52~69岁,中位年龄59岁,选取病例均具有明确放疗适应症。
1.2 CT模拟定位及靶区勾画
患者均采用仰卧位,双臂上举,用热塑体膜进行体位固定。应用美国GE公司的Lightspeed 16排螺旋CT进行扫描,扫描范围包括下颌至全胸廓的所有区域,扫描层厚设置为5 mm,扫描过程中患者保持自主平静呼吸。扫描后的CT图像传至Pinnacle3V 9.10计划系统,由医生勾画肿瘤靶区(Gross Tumor Volume,GTV)、临床靶区(Clinical Target Volume,CTV)、计划靶区(Planning Target Volume,PTV)及危及器官(Organs At Risk,OARs)。GTV包括肺内原发灶、纵膈淋巴结和转移肺门,CTV由GTV向肺部及转移淋巴结外放获得,PTV考虑器官运动范围及摆位误差,由CTV外放6 mm获得,危及器官包括脊髓、心脏和双肺组织。
1.3 计划设计
利用Pinnacle3V9.10计划系统对16例肺癌病例分别设计手动调强计划和AP调强计划。为方便比较,手动计划和AP计划均采用医科达Synergy直线加速器6 MV X线,且设置相同射野,射野角度根据肿瘤位置设置为5野偏分或均分,处方剂量6000 cGy/30次。手动计划由本院5年以上工作经验的物理师首先对非重叠的靶区及OARs进行外扩处理,而对重叠的部分根据需要进行内缩处理,然后根据给定的靶区和OARs限量设置目标函数及其权重,经初步计算后,根据剂量分布情况,由物理师反复补充、调整限量条件使得剂量成型。AP计划首先利用Pinnacle3V9.10系统中自带的Technique对靶区和OARs进行处理,对处理后的靶区和OARs进行限量后自动优化,优化过程中由系统根据经验自动生成DSS结构并反复补充优化,使目标函数无限接近最优解,最终达到剂量成型。
1.4 计划参数比较
根据剂量体积直方图(Dose Volume Histogram,DVH)分析和比较两种计划的剂量分布差异,剂量分布指标包括:
(1)靶区:最大受照剂量Dmax、平均受照剂量Dmean、最小受照剂量Dmin、靶区均匀性指数(Homogeneity Index,HI)和靶区适形度指数(Conformity Index,CI)。其中HI、CI指数公式如下:
HI=D5/D95
CI=(VPTV95%/VT)*( VPTV95%/VPTV)
其中D5为5%的靶区体积所接受的照射剂量,D95为95%的靶区体积所接受的照射剂量。HI值越小,靶区剂量越均匀。VPTV95%为95%处方剂量曲线覆盖的PTV面积,VT为95%处方剂量曲线覆盖的面积,VPTV为靶区体积。CI值越接近1(范围为0~1),靶区适形度越好。
(2)危及器官:脊髓的最大剂量Dmax和平均剂量Dmean;双肺的平均剂量Dmean和特定剂量受到的照射体积V30,V20,V5;心脏的平均剂量Dmean和特定剂量受到的照射体积 V40,V30。
1.5 统计学分析
采用SPSS 20.0统计软件,对两种计划的各项剂量参数行配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 靶区剂量比较
与手动计划相比,AP计划靶区平均剂量更接近处方剂量,比手动计划少约19.38 cGy(t=-4.257,P=0.001);最小剂量增加约72.55 cGy(t=2.903,P=0.011);适形度优于手动计划(t=6.376,P=0.000012),差异均具有统计学意义。靶区的最大剂量和均匀性差异无统计学意义,具体结果见表1。
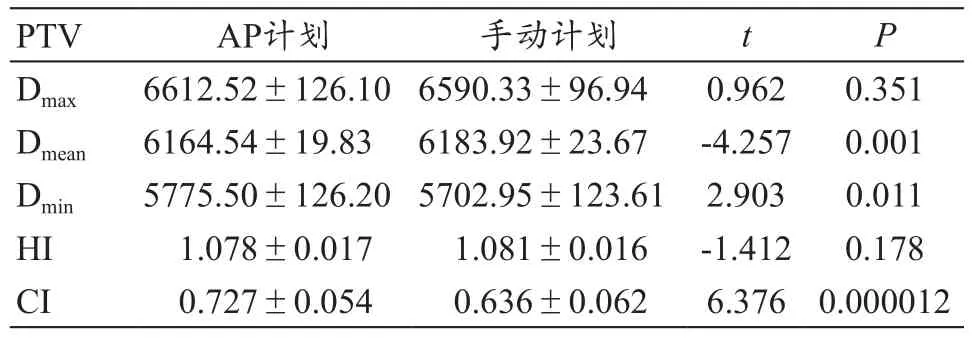
表1 两种计划的靶区剂量学分布(cGy)
2.2 危及器官剂量比较
与手动计划相比,AP计划脊髓的最大剂量和平均剂量分别减少约183.83 cGy(t=-3.933,P=0.001)、103.61 cGy(t=-2.865,P=0.012),差异有统计学意义。AP计划心脏的平均剂量减少约 43.44 cGy(t=-2.332,P=0.036),V40减少约0.91%(t=-2.554,P=0.029),差异有统计学意义。V30差异无统计学意义。AP计划双肺的平均剂量减少约34.49 cGy(t=-5.257,P=0.000097),V30和V20分别减少约0.72%(t=-3.974,P=0.001)、0.53%(t=-3.46,P=0.003),差异有统计学意义。V5差异无统计学意义,具体分析见表2。

表2 两种计划的危及器官剂量学分布(cGy)
3 讨论
随着放疗技术的发展,IMRT精确放疗技术广泛应用于肺癌。初步结果表明,IMRT可提高肺癌靶区的受照剂量,同时降低危及器官,如肺、脊髓等的照射剂量。计划设计作为放疗的中枢环节,计划质量直接影响放疗疗效。因此如何高效优质的完成计划设计对放疗技术的临床应用具有重要意义。
IMRT计划的本质就是根据目标函数直接优化子野形状和权重,逆向求得接近最优解的剂量分布。但优化程序只会依据定义的限量条件求最优射野参数,对没有描述到的正常组织区域不作要求,由此可能导致靶区适形度差,靶区外存在剂量热点,脑干或脊髓等危及器官出现剂量“套圈”现象。针对此类现象,计划设计者通过定义DSS结构给定相应限量解决这一问题。常用的DSS结构包括3种:① 将靶区外廓一定范围得到环状结构,对环状结构限定最大剂量约束,其作用能够提高靶区适形度;② 凹形靶区的凹陷区,考虑凹陷区内危及器官的受量要求,给定凹陷区一个剂量体积约束,同时限定最大剂量容许值,可以消除危及器官剂量“套圈”现象;③ 外扩靶区与一些重要并行器官的重叠区,将危及器官与靶区的重叠区设定最大剂量约束,非重叠区给出最小剂量约束,可以在保证靶区剂量的同时减少危及器官某一剂量以上的体积。手动计划中,物理师首先对非重叠的靶区及OARs进行外扩处理,而对重叠的部分根据需要进行内缩处理,然后根据临床给定的要求设置限量条件及其权重,经初步计算后,物理师继续根据剂量分布情况补充、调整限量条件,最终使得剂量成型。由此可见DSS结构的设计极大程度上依赖物理师的临床经验,AP的精华即模仿有经验的物理师,并且相对手动计划,AP能不断根据计算出的剂量分布系统生成DSS结构,并自动给出限量条件,直到目标函数无限接近最优解,最终剂量成型。
本文分析比较了手动调强计划和AP调强计划的剂量学特性,研究结果发现,AP放疗计划不仅能够满足临床要求,而且相对手动计划提高了靶区的最低剂量和适形度,平均剂量更接近处方剂量,并且很好的控制了脊髓的最高剂量,减少了脊髓的平均受量,一定程度上降低了双肺的平均剂量和特定剂量的受照体积(V30,V20),在保护心脏的平均剂量和V40方面也稍有优势。
综上所述,AP作为一种新的计划设计方法,可以模仿有经验的物理师,自动生成DSS结构优化目标函数,最终获得满足临床要求的治疗计划。AP计划能够有效优化靶区剂量分布,减少危及器官受照,实现了计划设计的自动化,减少了人工依赖以及人为因素影响,提高了物理师的工作效率,使治疗计划更趋智能科学。
[1] 戴建荣,胡逸民.调强放疗的计划设计[J].中国医疗器械信息,2005,11(2):9-12.
[2] Mell LK,JCMundt AR.A survey of intensity-modulated radiation therapy use in the United States[J].Cancer,2003,98(1):204-211.
[3] Chan C,Lang S,Rowbottom C,et al.Intensity-modulated radiotherapy for lung cancer: Current status and future developments[J].J Thorac Oncol,2014,9(11):1598-1608.
[4] Bezjak A,Rumble RB,Rodrigues G,et al.Intensity-modulated radiotherapy in the treatment of lung cancer[J].Clin Oncol,2012,24:508-520.
[5] 周晓琳.高龄早期非小细胞肺癌单纯放射治疗效果研究[J].中国继续医学教育,2015,(33):123-124.
[6] Selek U,Bolukbasi Y,Welsh JW,et al.Intensity-modulated radiotherapy versus 3-dimensional conformal radiotherapy strategies for locally advanced non-small-cell lung cancer[J].Balk Med J,2015,31(4):286-294.
[7] Xu Y,Deng W,Yang S,et al.Dosimetric comparison of the helical tomotherapy, volumetric-modulated arc therapy and fixed- field intensity-modulated radiotherapy for stage IIB-IIIB non-small cell lung cancer[J].Sci Rep,2017,7(1).
[8] Zarepisheh M,Long T,Li N,et al.A DVH-guided IMRT optimization algorithm for automatic treatment planning and adaptive radiotherapy replanning[J].Med Phys,2014,41(6 Part1):61711.
[9] Li N,Zarepisheh M,Uribesanchez A,et al.Automatic treatment plan re-optimization for adaptive radiotherapy guided with the initial plan DVHs[J].Phys Med Biol,2013,58:8725-8738.
[10] Marwaha G,Zhuang T,Ward MC,et al.Autoplanning for lung SBRT: Quicker, without compromising quality[J].Inter J Radiat Oncol Biol Phys,2015,93(3):E580-E581.
[11] Gintz D,LatifiK,Caudell J,et al.Initial evaluation of automated treatment planning software[J].J Appl Clin Med Phys,2016.
[12] Kusters JMAM,Bzdusek K,Kumar P,et al.Correction to:Automated IMRT planning in pinnacle—A study in head-andneck cancer[J].Strahl Onkol,2017,193(12): 1077-1078.
[13] Kusters JMAM,Bzdusek K,Kumar P,et al.Automated IMRT planning in pinnacle[J].Strahl Onkol,2017,193(12):1031-1038.
[14] 王琳婧,王锐濠,雷怀宇,等.基于Auto-Planning的宫颈癌调强放疗的剂量学研究[J].中国医疗设备,2017,32(6):83-86.
[15] 李洪水,廖丽娟.局部晚 期非小细胞肺癌调强放疗与三维适形放疗的对比[J].中国卫生标准管理,2017,(24):62-64.
[16] 廖雄飞,李厨荣,李宁山,等.自动和逆向3DCRT与逆向IMRT计划剂量学比较[J].中华放射肿瘤学杂志,2017,26(4):437-441.

