三维彩色多普勒超声与超声造影对鉴别诊断原发性肝癌及转移性肝癌的价值
袁月德,刘梅存
青海省海东市互助县人民医院 电生理科,青海 海东 810500
引言
肝脏是肿瘤好发部位之一,其中良性肿瘤较少见,多为恶性肿瘤,肝癌根据原发病灶位置分为原发性肝癌及转移性肝癌[1]。现代由于生活环境的影响,肝癌的发生率也不断升高。肝癌发病隐匿,早期基本无明显临床症状,当患者出现明显不适时,肝肿瘤已经发展为中晚期[2]。现代临床对肝癌的检查多采用彩色多普勒超声(Color Doppler Flow Imaging,CDFI) 与 超 声 造 影(Contrast Enhanced Ultrasound,CEUS),并取得了较高的检出率[3]。多年来的临床经验发现[4],三维CDFI与CEUS在鉴别诊断原发性肝癌及转移性肝癌时,可以通过周边血流情况及造影过程中各项指标的情况鉴别肝癌类型,进而采取相应有效的治疗方案以控制患者的病情发展。我院为进一步分析探讨三维CDFI与CEUS对于鉴别诊断原发性肝癌及转移性肝癌的价值,特选取2014年7月至2016年7月入住我院的80例肝癌患者作为研究对象,分析后报告如下。
1 资料与方法
1.1 一般资料
将2014年7月至2016年7月入住我院的80例临床诊断为肝癌的患者作为研究对象,其中男性42例,女性38例;年龄26~81岁,平均(47.31±13.38)岁。80例患者肝内病变均为单发病灶,肿瘤直径1.6~11.3 cm,平均直径(5.01±1.34)cm。术后病理诊断:原发性肝癌39例,转移性肝癌41例。
原发性肝癌组:男性21例,女性18例,年龄26~78岁,平均年龄(47.21±13.49)岁,肿瘤直径1.6~10.8 cm,平均直径(4.89±1.46)cm。转移性肝癌组:男性21例,女性20例,年龄27~81岁,平均年龄(47.91±14.38)岁,肿瘤直径1.9~11.3 cm,平均直径(5.12±1.97)cm;转移的原发病灶位置分类:肺部8例、胃部7例、乳腺6例、甲状腺8例、结直肠7例、胰腺5例。两组患者在性别、年龄、病灶大小等一般资料方面差异较小,差异无统计学意义(P>0.05),具有可比性。
纳入标准:① 经临床症状及病理检查确诊为肝癌;②患者意识清楚、神智正常,能对事物进行清晰的表达;③能主动配合调查,各项生命体征平稳;④ 本组研究经伦理委员会批准后实施,本人及家属对本组治疗方案均已详细了解,并主动签署知情同意书,患者的临床资料均不公开,充分尊重患者的隐私性。
排除标准:① 全身感染、其他全身性疾病的患者;② 心、肝、肾功能严重受损、精神异常的患者;③ 明显重大疾病症状表现,生命濒危的患者;④ 不愿参加本研究者。
1.2 方法
所有研究对象在术前分别进行三维CDFI 检查与CEUS。
三维彩色多普勒超声肝部检查,使用GE公司LOGIQP5型彩色多普勒超声检测仪,凸阵探头频率3.5~5.0 MHz线阵探头频率10.0~15.0 MHz。患者在平静状态下平卧于检查床上,充分暴露肝部检测区域,观察肝部病灶情况及血流情况;之后对肝癌病变作超声造影,观察、测量并记录病变血流状况;使用CG公司生产的LOGIQ E9彩色多普勒超声诊断仪,探头频率3.5 MHz;具体方法:将六氟化硫微泡(生产厂家意大利博莱科公司)溶于5 mL 0.9%的生理盐水中,充分溶解后,经肘静脉注入患者体内,每次注射量不超过3 mL,启动造影模式,观察造影剂注入过程中患者肝部声像图表现,并由仪器内置录像设备实时记录造影全过程。
1.3 观察指标
分别采用CDFI与CEUS对肝部病灶周围动脉、门静脉进行检查:
(1)观察两组患者CDFI检查时病灶内部和病灶周围血流信号的检出情况。
血流信号分级标准[5]:0级:未见明显血流信号;Ⅰ级:可见1~2个点状和细棒状的血流信号;Ⅱ级:见3~4个点状和细棒状的血流信号,或见1~2个明显的条状血流信号;Ⅲ级:见≥5个点状和细棒状的血流信号,或见1~2个明显的条状血流信号。
血流信号的检出率:为Ⅰ级血流信号、Ⅱ级血流信号和Ⅲ级血流信号之和与本组总例数之比(%)。
(2)比较两组患者CDFI检查周遭血流情况,具体包括:肝动脉峰值流速、肝动脉最小流速、门静脉流速、肝动脉内径和阻力指数等。
(3)比较两组患者经CEUS检查的造影全过程的各项指标,具体包括:增始时间、峰值时间、峰值增强强度、增强速率和50%倾斜率。
(4)比较两种检验方法的临床诊断情况,比较二者的检测符合率。
1.4 统计学分析
统计分析时采用SPASS 20.0软件分析,计量资料以x-±s表示,用χ2检验计数资料,用t检验比较组间,以P<0.05为有统计学意义。
2 结果
2.1 病灶血流信号检出情况
2.1.1 “病灶内部”血流信号的检出情况
两组患者CDFI检查,原发性肝癌组“病灶内部”血流信号的检出率优于转移性肝癌组,差异有统计学意义(P<0.05),见表1,表明诊断结果更为准确。
2.1.2 “病灶周围”血流信号的检出情况
两组患者CDFI检查,原发性肝癌组“病灶周围”血流信号的检出率优于转移性肝癌组,差异有统计学意义(P<0.05),见表2,表明诊断结果更为准确。

表1 两组患者经CDFI检查后“病灶内部”血流信号的检出情况的比较(例)
2.2 两组患者经CDFI检查后周遭血流情况
原发性肝癌组肝动脉峰值流速、肝动脉内径和阻力指数的情况与转移性肝癌组比较明显要高,原发性肝癌组肝动脉最小流速、门静脉流速指标情况与转移性肝癌组比较明显要低,二者统计学上有意义(P<0.05),见表3。
2.3 两组患者经CEUS检查的造影全过程各项指标的情况
原发性肝癌组增始时间、增强速率指标情况与转移性肝癌组相比明显要低,原发性肝癌组峰值时间、峰值增强强度及50%倾斜率指标情况与转移性肝癌组相比明显要高,二者统计学上有意义(P<0.05),见表4。
2.4 两种诊断方法的临床诊断情况
原发性肝癌采用CEUS诊断结果与病理检查符合率要稍高于采用CDFI的诊断结果;转移性肝癌采用CEUS诊断结果与病理检查符合率也要稍高于采用CDFI的诊断结果,但二者差异较小,差异无统计学意义(P>0.05),见表5。
3 讨论
3.1 原发性肝癌与转移性肝癌病理解剖的区别
近年来,由于人们生活水平的不断提高和饮食方式的不断改变,环境中突变原和病毒是激发肝细胞分裂的主要途径,引起细胞点突变和基因异位,加速了肝肿瘤细胞分化增殖,导致肝癌发病率逐年升高[6]。肝癌根据原发病灶位置分为原发性肝癌及转移性肝癌[7]。原发性肝肿瘤多发生于肝细胞索、肝管上皮、血管和其他中胚层组织;转移性肝癌多由肺、胃、乳腺、甲状腺、结直肠、胰腺等脏器癌细胞的转移造成[8]。
3.2 原发性肝癌与转移性肝癌病理改变及血流动力学的差异
由于肝脏的解剖及血供特点,因此对于原发性肝癌患者肝脏不但能够给肿瘤细胞更多的生长空间,还通过肝动脉和门静脉向肿瘤组织输送营养以维持肿瘤细胞的能量支持[9];然而转移性肝癌患者由于癌细胞的是由其他脏器转移而致病,大多肿瘤细胞的血供不如原发性肿瘤细胞良好。
3.3 CDFI与CEUS检查方法的优越性
临床上对于肝癌类型的鉴别诊断对后续治疗具有一定的指导意义,尤其对于转移性肝癌,只有确定了原发病灶的位置,才能够更为有效的采取治疗方案以控制患者的病情发展[10]。本研究结果显示两组患者经CDFI检查后,原发性肝癌组病灶内部及病灶周围血流信号的检出情况均要优于转移性肝癌组,诊断结果更为准确,统计学上有意义。由于肝脏的解剖及血供特点,加之转移性肝癌患者的癌细胞是由其他脏器转移而致病,因此血供不如原发性肿瘤细胞良好,故原发性肝癌患者肝部病灶内部及病灶周围血流信号多为Ⅱ级血流信号和Ⅲ级血流信号,在CDFI下见清晰的点状、细棒状及条状的血流信号,检出率也较高[11-12]。本研究还显示,原发性肝癌和转移性肝癌采用CEUS诊断结果与病理检查符合率都要稍高于采用CDFI的诊断结果,可能是受样本数量的限制,统计结果未见明显优势。但这也足够说明CEUS在诊断肝癌类型方面较CDFI更有临床价值。CEUS对肝癌病变进行鉴别诊断,给予患者静脉注射超声造影剂,这不但提高了患者肝脏周围凝血功能,造影剂的散射作用还能增强信号使影像学医生对患者血流功能和病灶边界有更清晰的诊断,提高诊断准确率[13-14]。CEUS技术能够清楚辨别变薄的受累血管壁,为临床诊断提供了更加高标准、高质量的图像[15]。此外,该技术在成像过程中,有效避免了特异性低、敏感性低的缺陷,清晰的成像质量可以对患者的肝脏肿瘤细胞进行早期发现,早期诊断可有效控制疾病的发展,使患者得到优质的医疗护理服务[16-17]。CEUS技术较CDFI技术对腹部病变患者的确诊率要高[18-19]。CEUS技术的高准确率对疾病的及早发现并对其进行治疗有巨大意义,为治疗疾病争取更多时间,在挽救患者生命的基础上,提高患者生存质量[20]。

表2 两组患者经CDFI检查后“病灶周围”血流信号的检出情况的比较(例)
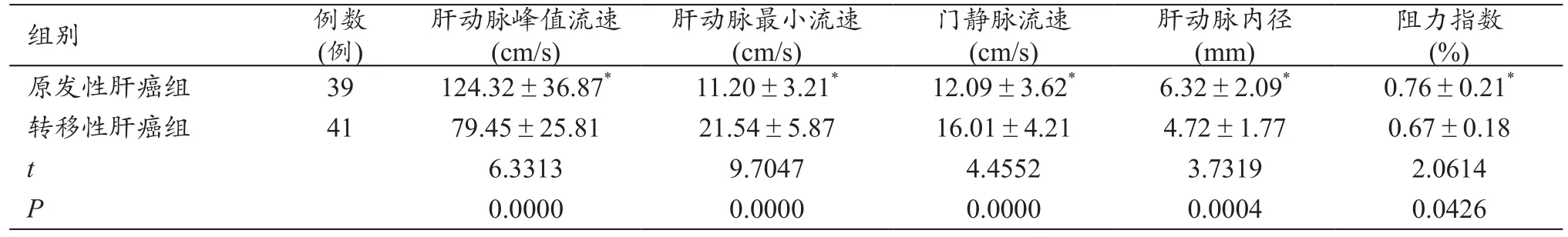
表3 两组患者经CDFI检查后周遭血流情况的比较(x-±s)
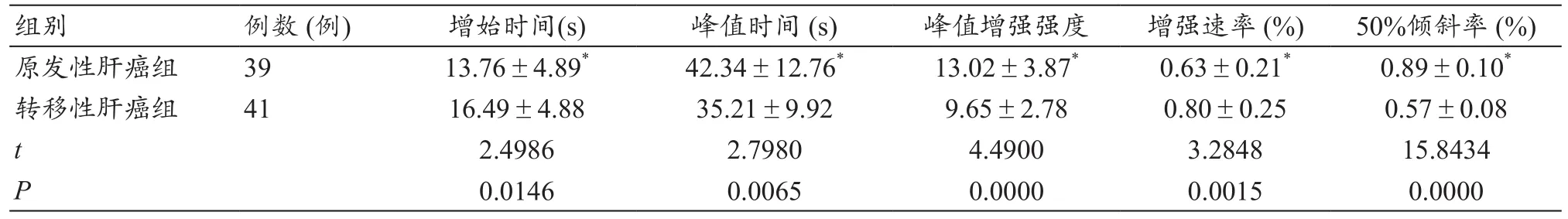
表4 两组患者经CEUS检查的造影全过程各项指标情况的比较(x-±s)

表5 不同诊断方法的临床诊断情况
总之,原发性肝癌与转移性肝癌相比,采用CDFI与CEUS检查,具有明显的血流信号,造影过程中各项指标也更为显著;CDFI及CEUS与术后病理诊断的符合率相近,无统计学意义,均可作为诊断的有效方法,对鉴别诊断原发性肝癌及转移性肝癌的有更高的临床价值。
[1] 许东,王耀东,何其舟,等.肝脏少见类型原发性肝癌的MSCT表现和病理基础[J].实用放射学杂志,2016,32(9).
[2] Moschouris H,Malagari K,Gkoutzios P,et al.Intermediate and advanced hepatocellular carcinoma treated with the antiangiogenic agent sorafenib.Evaluation with unenhanced and contrast-enhanced ultrasonography[J].Med Ultrason,2012,14(2):87-94.
[3] 虞梅,梅琪,倪娟,等.肝超声造影监测和早期诊断微小肝癌的应用价值[J].中国癌症杂志,2014,24(3):203-207.
[4] 谌奎芳,李峰.常规超声结合彩色多普勒能量图和弹性成像在小肝癌中的诊断价值[J].当代医学,2013,19(13):65-66.
[5] 李传刚,吴凤林,李颖嘉,等.彩色多普勒超声对原发性肝癌患者放疗后的疗效评估[J].现代预防医学,2012,39(11):2809-2810.
[6] Seitz K,Bernatik T,Strobel D,et al.Contrast-enhanced ultrasound(CEUS) for the characterization of focal liver lesions in clinical practice (DEGUM multicenter trial): CEUS vs.MRI-a prospective comparison in 269 patients[J].Ultraschall Med,2010,31(5):492-499.
[7] 王晓东,梁群兴,赵萍.超声造影和彩色多普勒超声在原发性肝细胞肝癌诊断中的应用[J].广东医学,2013,34(12):1869-1871.
[8] 钱晓莉,司芩,黄声稀,等.转移性肝癌的超声造影灌注特征及其临床价值[J].中国超声医学杂志,2013,29(2):134.
[9] 滕瑞军,陈虎,黄儒飞.血清总胆汁酸测定在肝病诊断中的价值分析[J].转化医学电子杂志,2015,2(3):113-114.
[10] Sporen I,Badea R,Martie A,et al.Contrast enhanced ultrasound for the evaluation of focal liver lesions in daily practice multicentre study[J].Med Ultrason,2012,14(2):95-100.
[11] 王彦东,经翔,丁建民,等.动态三维超声造影评价肝癌血流分布的应用研究[J].中国超声医学杂志,2013,29(10):910.
[12] Quaia E,Lorusso A,Grisi G,et al.The role of CEUS in the characterization of hepatocellular nodules detected during the US surveillance program-current practices in Europe[J].Ultraschall Med,2012,33(1):S48-S56.
[13] 张丽平,王永莉,刘燕,等.彩色多普勒超声和超声造影诊断小肝癌的临床应用价值[J].中国现代医生,2014,52(29):54-56.
[14] 陈琼,司芩,钱晓莉,等.小肝癌的超声造影特征及其与病理分化程度相关性的临床研究[J].临床肿瘤学杂志,2014,19(4):342-345.
[15] Rodriguez-Peralvarez M,Luong TV,Andreana L,et al.A systematic review of microvascular invasion in hepatocellular carcinoma:diagnostic and prognostic variability[J].Ann Surg Oncol,2013,20(1):325-339.
[16] 刘洋.三维彩色多普勒超声与超声造影鉴别原发性肝癌与转移性肝癌诊断的比较[J].中国老年学杂志,2016,36(7):1708-1710.
[17] 韦柳,李智贤,彭涛,等.超声造影对不同病理类型及分化程度原发性肝癌的诊断价值[J].中华肝脏病杂志,2012,20(12):939.
[18] 周薪传,智慧,肖晓云,等.超声弹性成像与超声造影对肝脏良恶性病灶的诊断价值探讨[J].中国超声医学杂志,2013,29(2):137-139.
[19] Salvatore V,Borghi A,Sagrini E,et al.Quantification of enhancement of focal liver lesions during contrast-enhanced ultrasound (CEUS). Analysis of ten selected frames is more simple but as reliable as the analysis of the entire loop for most parameters[J].Eur J Radiol,2012,81(4):709-713.
[20] 张莉,刘德英.37例原发性肝癌彩色多普勒超声表现及特点分析[J].中国实验诊断学,2015,19(7):1085-1087.

