外源MeJA对花后干旱胁迫下小麦光合特性的影响
马 超,张 均,王学平,贾琦石,原佳乐,张 苏,冯雅岚
(1.河南科技大学农学院,河南洛阳 471023;2.河南省新安县农业局,河南新安 471800)
随着全球气候的不断恶化,干旱发生的频率和程度都将大幅增加,原本一些非干旱地区也将遭受不可预测干旱的影响[1-2]。干旱胁迫是所有逆境中最复杂、涉及生理生化过程最多的逆境胁迫之一,任何时候发生的干旱胁迫,都将影响作物生长发育并对产量造成严重威胁[3]。据估测,干旱胁迫对谷物产量造成的损失超过其他环境胁迫的总和[4]。小麦籽粒在开花后形成并逐渐充实,籽粒干物质的70%~90%来自开花后积累的光合产物,也就是说灌浆过程中小麦光合特性对最终产量起决定作用[5]。随着籽粒灌浆进程的推进,小麦叶片的衰老程度也在不断加剧,特别是在有效水分供给不足的条件下,植株早衰将严重发生[6]。虽然用于光合作用的水分仅占植株水分吸收量的一少部分,植株吸收的水分大部分都通过蒸腾作用散失了,但水的间接作用很大。相关研究表明,干旱胁迫已经成为抑制作物光合作用的主要环境因子[6]。
茉莉酸类物质(JAs)作为一种信号分子,广泛参与高等植物响应各种生物胁迫和非生物胁迫[7]。具有挥发性的茉莉酸甲酯(MeJA)最初是从大花茉莉(Jasminumgrandiflorum)的花中分离并鉴定的[8]。随后的研究发现,JAs在高等植物的种子发育、根系生长、开花、果实成熟和衰老等过程中都具有重要的调控作用[9]。大量研究证明,在干旱胁迫下许多植物的内源JAs含量会显著增加,施用外源JAs也可以通过调节相关基因的表达来增强植物的抗旱性[10-12]。外源JAs能够增强作物抗氧化和渗透调节能力,并通过调节气孔关闭来减少水分的散失,从而缓解干旱胁迫对植物产生伤害,提高其抗旱性。在水稻、棉花、大豆、烟草等农作物及花卉、果树等植物上的相关研究也取得了较好的结果[13-16]。目前,外源MeJA对缓解干旱胁迫下小麦的生长发育、产量形成及逆境响应的研究还不多,尤其是针对花后干旱胁迫下对其光合特性的研究鲜见报道。本研究以产量形成的关键时期(灌浆期)进行干旱胁迫,系统分析外源MeJA对干旱胁迫下小麦光合色素含量、气体交换参数、叶绿素荧光参数及叶黄素循环的影响,以期为外源MeJA在小麦抗旱栽培中的合理利用提供依据。
1 材料与方法
1.1 供试材料
试验于2016年10月至2017年6月在河南科技大学农场实施。试验采用盆栽(深18 cm、直径25 cm的塑料盆)方法,以精确控制土壤水分含量。先取大田耕层土壤并晾晒风干,去除碎石及杂草备用。土壤中全氮含量0.156%,碱解氮含量49.1 mg·kg-1,有效磷含量47.3 mg·kg-1,速效钾含量为101.3 mg·kg-1,有机质含量为1.71%。每盆装入20 kg备用土壤,并拌入1.5 g复合肥(N-P2O5-K2O,20-25-5)。供试小麦品种为周麦18,每盆种植15株,盆子埋于大田,顶部边沿与外部土壤齐平,底部垫一层塑料布,防止大田水分反渗回盆中。2016年10月18日播种,每盆浇2 L蒙头水以促进种子萌发。发芽后7 d间苗,每盆留健壮的麦苗10株。视盆内土壤水分情况每隔几天浇一次水,每次浇水2 L,拔节期随灌水每盆追施尿素1.5 g,其他栽培措施同一般高产田。
1.2 试验处理
干旱胁迫以控水的方式于2017年4月1日开始,到扬花期控制达到试验要求。设正常灌水和干旱胁迫两个水分处理(分别用N和D代表),土壤水分分别保持田间最大持水量的85%~80%和55%~50%。为了精确控制土壤水分含量,扬花期后每隔1 d在18:00将塑料盆取出并称重,浇入蒸发损失的水分直到小麦成熟。为了避免降雨对试验造成的误差,下雨前将简易防雨棚塑料布放下进行遮雨。MeJA从2017年4月15日(挑旗期)连续喷施3 d,设置0 μmol·L-1(CK)和0.25 μmol·L-1(M)两个浓度水平(浓度经过预备实验筛选确定),溶液中包含0.5%的吐温-20,喷施标准以喷透冠层叶片且保证液体不下滴为宜。试验形成四个处理,即N+CK、N+M、D+CK和D+M。分别于挑旗期(S1)、开花期(S2)、花后10 d(S3)和花后25 d(S4)进行样品采集及指标测定。
1.3 测定项目及方法
1.3.1 光合色素及叶黄素循环组分含量的测定
光合色素及叶黄素循环组分含量用液相色谱(HPLC)法参照赵世杰等[17]的方法测定。在弱光条件下将小麦旗叶在液氮中研磨并用100%丙酮提取色素,于4 ℃ 10 000 r·min-1条件下离心10 min。用滤膜过滤后保存于-20 ℃待测。进样量为10 μL。色谱柱为Spherisorb C185U,流动相流速为5 mL·min-1。流动相A溶液为0.05 mmol·L-1的乙腈∶甲醇∶Tris盐酸(72∶8∶3)缓冲液,B溶液为甲醇∶正己烷(5∶1)。叶绿素a检测波长为428 nm,其他组分为448 nm,分析时间约50 min。色素含量根据峰的面积计算。
1.3.2 气体交换参数的测定
在晴朗无风的上午9:00至中午11:30,用美国产的便携式光合仪(LI-6400,LI-COR,Lincoln,NE,USA)测定旗叶气体交换参数,包括净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)、气孔导度(Gs)和叶片表面温度(LT)。将有效光合辐射设置为1 000 μmol·m-2·s-1,CO2流速设置为330~360 μmol·mol-1,叶室温度设置为28 ℃,叶室相对湿度设置为50%~55%。叶片瞬时水分利用效率(WUE)用Pn/Tr比值表示。
1.3.3 荧光参数的测定
在测定气体交换参数的同时,用英国Hansateach公司生产的FMS-2型脉冲式调制荧光仪,在晴朗无云的天气,选择朝向一致的小麦旗叶进行叶绿素荧光参数的测定。根据Van Kooten的方法[18],测定初始荧光(Fo)、最大荧光(Fm),计算可变荧光Fv=Fm-Fo、PSⅡ潜在活性Fv/Fo、PSⅡ最大光化学效率Fv/Fm、PSⅡ实际光化学效率ΦPSⅡ=(Fm′-Fs)/Fm′、非光化学淬灭系数NPQ=(Fm-Fm′)/Fm′;光能利用率(LUE)=光合速率/有效光合辐射。
1.4 数据统计与分析
试验数据均用Excel 2003及SPSS 11.0软件进行统计分析,多重比较采用Ducan法,所有图表中数据均为3次重复的平均值。
2 结果与分析
2.1 外源MeJA对花后干旱胁迫下小麦旗叶光合色素含量的影响
随着生育进程的推进,小麦旗叶叶绿素a、叶绿素b、叶绿素a+b、叶黄素及β-胡萝卜素含量均呈先升后降的趋势,叶绿素a/b的变化则相反(表1)。N+M处理下叶绿素a、叶绿素b、叶绿素a+b含量从挑旗期至开花期低于N+CK处理,而从花后10 d至花后25 d显著高于N+CK;D+CK和D+M处理则显著低于N+CK,但D+M处理在整个灌浆期均显著高于D+CK处理;叶绿素a/b除了挑旗期的N+M处理略高于N+CK处理外,其余生育时期均表现为D+CK>D+M> N+CK> N+M;N+M处理的叶黄素含量在花后25 d显著高于N+CK处理,其余生育时期差异不显著,而D+CK和D+M处理在各时期均显著低于N+CK处理,且D+M处理显著高于D+CK处理;β-胡萝卜素含量在N+M和D+M处理下均显著高于N+CK处理,且N+M>D+M,而D+CK处理与N+CK处理差异不显著。这说明外源MeJA能够缓解干旱条件下光合色素含量的下降,有利于光合作用。
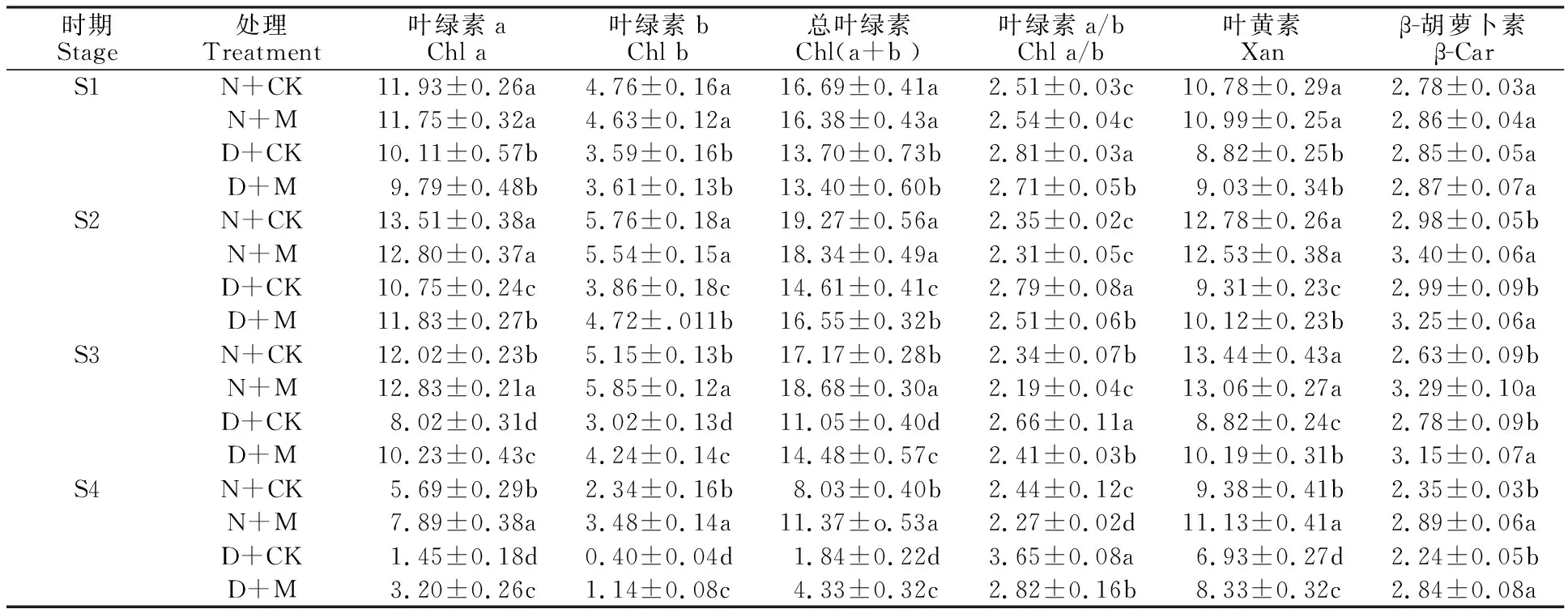
表1 外源MeJA对花后干旱胁迫下小麦旗叶光合色素含量的影响Table 1 Effects of exogenous MeJA on photosynthetic pigment content in wheat flag leaf under drought stress after anthesis mg·g-1DW
同列不同小写字母表示同一时期的不同处理之间差异显著(P<0.05)。下表同。
Different small letters in the same column mean significant difference among treatments within the same growth stage at 0.05 level. The same in following tables.
2.2 外源MeJA对干旱胁迫下小麦旗叶叶黄素循环的影响
叶黄素循环及其组分在植物光破坏防御中起重要作用。植物叶黄素循环有紫黄质( violaxanthin,V)、花药黄质( antheraxanthin,A)和玉米黄质( zeaxanthin,Z)三种组分,在黑暗和弱光下以紫黄质为主,在光能过剩时紫黄质向另外两种组分转换。由图1可知,随着生育进程的推进,小麦旗叶(V+A+Z)含量呈先升后降的趋势。干旱胁迫显著增加了(V+A+Z)含量,这可能是植物在逆境条件下自我适应的结果。外源MeJA在非干旱和干旱胁迫条件下均显著增加了(V+A+Z)的含量。(A+Z)/(V+A+Z)值与(V+A+Z)含量的变化趋势类似,外源MeJA仅在花后25 d显著增加了干旱胁迫下小麦叶片的(A+Z)/(V+A+Z) 值,而在非干旱条件下,从开花期开始就显著增加了小麦叶片的(A+Z)/(V+A+Z)值。由此可见,外源MeJA有利于干旱胁迫下小麦叶片的热耗散,从而保护了光合机构被破坏程度,在一定程度上维持了光合作用。

图柱上的不同小写字母表示同一时期的不同处理之间差异显著(P<0.05)。下图同。
Different small letters on the columns mean significant difference among the treatments within the same growth stage at 0.05 level. The same in the following figures.
图1外源MeJA对花后干旱胁迫下小麦旗叶叶黄素循环的影响
Fig.1EffectofexogenousMeJAonxanthophyllcycleofwheatflagleafunderdroughtstressafteranthesis
2.3 外源MeJA对干旱胁迫下小麦旗叶叶绿素荧光参数的影响
小麦旗叶Fo和ΦPSⅡ随着生育进程呈先升后降的趋势,而Fv/Fo和Fv/Fm呈逐渐降低趋势(表2)。与N+CK处理相比,干旱胁迫(D+CK)显著促进了Fo上升,但使Fv/Fo、Fv/Fm和ΦPSⅡ均显著降低。在非干旱条件下,N+M处理的Fo在挑旗期和花后25 d显著高于N+CK处理,而在开花期至花后10 d显著低于N+CK处理;在干旱条件下,喷施MeJA显著促进Fo降低。在非干旱条件下,与N+CK处理相比,N+M处理的Fv/Fo和Fv/Fm在挑旗期显著降低,而ΦPSⅡ变化不显著;Fv/Fo、Fv/Fm和ΦPSⅡ在开花期变化均不显著;在花后10 d,Fv/Fo和Fv/Fm显著升高,而ΦPSⅡ变化不显著;在花后25 d,Fv/Fo、Fv/Fm和ΦPSⅡ均显著升高。在干旱条件下,喷施MeJA在挑旗期至花后10 d对Fv/Fo、Fv/Fm和ΦPSⅡ影响不大,但在灌浆后期均有显著促进作用。
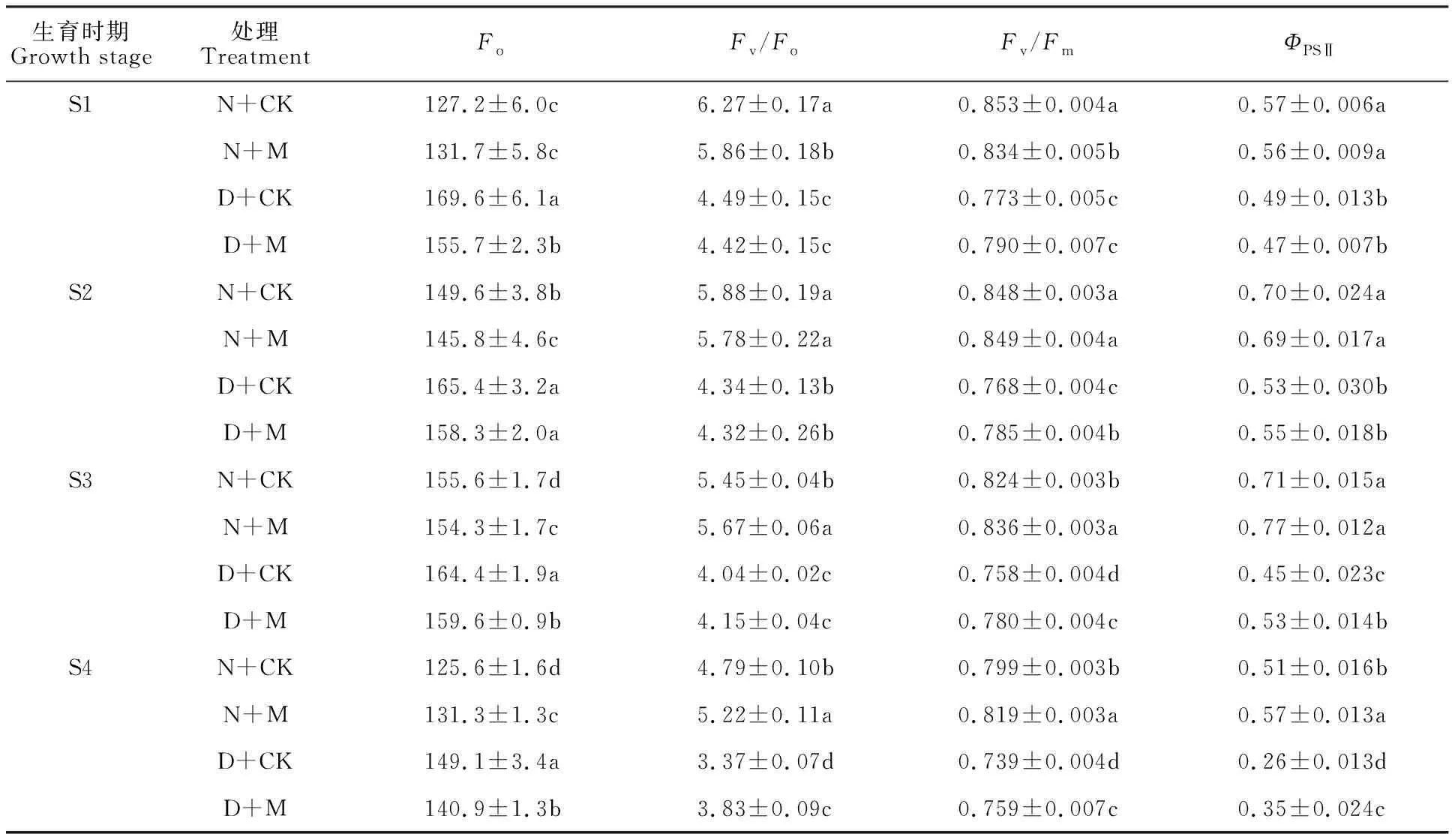
表2 外源MeJA对干旱胁迫下小麦旗叶叶绿素荧光参数的影响Table 2 Effect of exogenous MeJA on chlorophyll fluorescence parameters inwheat flag leaf under drought stress after anthesis
2.4 外源MeJA对干旱胁迫下小麦旗叶NPQ和LUE的影响
小麦旗叶的NPQ随着生育进程的推进呈逐渐升高趋势(图2),干旱胁迫显著促进了NPQ升高。在非干旱条件下,喷施MeJA显著降低了挑旗期的NPQ,而花后25 d却显著升高NPQ,其余时期则影响不显著。在干旱条件下,外源MeJA能显著增加从开花期至花后25 d的NPQ,使挑旗期的NPQ也小幅增加,但影响不显著。
小麦旗叶的LUE随着生育进程的推进呈先增后降的趋势,干旱胁迫使LUE显著降低(图2)。在非干旱条件下,外源MeJA显著降低了挑旗期至开花期的LUE,而在花后25 d却显著增加了LUE。在干旱条件下,外源MeJA在挑旗期降低了LUE,而在花后10 d至花后25 d却使LUE显著升高。这表明外源MeJA可减轻干旱胁迫对小麦光化学反应的抑制作用,促进光能利用。
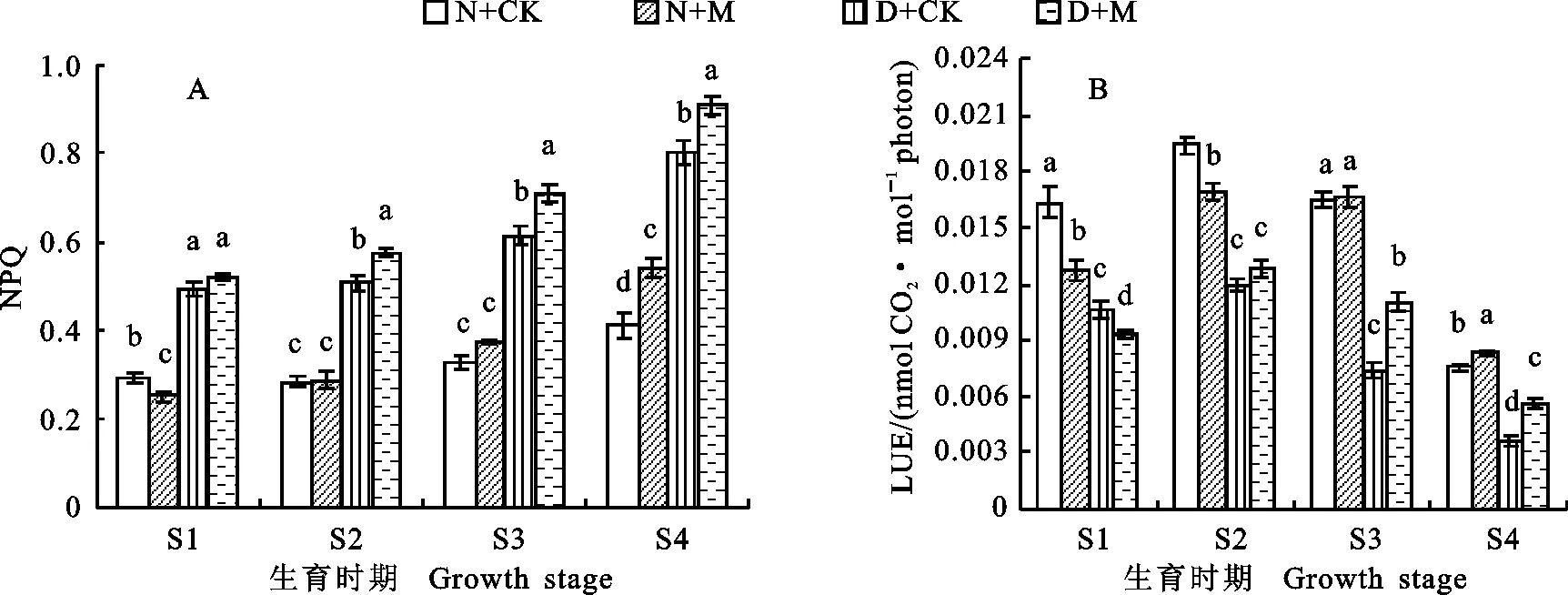
图2 外源MeJA对干旱胁迫下小麦旗叶NPQ(A)和LUE(B)的影响Fig.2 Effect of exogenous MeJA on NPQ and LUE of wheat flag leaf under drought stress after anthesis
2.5 外源MeJA对干旱胁迫下小麦旗叶气体交换参数的影响
小麦旗叶Pn、Gs、Tr和WUE随着生育进程呈先升后降的趋势,Ci则完全相反,呈先降后升的趋势,而LT呈逐渐升高的变化趋势(表3)。与N+CK处理相比,干旱胁迫后Pn、Gs、Tr和WUE显著降低,而Ci和LT则显著升高。非干旱条件下,与N+CK处理相比,喷施MeJA后,在挑旗期至花后10 d,Pn、Gs和Tr显著降低(Pn在花后10 d变化不显著),而在花后25 d变化不显著;LT在挑旗期至开花期显著增大,在花后10 d至花后25 d变化不显著;Ci仅在开花期变化不显著,其余时期显著降低,而WUE同样在开花期变化不显著,其余时期与Ci规律相反。在干旱条件下,喷施MeJA后,灌浆中后期(S3-S4)Pn和Ci分别显著增大和降低,在挑旗期至开花期变化均不显著;Gs在挑旗期显著降低,而在灌浆中后期(S3-S4)又显著升高;LT与Gs规律相反,但在开花期至花后10 d变化不显著;Tr仅在开花期显著升高,在其他时期变化不显著;WUE显著提高。说明外源MeJA可减少干旱胁迫下小麦叶片水分散失,促进CO2同化,提高光合能力。

表3 外源MeJA对花后干旱胁迫下小麦气体交换参数及叶温和水分利用效率的影响Table 3 Effects of exogenous MeJA on gas exchange parameters and relevantparameters in wheat under drought stress after anthesis
3 讨 论
3.1 外源MeJA对干旱胁迫下小麦质体色素含量及叶黄素循环的影响
光合作用是作物干物质积累和产量形成的重要生理过程,也是叶肉细胞中的色素分子通过光系统(PSI和PSII)将光能转化为化学能的过程[19]。大量研究表明,任何生育时期尤其是水分临界期发生的干旱胁迫,都会造成作物叶片萎蔫、早衰,并使光合结构受损,将导致减产甚至绝收[20]。本研究结果表明,干旱胁迫使小麦旗叶叶绿体色素和叶黄素含量显著降低,而使β-胡萝卜素略微增加,这与范敏等的研究结果一致[21]。外源MeJA使挑旗期叶绿素a含量略微降低,但在整个灌浆期都显著提高了叶绿素含量;同时,外源MeJA可以显著增加小麦叶片β-胡萝卜素含量,这将有利于增强干旱胁迫下小麦叶片光合机构的稳定性,这可能是其抗旱性得到加强的重要原因[22]。外源MeJA在整个灌浆期间促使叶绿素a/b比值下降,说明外源MeJA有利于缓解干旱胁迫下叶绿素b的降解速度,从而使小麦叶片在捕光能力方面得到改善,特别有利于提高清晨或傍晚弱光条件时的光能利用率。
3.2 外源MeJA对干旱胁迫下小麦叶黄素循环的影响
植物叶片在逆境条件下的衰老主要是由氧化胁迫引起的[23]。当叶片叶绿素吸收的光能超过了植物光合作用的消耗能力时,就会产生大量过剩的激发能,进而引发光氧化现象并发生光抑制,严重时还会不可逆地破坏光合器官和光合机构[24]。植物会通过减少光能的吸收、增强光能的利用和促进光能的耗散等方式将过剩光能以热能形式耗散掉,以尽可能地缓解因光氧化而造成的叶片衰老[25]。除了β-胡萝卜素之外,叶黄素循环在热耗散过程中也起着十分重要的作用[26-27]。本研究中,外源MeJA能够增加小麦叶黄素循环组分(V+A+Z)的含量,并增强(A+Z)在(V+A+Z)库中的比例,因此显著增强了叶黄素组分耗散过剩能量的能力,缓解了叶片的衰老。
3.3 外源MeJA对干旱胁迫下小麦荧光参数的影响
叶绿素荧光参数能反映植物叶片对光能的激活、吸收、转换及PSⅡ的光化学反应效率[28]。Fo的大小与光合色素的含量和PSⅡ的受损状况有密切关系,光合色素含量降低,Fo降低;而PSⅡ受到损伤时,Fo明显升高[29]。大量研究表明,干旱胁迫能引起Fo上升和Fv的下降,并提高玉米黄质(Z)的光保护作用,从而降低PSⅡ光化学效率(Fv/Fm)[30]。本研究也得到类似结果:干旱胁迫促进了Fo的上升,而PSⅡ潜在活性(Fv/Fo)、PSⅡ最大光化学效率(Fv/Fm)和PSⅡ实际光化学效率(ΦPSⅡ)均呈显著降低的趋势,这说明光合系统发生了光抑制现象,光合电子传递受到限制,叶绿体膜复合体将吸收的光能转化为化学能的能力发生改变,使叶绿体量子产额下降[31]。外源MeJA能显著缓解Fv/Fo、Fv/Fm和ΦPSⅡ在干旱胁迫下的降低,这说明外源MeJA能够缓解干旱胁迫对小麦叶片PSⅡ反应中心的伤害,电子传递速率和光能转换效率都得到改善。NPQ反映了PSⅡ天线色素吸收但不能用于光合电子传递而是以热的形式耗散的部分[32]。本研究表明,干旱胁迫显著提高了非光化学淬灭系数(NPQ),说明干旱胁迫导致小麦叶片吸收的光能用于光化学反应的比例降低,这也是光合系统对干旱胁迫产生的一种应激自我保护[29],因而导致LUE显著降低。干旱胁迫下外源MeJA显著增加了灌浆期间的NPQ,这说明外源MeJA显著增加了PSⅡ反应中心的开放比例,对灌浆中后期的LUE有显著的促进作用。
3.4 外源MeJA对干旱胁迫下小麦气体交换参数的影响
干旱胁迫会影响植物生长发育,阻碍生物量的积累,最终导致花的败育并影响产量[4]。这是因为干旱胁迫诱导的气孔关闭阻碍了气体交换,对光合作用的正常进行产生严重的阻碍[32]。本研究表明,干旱胁迫显著降低了小麦旗叶Pn。前人研究发现,外源MeJA能提高作物光合速率而减轻干旱胁迫对其生长的抑制[13,16],这与本研究结果一致。在本研究中,Pn的降低伴随着Ci的升高,说明本研究条件下Pn的降低主要是非气孔限制因素造成的[33]。外源MeJA使Gs和Ci均显著降低,说明MeJA显著缓解了干旱胁迫对光系统的破坏。干旱胁迫下气孔的关闭可以阻碍水分因蒸腾作用的散失[34]。外源MeJA可以诱导气孔关闭,进一步缓解了植株水分的散失[35-36]。干旱条件下作物叶片Pn的降低还与光合作用暗反应中碳素同化效率降低有关;这些都与作物遭受干旱胁迫的程度、胁迫时间以及作物的种类有关[37],但其内在机理还有待于进一步阐明。
综上所述,干旱胁迫下小麦质体色素(叶绿素a、叶绿素b和叶黄素)含量显著降低,Ci、LT、Fo和NPQ显著升高,Pn、Gs、E、Fv/Fo、Fv/Fm、ΦPSⅡ、LUE和WUE显著下降,叶黄素循环组分(V+A+Z)含量及叶黄素循环(A+Z)/(V+A+Z)都显著增加,导致小麦光合同化能力受到严重抑制;干旱胁迫下喷施MeJA有效促进了β-胡萝卜素的积累,保护了其他质体色素免受氧化降解,并通过调节Gs避免植株水分的进一步散失;同时,喷施MeJA通过增加叶黄素循环组分(V+A+Z)含量及叶黄素循环(A+Z)/(V+A+Z),在保持干旱胁迫下小麦叶片热耗散的同时,减小了光合机构的破坏程度,从而在一定程度上维持了小麦叶片的Pn、Fv/Fo、Fv/Fm和ΦPSⅡ,最终提高了LUE和WUE,因而缓解了干旱胁迫对小麦叶片光合同化能力的不良影响,增强了小麦的抗旱性。因此,在生产实践中可以考虑用MeJA作为化学调控剂来缓解干旱胁迫对小麦生产带来的不利影响。
参考文献:
[1] HU Y R,MASKEY S,UHLENBROOK S.Trends in temperature and rainfall extremes in the Yellow River source region,China [J].ClimaticChange,2012,110(1-2):403.
[2] CHEN C,WANG E L,YU Q,etal.Modelling the effects of climate variability and water management on crop water productivity and water balance in the North China Plain [J].AgriculturalWaterManagement,2010,97(8):1175.
[3] KRASENSKY J,JONAK C.Drought,salt,and temperature stress-induced metabolic rearrangements and regulatory networks [J].JournalofExperimentalBotany,2012,63(4):1593.
[4] LEWIS R G.What food crisis?:Global hunger and farmers’ woes [J].WorldPolicyJournal,2008,25(1):29.
[5] MA C,WANG Z Q,ZHANG L T,etal.Photosynthetic responses of wheat(TriticumaestivumL.) to combined effects of drought and exogenous methyl jasmonate [J].Photosynthetica,2014,52(3):377.
[6] 杨德龙,栗孟飞,刘 媛,等.干旱胁迫对小麦花后不同器官果聚糖代谢和转运的影响[J].麦类作物学报,2016,36(2):190.
YANG D L,LI M F,LIU Y,etal.Effect of drought stress on fructan metabolism and translocation in different organs of wheat after anthesis [J].JournalofTriticeaeCrops,2016,36(2):190-199.
[7] 刘庆霞,李梦莎,国 静.茉莉酸生物合成的调控及其信号通路[J].植物生理学报,2012,48(9):837.
LIU Q X,LI M S,GUO J.Regulation of jasmonic acid biosynthesis and jasmonic acid signaling pathway [J].PlantPhysiologyJournal,2012,48(9):837.
[8] CREELMAN R A,MULLET J E.Biosynthesis and action of jasmonates in plants [J].AnnualReviewofPlantBiology,1997,48:355.
[9] WASTERNACK C.Jasmonates:An update on biosynthesis,signal transduction and action in plant stress response,growth and development [J].AnnalsofBotany,2007,100(4):681.
[10] GAPPER N E,NORRIS G E,CLARKE S F,etal.Novel jasmonate amino acid conjugates inAsparagusofficinalisduring harvest-induced and natural foliar senescence [J].PhysiologiaPlantarum,2002,114(1):116.
[11] MAHOUACHI J,ARBONA V,GMEZ-CADENAS A.Hormonal changes in papaya seedlings subjected to progressive water stress and re-watering [J].PlantGrowthRegulation,2007,53(1):43.
[12] PEDRANZANI H,SIERRA-DE-GRADO R,VIGLIOCCO A,etal.Cold and water stresses produce changes in endogenous jasmonates in two populations ofPinuspinasterAit [J].PlantGrowthRegulation,2007,52(2):111.
[13] 董桃杏,蔡昆争,曾任森.干旱胁迫下茉莉酸甲酯对水稻叶片质膜透性及无机离子含量的影响[J].华北农学报,2010,25(1):136-140.
DONG T X,CAI K Z,ZENG R S.Effects of methyl jasmonate on membrane permeability and inorganic ions content in rice leaves under drought stress [J].ActaAgriculturaeBoreali-sinica,2010,25(1):136.
[14] 杨 艺,常 丹,王 艳,等.茉莉酸与茉莉酸甲酯预处理对干旱胁迫下棉花种子萌发和种苗生理特性的影响[J].西北植物学报,2015,35(2):302.
YANG Y,CHANG D,WANG Y,etal.Effects of JA and MeJA pretreatment on seed germination and seedling physiological characteristics ofGossypiumhirsutumunder drought stress [J].ActaBotanicaBoreali-Occidentalia,2015,35(2):302.
[15] ANJUM S A,TANVEER M,HUSSAIN S,etal.Exogenously applied methyl jasmonate improves the drought tolerance in wheat imposed at early and late developmental stages [J].ActaPhysiologiaePlantarum,2016,38(1):25.
[16] 金微微,王 炎,张会慧,等.茉莉酸甲酯对干旱及复水条件下烤烟幼苗叶绿素荧光特性的影响[J].应用生态学报,2011,22(12):3157.
JIN W W,WANG Y,ZHANG H H,etal.Effects of foliar spraying methyl jasmonate on leaf chlorophyll fluorescence characteristics of flue-cured tobacco seedlings under drought and re-watering [J].ChineseJournalofAppliedEcology,2011,22(12):3157.
[17] 赵世杰,孟庆伟,许长成,等.植物组织中叶黄素循环组分的高效液相色谱分析法[J].植物生理学通讯,1995,31(6):438.
ZHAO S J,MENG Q W,XU C C,etal.Analysis of the xanthophyll cycle components in plant tissues by high performance liquid chromatography [J].PlantPhysiologyCommunications,1995,31(6):438.
[18] KOOTEN O V,SNEL J F H.The use of chlorophyll fluorescence nomenclature in plant stress physiology [J].PhotosynthesisResearch,1990,25(3):147.
[19] 薛 娴,许会敏,吴鸿洋,等.植物光合作用循环电子传递的研究进展[J].植物生理学报,2017,53(2):145.
XUE X,XU H M,WU H Y,etal.Research progress of cyclic electron transport in plant photosynthesis [J].PlantPhysiologyJournal,2017,53(2):145.
[20] 赵燕昊,曹跃芬,孙威怡,等.小麦抗旱研究进展[J].植物生理学报,2016,52(12):1795.
ZHAO Y H,CAO Y F,SUN W Y,etal.The research advances in drought resistance in wheat [J].PlantPhysiologyJournal,2016,52(12):1795.
[21] 范 敏,金黎平,黄三文,等.干旱胁迫对马铃薯类黄酮和类胡萝卜素合成关键酶基因表达的影响[J].园艺学报,2008,35(4):535.
FAN M,JIN L P,HUANG S W,etal.Effects of drought on gene expression of key enzymes in carotenoid and flavonoid biosynthesis in potato [J].ActaHorticulturaeSinica,2008,35(4):535.
[22] 刘丽红.茉莉酸和油菜素甾醇调控番茄果实类胡萝卜素积累的机理研究[D].杭州:浙江大学,2015:3-4.
LIU L H.Regulation of carotenoids accumulation in tomato fruit by jasmonic acid and brassinosteroid [D].Hangzhou:Zhejiang University,2015:3-4.
[23] 刘 强,胡 萃,柳正葳,等.铝胁迫对烟草叶片光能利用、光保护系统及活性氧代谢的影响[J].华北农学报,2017,32(1):118.
LIU Q,HU C,LIU Z W,etal.Effects of aluminum stress on light energy utilization,photoprotective systems and reactive oxygen metabolism in leaves of tobacco seedlings [J].ActaAgriculturaeBoreali-Sinica,2017,32(1):118.
[24] MELIS A.Photosystem-II damage and repair cycle in chloroplasts:What modulates the rate of photodamage? [J].TrendsinPlantScience,1999,4(4):130.
[25] 李运丽,侯喜林,李志强,等.光强对紫罗勒花青素含量及光合特性的影响[J].华北农学报,2011,26(3):231.
LI Y L,HOU X L,LI Z Q,etal.Effects of light intensity on anthocyanins contents and photosynthetic characteristics in purple basil(OcimumbasilicumL.) leaves [J].ActaAgriculturaeBoreali-Sinica,2011,26(3):231.
[26] 赵 霞,杨华伟,刘然方,等.水稻热耗散对逆境的响应[J].中国水稻科学,2016,30(4):431.
ZHAO X,YANG H W,LIU R F,etal.Responses of heat dissipation in rice to stress [J].ChineseJournalofRiceScience,2016,30(4):431.
[27] 孙 艳,徐伟君,范爱丽.高温强光下水杨酸对黄瓜叶片叶绿素荧光和叶黄素循环的影响[J].应用生态学报,2006,17(3):399.
SUN Y,XU W J,FAN A L.Effects of salicylic acid on chlorophyll fluorescence and xanthophyll cycle in cucumber leaves under high temperature and strong light [J].ChineseJournalofAppliedEcology,2006,17(3):399.
[28] 张守仁.叶绿素荧光动力学参数的意义及讨论[J].植物学通报,1999,16(4):444.
ZHANG S R.A discussion on chlorophyll fluorescence kinetics parameters and their significance [J].ChineseBulletinofBotany,1999,16(4):444.
[29] 吴金芝,王志敏,李友军,等.不同冬小麦品种旗叶叶绿素荧光特性及其对干旱胁迫的响应[J].麦类作物学报,2015,35(5):699.
WU J Z,WANG Z M,LI Y J,etal.Flag leaf chlorophyll fluorescence characteristics and its response to drought stress in different cultivars of winter wheat [J].JournalofTriticeaeCrops,2015,35(5):699.
[30] XU C C,LI D Q,ZOU Q,etal.Effect of drought on chlorophyll fluorescence and xanthophyll cycle components in winter wheat leaves with different ages [J].ActaPhytophysiologicaSinica,1999,25(1):29.
[31] 吴长艾,孟庆伟,邹 琦.叶黄素循环及其调控[J].植物生理学通讯,2001,37(1):1.
WU C A,MENG Q W,ZOU Q.The xanthophyll cycle and its regulation [J].PlantPhysiologyCommunications,2001,37(1):1.
[32] 李立辉,王 岩,胡海燕,等.初花期干旱对不同抗旱性紫花苜蓿光合特征及荧光参数的影响[J].华北农学报,2015,30(4):126.
LI L H,WANG Y,HU H Y,etal.Responses of photosynthetic characters and fluorescence parameters of alfalfa with different drought tolerances to drought [J].ActaAgriculturaeBoreali-Sinica,2015,30(4):126.
[33] FARQUHAR G D,SHARKEY T D.Stomatal conductance and photosynthesis [J].AnnualReviewsofPlantPhysiology,1982,33:317.
[34] 杨泽粟,张 强,郝小翠.自然条件下半干旱雨养春小麦生育后期旗叶光合的气孔和非气孔限制[J].中国生态农业学报,2015,23(2):174.
YANG Z S,ZHANG Q,HAO X C.Stomatal or non-stomatal limitation of photosynthesis of spring wheat flag leaf at late growth stages under natural conditions in semiarid rainfed regions [J].ChineseJournalofEco-Agriculture,2015,23(2):174.
[35] 兰彦平,周 军,曹 慧,等.茉莉酸对苹果气孔运动及抗旱性的影响[J].果树学报,2001,18(3):133.
LAN Y P,ZHOU J,CAO H,etal.Effect of jasmonic acid on the leaf stomatal movement and drought resistance of young apple trees [J].JournalofFruitScience,2001,18(3):133.
[36] 支金虎,马永清.双氢茉莉酸丙酯对不同小麦品种气体交换性状的影响[J].安徽农业科学,2007,35(19):5705.
ZHI J H,MA Y Q.Effect of prophyl dihydro jasmonate on gas exchange characters of different wheat varieties [J].JournalofAnhuiAgriculturalSciences,2007,35(19):5705.
[37] 魏爱丽,王志敏,陈 斌,等.土壤干旱对小麦绿色器官光合电子传递和光合磷酸化活力的影响[J].作物学报,2004,30(5):487.
WEI A L,WANG Z M,CHEN B,etal.Effect of soil drought on electron transport rate and photophosphorylation level of different green organs in wheat [J].ActaAgronomicaSinica,2004,30(5):487.

