木犀草素氨基醌抑菌活性和酶抑制活性
王 建,陶传洲,孙 威,苏珍妮,王 丽,史天智,马晓东,刘玮炜,史大华,朱 强
(1.淮海工学院 化工学院,江苏 连云港 222005;2.淮海工学院 药学院,江苏 连云港 222005;3.淮海工学院 研究生处,江苏 连云港 222005;4.淮海工学院 海洋生命与水产学院,江苏 连云港 222005)
木犀草素1普遍存在于植物中,具有多种生化和药理作用[1],化学名为3′,4′,5,7-四羟基黄酮,各个环上酚羟基活性相差较大,B环酚羟基活性最高,C环为色原酮结构,其上的羟基活性其次,A环酚羟基活性最弱。因此,在木犀草素的结构中,使其具有生理活性的是A环和B环上的酚羟基和C环上的α、β-不饱和环酮结构。目前,对木犀草素结构修饰主要集中在对 C2、C3、C6、C8、C3′(或 C5′)和C4′等位进行的化学改性,引入卤素、烷氧基、芳基、吡啶基、氨基、羧基、磺酸基和磷酸基等基团来改善溶解性,提高生物活性和生物利用度。杨洋等[2]测定了花生壳木犀草素的抑菌特性,结果表明:木犀草素对伤寒沙门氏菌、金黄色葡萄球菌、枯草芽孢杆菌和痢疾杆菌表现出抑菌活性,对啤酒酵母有抑制作用,而对大肠杆菌无效;其抑菌活性强于同质量浓度的山梨酸和亚硝酸钠。周建新等[3]研究了不同溶剂及辅助方法对木犀草素含量及金黄色葡萄球菌抗菌作用的影响,结果表明:随着木犀草素质量浓度的增加,抗菌作用越显著。
目前,国内外都是在不损害木犀草素活性的基础上,通过化学方法进行结构修饰,或通过衍生化反应改变其溶解度,或引入亲水基团以提高水溶性[4]。沙靖全等[5]以木犀草素和磺胺甲恶唑进行缩合反应制成新的黄酮席夫碱化合物,并以此为配体合成了新的金属配合物,进行抗菌活性实验。结果表明:配体和配合物都对金黄葡萄球菌B1、大肠杆菌B2、白色念珠菌B3、枯草杆菌B4和变形杆菌B5等菌株有明显的抑菌活性,且优于各自的母体,形成配合物后抑菌活性大大增强。周美荣等[6]以木犀草素为先导化合物,利用二甲苯诱发小鼠耳廓肿胀模型对所合成的7个8-氨甲基化衍生物进行抗炎活性的药理筛选,结果表明:部分化合物具有良好的抗炎活性,能明显减轻二甲苯致小鼠耳廓炎症反应,肿胀度与阴性组比较具有显著差异性,其活性亦高于母体化合物木犀草素的活性。
木犀草素为多酚分子,在其6′位引入氨基未见报道。笔者通过控制一定酸度,用空气将木犀草素氧化为相应的邻醌化合物[7],再由α,β-不饱和羰基与氨基化合物进行亲核加成反应,将脂肪族伯、仲胺氨基结构单元引入木犀草素醌环(B环)上6′位,既起到增强药效的作用,又可以对整个分子的脂/水分布系数作出调整,影响先导化合物的药代动力学参数,并做出改善。
关于阿尔茨海默症(Alzheimer′s disease,AD)的治疗大多离不开胆碱能学说[8]。按照胆碱酯酶(cholinesterase,ChE)对底物特异的催化作用,将其分为2种,第一种是乙酰胆碱酯酶(AChE),第二种是丁酰胆碱酯酶(BuChE)。不过目前已经批准上市的乙酰胆碱酯酶抑制剂药物有很多局限性。李俊杰[9]通过临床治疗发现:患者长期服用乙酰胆碱酯酶抑制剂类药物出现不良反应时,将药物换作双重胆碱酯酶抑制剂,病情会稳定下来,认知水平也会得到很好的控制。所以,改善AD患者的临床治疗可以从发展特异性的丁酰胆碱酯酶抑制剂或双重ChE抑制剂着手。美国 FDA已批准通过的用于治疗AD的药物仅有一类,即AChE抑制剂。目前已经批准上市的有4种药物都包含生物碱类化合物[10]。但是它们都有许多副作用,比如半衰期短,容易造成患者胃、肝不适等,故其广泛应用受到很大限制。因此,从天然植物及其衍生物中发掘出可以根除疾病、毒副作用小的乙酰胆碱酯酶抑制剂是当前主要的研究方向。探寻可对丁酰胆碱酯酶产生抑制作用的抑制剂也已经发展成为一种新的治疗AD的途径。目前关于木犀草素对AD的治疗作用未见报道,本研究以木犀草素为参照物,使用自制水溶性氨基木犀草素醌系列化合物进行相关实验,以期为此类新的具有较强抗自由基能力化合物的应用开拓更广泛的领域。
1 材料与方法
1.1 仪器和试剂
304材质牛津杯,上海化科实验器材有限公司;YXQ-LS-30S11型高压灭菌锅,上海博迅实业有限公司医疗设备厂;SHP-250型电热恒温培养箱,上海实验仪器总厂;TS-1102型振荡双层培养摇床,常州市国旺仪器制造有限公司;SW-CJ-1F型单人双面净化工作台,BXM-50VE型立式压力蒸气灭菌器,上海博迅医疗生物仪器股份有限公司;GL124-1SCN型电子分析天平,德国赛多利斯公司;WH-2型旋涡振荡器,常州华奥仪器制造有限公司。
金黄色葡萄球菌,枯草芽孢杆菌和大肠埃希氏菌均来自淮海工学院海洋生物技术实验室;乙酰胆碱酯酶活性检测试剂盒、丁酰胆碱酯酶、β-羟丁酸脱氢酶(来源于勒氏假单胞菌,冻干粉,活性≥200 U/mg),美国Sigma公司。
1.2 实验方法
1.2.1 木犀草素醌的制备
木犀草素为主要原料,具有4个酚羟基,通过控制pH可使其主要氧化生成邻位醌式结构化合物,测得最适pH为9.2,反应式见图1。
1.2.2 氨基木犀草素醌的合成
醌式结构化合物再与胺类反应合成基于木犀草素结构的18个醌类化合物。对其进行红外(IR)、紫外(UV)、质谱和核磁表征[11],反应式见图2,结构如图3所示。
1.2.3 抑菌实验原理
本实验采用抑菌圈法,利用待测样品在琼脂平板中扩散,使其周围的细菌生长受到抑制而形成透明圈,根据抑菌圈大小判定待测样品抑菌效价。
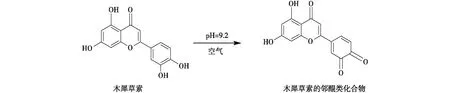
图1 木犀草素被氧化的反应式Fig.1 Reaction equation of luteolin by oxidation
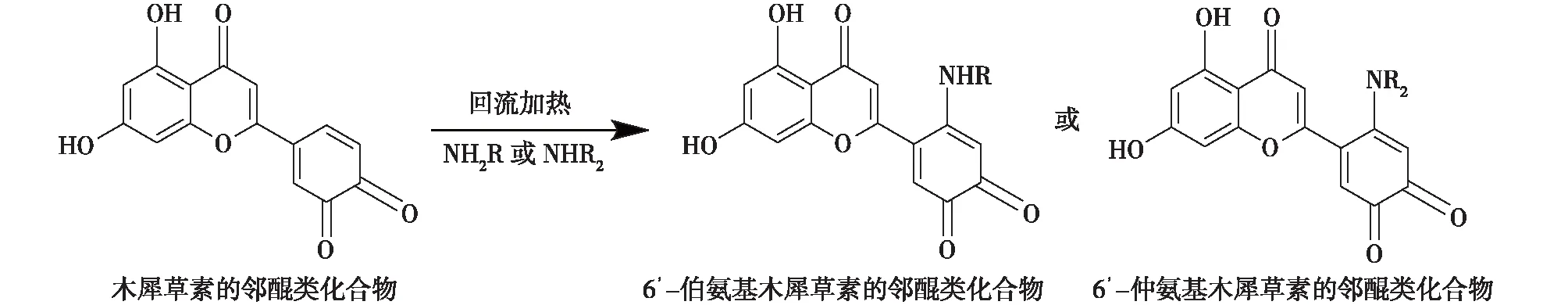
图2 木犀草素的邻醌类化合物与胺类的反应式Fig.2 Reaction equation of the luteolin’s o-quinone with amines
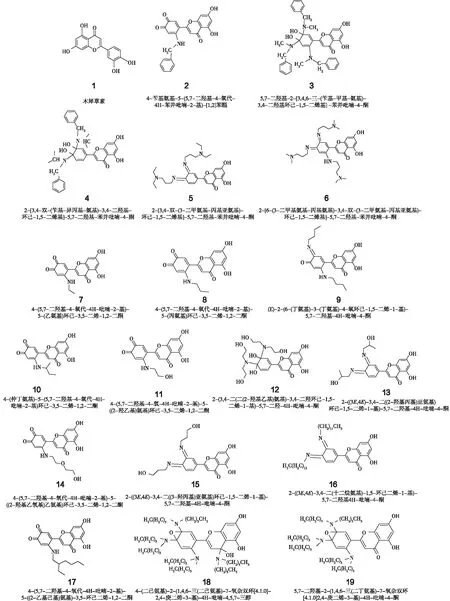
图3 被测样品的分子结构Fig.3 Molecular structure of samples tested
1.2.4 总巯基检测试剂盒法(Ellman 法)
Ellman法属于一种测试小分子化合物抑制胆碱酯酶活性的方法,能定量评价AChE或BuChE抑制活性。原理是硫代乙酰胆碱(硫代ACh)或硫代丁酰胆碱(硫代BuCh)被AChE或BuChE水解,从而得到硫代胆碱。硫代胆碱可和5,5′-二硫代双-(2-硝基苯甲酸)(显色剂,DTNB)结合,得到5-硫-2-硝基苯甲酸,呈黄色。5-硫-2-硝基苯甲酸在波长 412 nm处显示出最大紫外吸收。当化合物对酶产生抑制作用时,活性降低,其水解硫代ACh或硫代BuCh的水平降低,水解产生的硫代胆碱浓度都会有所减少,硫代胆碱与DTNB反应生成的 5-硫-2-硝基苯甲酸含量会相应减少,在 412 nm 处显示出吸光度降低。抑制率的大小可根据吸光度变化数值计算,其反应式如图4所示。

图4 硫代乙酰胆碱被AChE水解得到硫代胆碱及其和DTNB的显色反应Fig.4 Thioacetylcholine is hydrolyzed by AChE to give thiocholine and its colour reaction with DTNB
1.3 实验过程
1.3.1 培养基的制备
用牛肉膏蛋白胨琼脂培养基培养细菌[12];液体培养基中不添加琼脂即可[13]。牛肉膏蛋白胨(NB)培养基:牛肉膏3.0 g,鱼粉蛋白胨10.0 g,NaCl 5.0 g,琼脂15.0~20.0 g,将pH调至7.2~7.4,补水至1 000 mL,分装至三角瓶中,脱脂棉封口包扎,静置数分钟,待冷却。在高压灭菌锅内进行灭菌,温度设定为121.0 ℃,时间为25 min。
1.3.2 试验细菌的活化
将温度冷却至约70 ℃时,在无菌环境下将培养基倾倒至平板中,高度约为平板的1/4。待培养基凝固,从试验菌的保藏斜面中用灼烧过的接种针取出少量菌体,在平板内划线传代(代数2次为相对稳定)。将划好的平板倒置于恒温培养箱中进行培养,温度设定为37 ℃,经过1~2 d培养,即可看出菌体的生长。
1.3.3 菌悬液制备
预先制备NB液体培养基,即不添加琼脂,体积为试管的1/4~1/3,包好后进行灭菌,设定条件和固体培养基一样,待冷却。无菌环境下用接种环从平板中挑取纯种单菌落,将菌落接入液体培养基中,每个试管接2~3环。将试管绑好,安放在振荡双层培养摇床中,温度设定为37 ℃,转速设定为150 r/min。
1.3.4 样品的处理
对样品做好编号进行标记。只有2号、12~18号8个产物在二甲基亚砜(DMSO)中溶解性较好,其余较难溶解。故选择无菌水为溶剂,溶解配比为1 mg药品对应1 mL无菌水。
1.3.5 加入样品测定实验
取出液体培养基,经过振荡器充分振荡,用移液枪取0.1 mL菌悬液注入NB培养基平板中,用涂布棒涂布均匀。将牛津杯经酒精灯灼烧1~2 s,放置在3个涂布过的平板上,成等边三角形。移液枪取出0.1 mL样品注入牛津杯中,在操作台中放置20 min后,置于恒温培养箱中培养2 d左右。同时以无菌水作为溶剂的空白实验。
1.3.6 结果的记录
待有效果样品对试验菌产生明显的抑菌圈后,用游标卡尺测量抑菌圈半径。
1.3.7 Ellman 法测试胆碱酯酶的抑制作用
包括木犀草素对照物在内18个产物,采用 Ellman法分别进行体外ChE抑制作用检测。
1) 缓冲液的配制 pH为8.0的H3PO4缓冲液:称取71.64 g Na2HPO4,加去离子水,用1 000 mL容量瓶定容;称取31.21 g NaH2PO4,加去离子水,用1 000 mL容量瓶定容;分别量取947 mL Na2HPO4溶液和53 mL NaH2PO4溶液,加去离子水定容至1 000 mL。
2) 显色剂及底物的配制 量取0.013 2 g显色剂DTNB,加上述H3PO4缓冲液定容至10 mL,称取0.015 3 g底物碘化硫代乙酰胆碱(C7H16INOS,ATCI),加上述配好的H3PO4缓冲液定容至10 mL。
3) 样品的配制 每种样品分别称取1 mg,加适量DMSO或水配制成1 mg/mL的样品液。
4) 96孔加样检测 通过96孔板检测样品的AChE的抑制活性。空白对照反应体系中加入20 μL酶液(乙酰胆碱酯酶或丁酰胆碱酯酶)、20 μL显色剂DTNB和130 μL H3PO4缓冲液;待测实验组反应体系中加入20 μL酶液(乙酰胆碱酯酶或丁酰胆碱酯酶)、20 μL显色剂DTNB、130 μL H3PO4缓冲液和10 μL样品液。临测前加入20 μL底物液碘化硫代乙酰胆碱(ATCI),摇晃混匀置于酶标仪中,在波长412 nm下,每隔1 min记录反应液的吸光度A412值,循环9次,持续8 min。
2 结果与讨论
2.1 抑菌活性的测定实验结果
抑菌活性的测定实验数据如表1所示。编号为2、4、5、14的氨基木犀草素醌在大肠杆菌中抑菌活性如图5所示。由表1和图5可知:抑菌圈半径分别为0.678、0.650、0.730和0.680 cm。

表1 抑菌活性测定实验数据
注:①大肠为大肠埃希氏菌,枯草为枯草芽孢杆菌,金葡为金黄色葡萄球菌;②当抑菌圈不明显时,表中以抑菌圈半径为“-”标示。

图5 编号为2、4、5和14的样品在大肠杆菌的抑菌活性Fig.5 Antibacterial activity of the samples No. 2,4,5 and 14 in Escherichia coli
在金黄色葡萄球菌中只有7号有抑菌活性(图6),抑菌半径为0.600 cm;而在枯草芽孢杆菌中,所有的药品都不存在抑菌活性。

图6 编号为7的样品在金黄葡萄球菌中的抑菌活性Fig.6 Antibacterial activity of sample No. 7 in Staphylococcus aureus
由抑菌圈可判断出,只有4种氨基木犀草素醌对大肠杆菌存在抑菌活性,但并不能从抑菌圈半径判断出其抑菌能力,因为测定结果受样品溶解性和扩散能力影响很大,具有一定局限性;同时只有一种氨基木犀草素醌对金黄色葡萄球菌存在抑菌活性;而对枯草芽孢杆菌,没有任何氨基木犀草素醌对其有抑菌作用。
2.2 酶抑制活性的实验
测得的样品抑制率如表2所示,抑制率以式(1)方法计算。

表2 样品酶的抑制率
注:序号1为木犀草素,因其在水中难以溶解,因此不做测试。
抑制率=(1-实验孔平均OD值/对照孔平均OD值)×100%=(1-C/0.016)×100%
(1)
式中:C为测得的每个样品液的实验孔平均A412值。
由表2可知:只有3、13~19号样品在DMSO中的溶解性较好,可进行乙酰胆碱酯酶活力检测。除17号对乙酰胆碱酯酶的抑制率稍高,其余均较低。抑制率最高的产物17和其次产物14抑制率分别为71.07%和16.88%。前者抑制率超过50%,活性较高,可以通过测定半抑制浓度(IC50),以IC50对抑制活性做定量测定。后者低于50%,则测定无意义。以无菌水为溶剂,进行丁酰胆碱酯酶活力检测时,18个样品对丁酰胆碱酯酶抑制率均较低,其中抑制率最高的是产物11,其次是产物9。目前主流研究认为体内乙酰胆碱含量与AD的症状改善显著相关[14]。碱酯酶抑制率越高,说明乙酰胆碱保留越多。
3 结论
1)以木犀草素为对照,探究18种基于木犀草素结构的氨基醌化合物的抑菌活性,通过观测抑菌环的方法,发现其中只有2、4、5、14号样品对大肠杆菌有抑菌活性,抑菌圈半径分别为0.678、0.650、0.730和0.680 cm,但效果有限;对金黄色葡萄球菌有抑菌活性的化合物只有7号样品,抑菌半径为0.600 cm;而对于枯草芽孢杆菌,所有化合物都无抑菌效果。因此,无一种化合物对3种菌类都具有抑制作用。
2)合成的氨基醌类化合物中只有3、13~19号样品的8个产物在DMSO中的溶解性较好,可进行乙酰胆碱酯酶活力检测。除产物17对乙酰胆碱酯酶的抑制率较高,其余都很低。抑制率最高的是产物17,其次是产物14,抑制率分别为71.07%和16.88%。前者抑制率超过50%,活性较高,可以通过抑制IC50对抑制活性进行定量测定;后者低于50%则测定IC50无意义。在进行丁酰胆碱酯酶活力检测时,溶剂为无菌水,结果18个样品对丁酰胆碱酯酶抑制率都很低。其中抑制率最高的是产物11,其次是产物9。
参考文献:
[1] 赵学志.木犀草素诱导Hela细胞凋亡及其机制研究[D].芜湖:皖南医学院,2013.
[2] 杨洋,聂静然,关红艳,等. 花生壳木犀草素的提取及其抑菌性能研究[J].食品科技,2009,34 (12):211-216.
[3] 周建新,林姣,包月红,等.不同溶剂及辅助方法对花生壳提取物中木犀草素含量及抗菌作用的影响[J]. 中国粮油学报,2014,29(9):87-90.
[4] 张宇,王朝兴,沙靖全,等. 磺化木犀草素金属配合物的合成及抗氧化、抗菌活性研究[J].分子科学学报,2012,28(6):490-494.
[5] 沙靖全,李敬芬,闫红.木犀草素缩磺胺甲恶唑席夫碱及金属配合物的研究[J].黑龙江医药科学,2005,28(4):8-9.
[6] 周美荣,李颖,窦后松,等.8-氨甲基取代木犀草素衍生物的合成和抗炎活性研究[J].化学研究与应用,2008,20(1):10-15.
[8] 苏亚彬.4-二甲氨基黄酮衍生物的设计、合成及其活性评价[D].开封:河南大学,2014.
[9] 李俊杰.苯并咪唑和3-氨基吡唑衍生物的合成及其乙酰胆碱酯酶抑制活性测定[D].保定:河北大学,2015.
[10] 徐赫男,娄晶莹,张灿,等.新型乙酰胆碱酯酶抑制剂6-芳甲基-3-(4-烷氧苯基)-7H-噻唑并[3,2-b]-1,2,4-三嗪-7-酮类化合物的设计、合成与生物活性研究[J].中国新药杂志,2013,22(22) :2692-2697.
[11] 王建,刘玮炜,王芙蓉,等.一种基于木犀草素结构的6′位氨基衍生物的制备方法:201611204210.8[P].2016-12-23.
[12] 张东博.药用植物中生物碱类乙酰胆碱酯酶抑制剂的筛选[D].兰州:兰州理工大学,2010.
[13] 蔡亚楠.乙酰胆碱酯酶活性检测和抑制剂筛选新方法[D].西安:陕西师范大学,2013.
[14] 董玉洁,朴美子,王懋存,等.长岛海洋生物内生真菌的分离及其抗老年痴呆活性筛选[J].中国食品学报,2012,12(4):43-47.

