蝇蛆油对急性皮肤创伤感染模型大鼠愈合的影响及机制研究Δ
韩跃东,张超,张松,张衍国(1.空军军医大学唐都医院皮肤科,西安7100;.西安市第三医院消化内科,西安 71008;.空军军医大学唐都医院药剂科,西安 7100)
皮肤创面愈合是一个极其复杂的生物学过程,大致包括细胞增殖、炎症反应、创面收缩、胶原生成等过程[1]。在创面愈合过程中,创面感染会使愈合延迟,严重时还会造成严重的菌血症,威胁患者生命[2]。因此,在有效控制感染的同时促进创面愈合,是治疗皮肤创伤的重要环节。近年来,临床常用抗生素控制皮肤创伤感染,但抗生素不仅易引起过敏性休克,还有可能引起二重感染,此外耐药菌的产生也严重困扰着临床医师和药师[3]。因此,开发兼具抗感染和促愈合的新型药物具有重要意义。
蝇蛆又名五谷虫,是丽蝇科丝光绿蝇和大头金蝇的幼虫,为我国传统中药材,其体内具有丰富的蛋白质、脂肪酸、矿物质、维生素和氨基酸类成分,营养价值高于鱼类,可用于某些氨基酸缺乏症或其他多种疾病的防治[4-5]。研究发现,蝇蛆油可抑制炎症反应,对绿脓杆菌和金黄色葡萄球菌均具有较强的抑菌作用,对深Ⅱ度烫伤模型小鼠及盐酸引起的化学性损伤和烧伤具有显著的保护作用[6-7]。但是,目前还未见关于蝇蛆油对急性皮肤创伤感染的保护作用及作用机制的文献报道。故本研究通过对大鼠复制创伤感染模型,研究蝇蛆油对急性皮肤创伤感染的保护作用及机制,为蝇蛆油的进一步开发应用提供参考。
1 材料
1.1 仪器
Infinite F50全自动酶标仪(瑞士Tecan公司);Chem Doc XRS+凝胶成像系统、Mini Protein Tetra Cell蛋白电泳槽(美国Bio Rad公司)。
1.2 试剂
京万红(天津达仁堂京万红药业有限公司,批号:211761,规格:20 g/支);羟脯氨酸(批号:20170219)、大鼠溶菌酶(批号:20170122)、肿瘤坏死因子α(TNF-α,批号:20170214)和白细胞介素6(IL-6,批号:20170218)酶联免疫吸附(ELISA)测定试剂盒均购自南京建成生物工程有限公司;核转录因子κB p65(NF-κB p65)、磷酸化NF-κB 抑制因子(p-IκB-α)、增殖细胞核抗原(PCNA)和β-肌动蛋白(β-actin)抗体均购自美国 Cell Signaling Technology公司;羊抗兔二抗(博士德生物有限公司);石油醚(国药集团化学试剂有限公司,批号:20160729,分析纯);氯胺酮注射液(美国Sigma公司,批号:H35020148,规格:0.1 g/2 mL)。
1.3 动物
清洁级SD大鼠280只,♀♂各半,体质量180~220 g,购自空军军医大学动物实验中心[动物生产合格证号:SCKX(军)2007-007号]。购入后将大鼠饲养于为室温为(25±2)℃、湿度为65%~75%的环境中,普通饲料喂养。4~5日龄蝇蛆幼虫由西安福如林生物技术有限公司提供。
1.4 菌株
金黄色葡萄球菌由唐都医院检验科提供。
2 方法
2.1 蝇蛆油的提取
取4~5日龄蝇蛆幼虫,精密称量10 g,充分碾磨后,用100 mL石油醚浸泡,每次6 h,重复3次,合并浸提液,用旋转蒸发仪在低温下(30℃)减压挥干石油醚,在真空干燥器中干燥至恒质量,蝇蛆油的得率为12.7%。
2.2 分组、造模与给药
将大鼠随机分为正常组(创伤表面涂生理盐水)、模型组(创伤表面涂生理盐水)、蝇蛆油组(测试药物组)、京万红组(阳性对照组),每组70只。除正常组外,其余各组大鼠均参考文献[8]方法复制皮肤急性创伤感染模型:腹腔注射氯胺酮(100 mg/kg)麻醉大鼠,用脱毛膏去除背部毛发,洗净后,用碘酒给皮肤消毒,切开长为1.5 cm伤口,深至皮下。在伤口处涂上1 mL(1.2×109mL-1)的金黄色葡萄球菌悬液,每天上午涂1次,连续3 d。参考国家卫生部医改司医院感染检测小组制订的医院感染诊断标准[9],以伤口出现红肿热痛并有脓液即提示造模成功。造模成功后,每天9:00和17:00各给药1次,给药剂量为0.3 mL/100 g(给药剂量参考文献[6]报道的给药剂量以及前期预实验结果确定),连续给药15 d。
2.3 创面大体情况观察
每日观察用药后大鼠皮肤创面情况,包括是否水肿、有无红肿、有无瘢痕、表面是否干燥平整,记录愈合时间。皮肤愈合判断标准[8]:皮肤完整,无水肿、无脓液渗出。
2.4 创面含水量及组织中羟脯氨酸含量测定
给药1、2、4、6、8 d后,每个时间点每组选10只大鼠,收集背部皮肤。采用干湿比法测定给药2、4、6、8 d后大鼠创面含水量:取创面组织,清除皮下脂肪组织,精确称量,记为湿质量;剪碎组织,在烘箱(100℃)中烘烤24 h,精确称量,记为干质量,创面含水量=(湿质量-干质量)/湿质量×100%。取干燥后的皮肤组织(给药1、2、4、6、8 d后的大鼠皮肤组织)7 mg,用6 mol/L的HCl溶液在120℃下水解15 h,用去离子水稀释裂解物,并用NaOH(1 mol/L)溶液中和,将裂解物以1 000×g离心15 min,收集上清液,用于羟脯氨酸含量测定,具体操作依照试剂盒说明书进行。
2.5 血清中溶菌酶含量测定
末次给药结束2 h后,每组取10只大鼠,麻醉后收集血液,在室温下将血液以1 000×g离心10 min,收集血清;每只大鼠取20 μL血清,按照试剂盒说明书操作,应用双抗体夹心法测定血清中溶菌酶含量。待反应结束后,采用全自动酶标仪在450 nm波长下测定各样品的吸光度(OD)值,通过标准曲线计算样品中大鼠溶菌酶含量。
2.6 血清中TNF-α、IL-6含量测定
末次给药结束2 h后,每组取10只大鼠,收集大鼠血液,将血液以1 500×g离心10 min,收集上清液。按照相应试剂盒说明书操作,测定各组大鼠血清中TNF-α和IL-6含量。
2.7 创面组织中NF-κB p65、p-I-κB蛋白表达测定
将大鼠取血后处死,取50 mg皮肤组织,加入组织蛋白匀浆液500 μL,匀浆至无组织块,冰浴15 min,在4℃条件下以1 500×g离心5 min,收集上清。然后按照说明书要求,加入细胞浆蛋白提取液,冰浴10~15 min,以10 000×g离心10 min,收集上清液,即为细胞浆蛋白样品液。沉淀中加入细胞核蛋白提取液,冰浴10~15 min,以10 000×g离心10 min后,收集上清液,即为细胞核蛋白样品液。用二喹啉甲酸(BCA)法对细胞浆和细胞核蛋白进行定量,然后置于-70℃保存,备用。蛋白变性后,分别取等量蛋白(30 μg)上样,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,半干转至聚偏二氟乙烯(PVDF)膜上,脱脂奶粉封闭后,用一抗(NF-κB p65、I-κB)孵育过夜,洗膜缓冲液TBST漂洗3遍后,加入羊抗兔二抗(1∶5 000),孵育1 h。TBST漂洗后,采用化学发光超敏显色试剂盒显影、拍照。核蛋白检测以PCNA(1∶1 000)为内参,细胞浆蛋白检测以β-actin(1∶1 000)为内参。采用Quantity one软件进行条带灰度值分析,以目的蛋白条带和内参(PCNA或β-actin)条带灰度值的比值表示目的蛋白的相对表达水平,并将正常组的比值设置为1。
2.8 统计学方法
采用SPSS 18.0统计软件进行数据分析。结果以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05表示差异有统计学意义。
3 结果
3.1 创面愈合的观察结果
与正常组比较,模型组大鼠创面愈合缓慢,愈合率较低,愈合时间较长[(14.3±2.1)d]。与模型组比较,蝇蛆油组和京万红组大鼠创面愈合率显著增加,愈合时间显著缩短[分别为(8.2±2.3)、(9.5±2.5)d](P<0.01),创面平整光滑、疤痕面积较小、整洁度较好。
3.2 创面含水量的测定结果
与正常组比较,模型组大鼠在给药2、4、6、8 d后创面含水量均显著增加(P<0.01);与模型组比较,蝇蛆油组和京万红组大鼠在给药2、4、6、8 d后创面含水量均显著减少(P<0.01)。各组大鼠创面含水量测定结果见表1。
表1 各组大鼠创面含水量测定结果(±s,n=10,%%)Tab 1 Content determination of water in wound of rats in each group(±s,n=10,%%)

表1 各组大鼠创面含水量测定结果(±s,n=10,%%)Tab 1 Content determination of water in wound of rats in each group(±s,n=10,%%)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01Note:vs.normal group,**P<0.01;vs.model group,##P<0.01
组别正常组模型组蝇蛆油组京万红组8 d 38.7±2.2 66.8±4.2**43.5±3.9##46.3±4.6##2 d 39.5±2.3 85.3±3.6**73.5±4.8##74.3±5.5##4 d 38.1±2.6 78.2±4.1**64.5±5.1##65.3±5.7##6 d 40.3±1.9 70.7±4.6**57.9±4.4##59.1±4.7##
3.3 创面组织中羟脯氨酸含量的测定结果
与正常组比较,模型组大鼠创面组织中羟脯氨酸含量随着时间的增加而增加,在给药4 d后差异开始有统计学意义(P<0.05或P<0.01)。与模型组比较,在给药后2、4、6、8 d后蝇蛆油组和京万红组大鼠创面组织中羟脯氨酸含量显著增加(P<0.01),提示蝇蛆油可以促进创面胶原合成,增加创面愈合能力。各组大鼠创面组织中羟脯氨酸含量测定结果见表2。
表2 各组大鼠创面组织中羟脯氨酸含量测定结果(±s,n=10,μg/mg)Tab 2 Content determination of hydroxyproline in wound of rats in each group(x ± s,n=10,μg/mg)
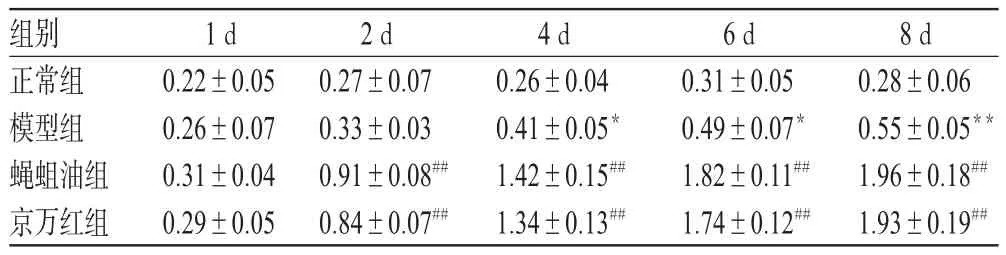
表2 各组大鼠创面组织中羟脯氨酸含量测定结果(±s,n=10,μg/mg)Tab 2 Content determination of hydroxyproline in wound of rats in each group(x ± s,n=10,μg/mg)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,##P<0.01Note:vs.normal group,*P<0.05,**P<0.01;vs.model group,##P<0.01
组别正常组模型组蝇蛆油组京万红组8 d 0.28±0.06 0.55±0.05**1.96±0.18##1.93±0.19##1 d 0.22±0.05 0.26±0.07 0.31±0.04 0.29±0.05 2 d 0.27±0.07 0.33±0.03 0.91±0.08##0.84±0.07##4 d 0.26±0.04 0.41±0.05*1.42±0.15##1.34±0.13##6 d 0.31±0.05 0.49±0.07*1.82±0.11##1.74±0.12##
3.4 血清中溶菌酶含量的测定结果
与正常组比较,模型组大鼠血清中溶菌酶含量显著增加(P<0.01)。与模型组比较,蝇蛆油组和京万红组大鼠血清中溶菌酶含量显著减少(P<0.01),表明蝇蛆油可以促进创面胶原合成,增强创面愈合能力。各组大鼠血清中溶菌酶含量测定结果见表3。
表3 各组大鼠血清中溶菌酶含量测定结果(±s,n=10)Tab 3 Content determination of lysozyme in serum of rats in each group(±s,n=10)

表3 各组大鼠血清中溶菌酶含量测定结果(±s,n=10)Tab 3 Content determination of lysozyme in serum of rats in each group(±s,n=10)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01Note:vs.normal group,**P<0.01;vs.model group,##P<0.01
组别正常组模型组蝇蛆油组京万红组溶菌酶含量,U/mL 1.27±0.21 2.14±0.26**4.78±0.38##4.15±0.27##
3.5 血清中TNF-α和IL-6含量的测定结果
与正常组比较,模型组大鼠血清中TNF-α和IL-6含量显著增加(P<0.01)。与模型组比较,蝇蛆油组和京万红组大鼠血清中TNF-α和IL-6含量显著减少(P<0.01)。各组大鼠血清中TNF-α和IL-6含量测定结果见表4。
表4 各组大鼠血清中TNF-α和IL-6含量测定结果(±s,n=10,ng/L)Tab 4 Content determination of TNF-α and IL-6 in serum of rats in each group(±s,n=10,ng/L)

表4 各组大鼠血清中TNF-α和IL-6含量测定结果(±s,n=10,ng/L)Tab 4 Content determination of TNF-α and IL-6 in serum of rats in each group(±s,n=10,ng/L)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01Note:vs.normal group,**P<0.01;vs.model group,##P<0.01
IL-6 1.04±0.13 3.09±0.65**1.58±0.45##1.66±0.56##组别正常组模型组蝇蛆油组京万红组TNF-α 142.5±33.8 369.4±49.7**211.6±41.5##227.4±43.1##
3.6 创面组织中NF-κB p65和p-I-κB-α蛋白表达测定结果
与正常组比较,模型组大鼠创面组织中NF-κB p65(细胞质中)蛋白表达水平显著降低(P<0.01),NF-κB p65(细胞核中)和p-IκB-α(细胞质中)蛋白表达水平均显著升高(P<0.01);与模型组比较,蝇蛆油组和京万红组大鼠创面组织中NF-κB p65(细胞质中)蛋白表达水平显著升高(P<0.01),NF-κB p65(细胞核中)和p-IκB-α(细胞质中)蛋白表达水平均显著降低(P<0.01)。各组大鼠创面组织NF-κB p65和I-κB-α蛋白表达电泳图见图1,测定结果见表5。

图1 各组大鼠创面组织中NF-κB p65和p-IκB-α蛋白表达电泳图Fig 1 Electrophorograms of protein expression of NF-κB p65 and p-IκB-α in wound of rats in each group
4 讨论
表5 各组大鼠创面组织中NF-κB p65和p-IκB-α蛋白表达水平测定结果(±s,n=10)Tab 5 Protein expression level of NF-κB p65 and p-IκB-α in wound of rats in each group(±s,n=10)
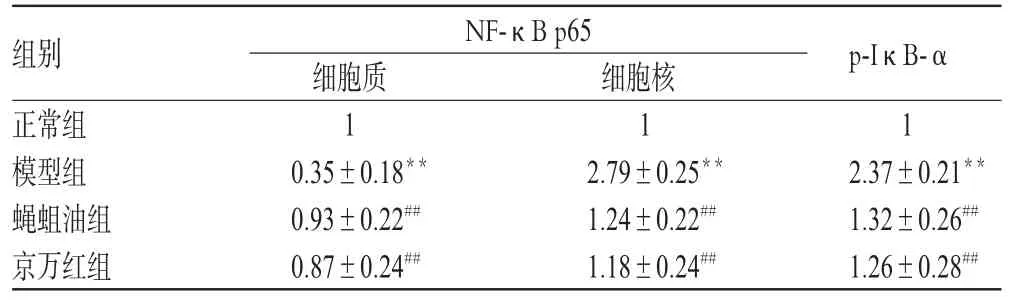
表5 各组大鼠创面组织中NF-κB p65和p-IκB-α蛋白表达水平测定结果(±s,n=10)Tab 5 Protein expression level of NF-κB p65 and p-IκB-α in wound of rats in each group(±s,n=10)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01Note:vs.normal group,**P<0.01;vs.model group,##P<0.01
组别正常组模型组蝇蛆油组京万红组p-IκB-α 1 2.37±0.21**1.32±0.26##1.26±0.28##NF-κB p65细胞质1 0.35±0.18**0.93±0.22##0.87±0.24##细胞核1 2.79±0.25**1.24±0.22##1.18±0.24##
皮肤创伤以及继发的感染是一种常见的疾病,发生率较高,如何促进创伤愈合和减轻感染一直以来是广大医药工作者渴望解决的难题。前期研究发现,蝇蛆油对抗烧、烫伤和盐酸烧伤有较好的改善作用,但未见有关其用于治疗皮肤创伤感染的报道[6-8,10]。本研究在大鼠皮肤创伤感染模型上,研究了蝇蛆油的治疗效果,并探讨了其作用机制。京万红是临床常用的治疗烧烫伤的药物,对皮肤创伤感染也有较好的治疗效果[11],所以本研究以其为阳性对照药。在本研究中,蝇蛆油可以减轻创伤感染引起的组织水肿,缩短创面愈合时间,并且创面愈合整洁度较好,疤痕形成较少,这表明蝇蛆油可以促进创面愈合,抑制组织水肿。同时,其还可以促进创面组织内羟脯氨酸的持续生成,这提示蝇蛆油促进创面愈合作用可能与促进胶原蛋白合成有关。另外,笔者还观察到蝇蛆油给药组溶菌酶含量显著高于模型组,这表明蝇蛆油可以促进吞噬细胞分泌溶菌酶,从而发挥抗菌作用。
炎症反应是机体修复损伤组织的一种基本反应,是创面修复的始动环节,但过度的炎症反应则会加重组织损伤[12]。过度的炎症反应会使细胞过度增殖,胶原蛋白大量合成、沉积,使瘢痕过度增生,组织修复不良[13]。本研究结果显示,创伤感染后大鼠血清中TNF-α、IL-6含量明显增加,表明创伤感染诱导了炎症反应,而蝇蛆油可明显抑制血清中TNF-α、IL-6的含量,表明蝇蛆油能够控制炎症反应。正常情况下,NF-κB以二聚体的形式在细胞质内与I-κB结合,处于失活状态,而当受活性氧或细菌感染等刺激时,I-κB发生磷酸化,使NF-κB p65解离和活化,并转位至细胞核内,调节下游蛋白表达,使损伤加剧[14-15]。为研究蝇蛆油的作用机制,笔者分别检测了细胞质内NF-κB p65和p-IκB-α蛋白表达情况,以及细胞核内NF-κB p65蛋白表达情况。结果表明,蝇蛆油可以使p-IκB-α蛋白表达水平降低,促使NF-κB p65由胞核转移至细胞质中,抑制NF-κB活化,从而抑制过度激活的炎症反应。
综上所述,蝇蛆油对急性皮肤创伤感染引起的组织损伤具有一定的改善作用,其机制可能与促进胶原蛋白生成、增加溶菌酶含量和调节NF-κB信号通路从而发挥抗炎作用有关。
[1]王一兵.烧伤愈合过程中皮肤神经构筑的变化及其意义[D].长沙:中南大学,2010.
[2]彭均,于晋建.早期创面处理在大面积感染性皮肤缺损愈合中的应用[J].解放军护理杂志,2011,28(13):38-40.
[3]隋凤瑞,杨念文,张小宁,等.关于滥用抗生素及不良反应的探讨[J].中华实用医药杂志,2007,7(9):811-812.
[4]国洪旭.蝇蛆油脂、蛋白粉和甲壳素的制备工艺研究[D].昆明:昆明理工大学,2016.
[5]顾亚凤.蝇蛆油对实验动物皮肤的刺激性、过敏性及烫伤治疗药效研究[J].中国兽药杂志,2004,38(10):16-17.
[6]陈淑媛.蝇蛆油脂化学成分、理化特性及其对动物实验性烫伤治疗药效的研究[D].武汉:华中农业大学,2007.
[7]蔺瑞,边海旭,郭超,等.五谷虫的药理作用研究进展[J].中国药房,2017,28(4):558-561.
[8]陈萍,陈伟,刘丁.医疗感染学教程[M].北京:人民卫生出版社,2003:131-132.
[9]张俊松.创复康喷剂对大鼠创伤感染模型创面抗感染及NO含量影响的研究[D].咸阳:陕西中医药大学,2011.
[10]边海旭,伍晓晓,李伟,等.五谷虫提取物凝胶对大鼠深Ⅱ度烫伤创面愈合的影响[J].中国医院药学杂志,2017,37(4):363-367.
[11]王景文.京万红软膏治疗皮肤损伤的临床应用研究进展[J].药物评价研究,2014,37(4):375-380.
[12]青春.皮肤局部炎症反应与创面修复[J].创伤外科杂志,2009,11(5):385-387.
[13]宋瑞,卞徽宁,赖文,等.碱性成纤维细胞生长因子对增生性瘢痕与正常皮肤成纤维细胞胶原、纤维连接蛋白表达的影响[J].中国组织工程研究,2010,14(41):7784-7790.
[14]张玉龙,李世荣.NF-κB信号通路在瘢痕疙瘩形成中的作用[J].中国美容整形外科杂志,2012,23(7):434-437.
[15]李晓光.ERK-NF-κB-VEGF信号通路在GMCSF调控创伤愈合血管新生中的作用[D].上海:上海交通大学,2011.

