UPLC-MS/QAMS测定小鼠血浆中石斛碱及其代谢产物M-250、M-280的浓度Δ
鲁艳柳,黄思,刘浩,曾瑶,王建秋,徐亚沙,陆远富,何芋岐(遵义医学院基础药理教育部重点实验室/特色民族药教育部国际合作联合实验室,贵州遵义 563003)
金钗石斛(Dendrobium nobileLindl.)为兰科石斛属(DendrodiumSW.)植物,是《中国药典》明确规定的药用石斛的植物来源,又名扁金钗、扁黄草、扁草、黄草等[1]。《神农本草经》中将其列为上品,素有“千金草”之称[2],具有滋阴清热、益胃生津、润肺止咳、明目强身等功效[1]。现代药理学研究表明,金钗石斛总生物碱是金钗石斛的主要活性成分,具有止痛、解热作用,可以降低心率、血压,减慢呼吸,并且缓解巴比妥引起的中毒症状[3],还具有降血糖[4]、抗白内障[5]、抗肿瘤[6]、减少细胞凋亡[7]、抗氧化[8]和抗老年痴呆[9]等作用。而石斛碱(Dendrobine)是金钗石斛总生物碱中最主要的特征性成分[1,3],开发应用前景广阔。本课题组前期鉴定出石斛碱在人肝微粒体中的主要代谢产物有M-250、M-280[10],本文在此基础上,采用超高效液相色谱-质谱/一测多评法(UPLC-MS/QAMS),首次建立了测定小鼠血浆中石斛碱及其代谢产物M-250、M-280浓度的方法,为进一步研究石斛碱的药动学提供了实验依据。石斛碱及其代谢产物M-250、M-280的结构图见图1。
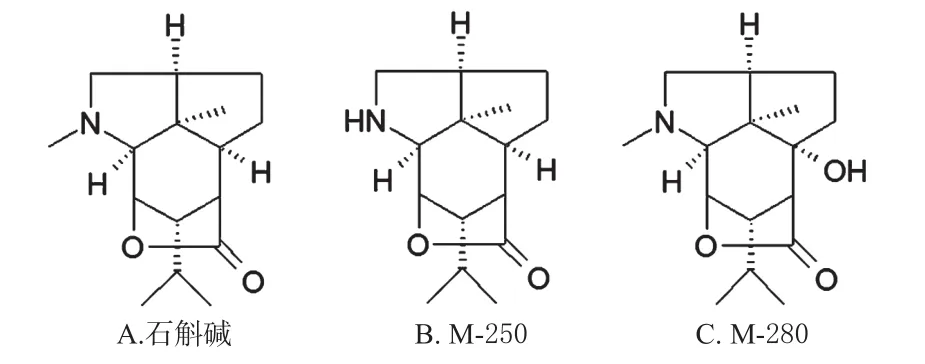
图1 石斛碱及其代谢产物M-250、M-280的结构图Fig 1 Structures diagrams of dendrobine and its metabolites M-250 and M-280
1 材料
1.1 仪器
Thermo Scientific Q Exactive四极杆-静电场轨道阱高分辨MS系统和Thermo Ultrmate 3000 UPLC系统(美国Thermo Fisher公司);Genius 1022液氮发生器(英国Peak公司);Milli-Q超纯水系统(美国Millipore公司);XS205电子天平(瑞士Mettler-Toledo公司);XW-80A漩涡混合仪(海门市其林贝尔仪器制造有限公司);Microfuge 20R高速离心机(美国Beckman Coulter有限公司)。
1.2 药品与试剂
石斛碱对照品(北京华迈科生物技术有限责任公司,批号:D990100,纯度:≥99.0%);盐酸伪麻黄碱对照品(中国食品药品检定研究院,批号:171237-201208,纯度:≥99.9%);乙腈、甲醇、甲酸均为质谱纯,其余试剂均为分析纯。
1.3 动物
健康SPF级C57BL/6J小鼠24只,♂,体质量18~22 g,由重庆第三军医大实验动物中心提供,实验动物生产合格证号:SCXK(渝)2012-0005,饲养温度 21~22℃,湿度56%~65%,明暗交替时间12/12 h。本实验符合遵义医学院实验动物伦理委员会的伦理学标准。
2 方法与结果
2.1 分组与给药
将小鼠随机分为空白对照组和给药组,每组12只,实验前禁食12 h,自由饮水。根据本课题组前期试验结果,给药组小鼠按60 mg/kg灌胃石斛碱[以0.5%羧甲基纤维素钠(CMC-Na)溶液助悬],空白对照组小鼠灌胃等体积的0.5%CMC-Na溶液,1 h后,眼眶取血0.2 mL至肝素化的离心管中,1 856×g离心15 min,分离血浆待测。
2.2 溶液的制备
2.2.1 对照品溶液 精密称取石斛碱对照品15.52 mg,置于10 mL量瓶中,加乙腈溶解至刻度,混匀,即得对照品贮备液,于4℃保存,备用。使用前以乙腈稀释,得到含石斛碱质量浓度分别为51.73、15.52、7.76、1.55、0.78、0.16µg/mL的对照品溶液。
2.2.2 内标溶液 精密称取盐酸伪麻黄碱对照品10.01mg,置于10 mL量瓶中,加乙腈溶解至刻度线,混匀,即得内标贮备液,于4℃保存,备用。使用前以乙腈稀释,得到含盐酸伪麻黄碱质量浓度为0.4µg/mL的内标溶液。
2.3 标准血浆样品的制备
分别取100µL空白血浆,加入不同质量浓度的石斛碱对照品溶液20µL,涡旋30 s,再依次加入内标溶液20µL和乙腈200 µL,涡旋30 s,15 493×g离心10 min,取上清液,即得含石斛碱质量浓度分别为912.94、456.47、91.29、45.65、9.13、3.04、0.91 ng/mL的标准血浆样品。其中,质量浓度为912.94、91.29、9.13 ng/mL的标准血浆样品为高、中、低质量浓度的质控血浆样品,均平行制备5份。
2.4 血浆样品的处理
取100µL血浆样品,加入乙腈20µL,涡旋30 s,再依次加入内标溶液20µL和乙腈200µL,涡旋30 s,15 493×g离心10 min,取上清液50 µL,进样分析。
2.5 色谱条件与质谱条件
2.5.1色谱条件色谱柱:Hypersil Gold C18(150 mm×2.1 mm,1.9 μm);流动相:0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱(0~0.5 min,5%B;0.5~15 min,5%→95%B;15~17 min,95%B);流速:0.3 mL/min;柱温:40 ℃;进样量:5 μL。
2.5.2 MS条件 采用可加热电喷雾离子源(HESI)的离子化方式;雾化温度:300℃;离子传输管温度:350℃;鞘气流速:35 arb;辅助气流速:15 arb;喷雾电压:3.5 kV;碰撞电压:30、40、50 eV;质荷比(m/z)检测范围:100~1 500;扫描模式:全扫描/正离子模式;全扫描模式下分辨率:70 000 FWHM。
2.6 专属性考察
取100µL空白血浆,加入200µL乙腈,涡旋30 s,15 493×g离心10 min,取上清液即得空白血浆样品。取空白血浆样品、标准血浆样品和按“2.4”项下方法处理得到的血浆样品,按“2.5”项下方法进样测定。结果显示,石斛碱([M+H]+m/z264.195 9)及其代谢产物M-250([M+H]+m/z250.180 1)、M-280([M+H]+m/z280.190 6)的保留时间分别为7.76、7.73、8.11 min,空白血浆中的内源性物质不干扰石斛碱及其代谢产物M-250、M-280的测定。石斛碱及其代谢产物M-250、M-280的选择离子图见图2。
2.7 线性关系、定量下限和检测限考察
取“2.3”项下对应样品进样测定后,采用加权(1/X2)最小二乘法,以石斛碱与内标的峰面积之比为纵坐标(y),石斛碱质量浓度为横坐标(x)进行回归分析,得回归方程为y=-10-5x2+0.043 2x+0.430 9(r=0.999 6)。结果表明,石斛碱检测质量浓度的线性范围为9.13~912.94 ng/mL,定量下限为3.04 ng/mL,检测限为0.91ng/mL。
2.8 基质效应考察
取“2.3”项下高、中、低质量浓度的质控血浆样品,进样测定,记录石斛碱和内标峰面积,分别记为A1和B1。将空白血浆换为水,同法制备高、中、低质量浓度的石斛碱+内标溶液,均平行制备5份,进样测定,记录石斛碱和内标峰面积,分别记为A2和B2。按A1/A2×100%计算石斛碱的基质效应,B1/B2×100%计算内标的基质效应,结果见表1。
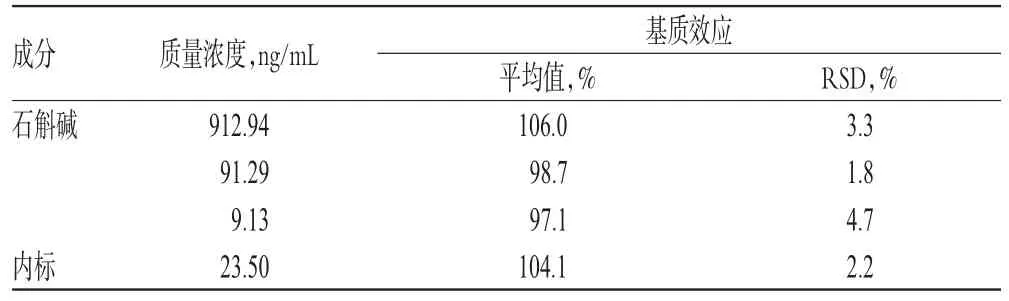
表1 基质效应考察结果(n=5)Tab 1Results of matrix effect(n=5)
2.9 精密度和准确度考察
取“2.3”项下高、中、低质量浓度的质控血浆样品,分别连续进样测定5次,计算日内精密度和准确度,连续测定3 d,计算日间精密度和准确度,结果见表2。
2.10 稳定性试验
取“2.3”项下高、中、低质量浓度的质控血浆样品,分别考察15℃保存24 h,-70℃保存并反复冻融3次,以及-70℃保存15 d后样品的稳定性,结果见表3。
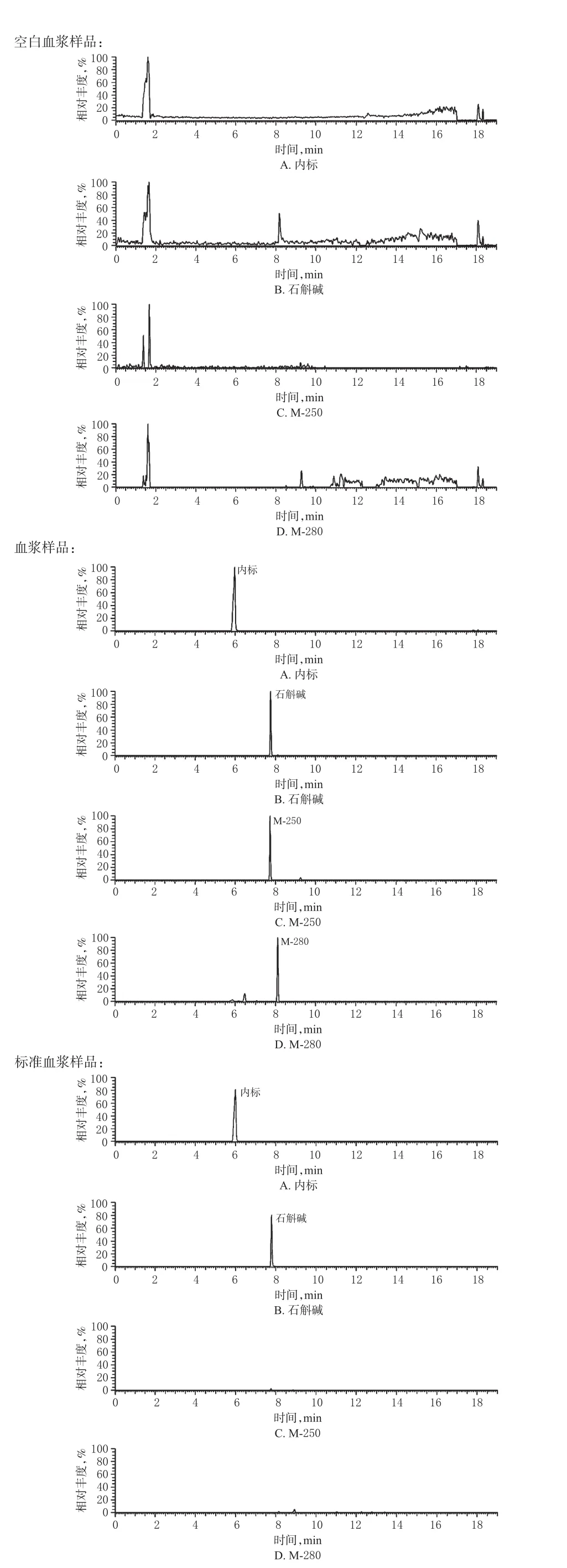
图2 石斛碱及其代谢产物M-250、M-280的选择离子图Fig 2 Selected ion chromatogram of dendrobine and its metabolites M-250 and M-280
2.11 血浆样品中石斛碱的浓度
按“2.4”项下方法处理给药组小鼠的血浆样品,按“2.5”项下方法进样测定,计算血浆样品中石斛碱的质量浓度为(41.3±5.7)ng/mL(n=12)。
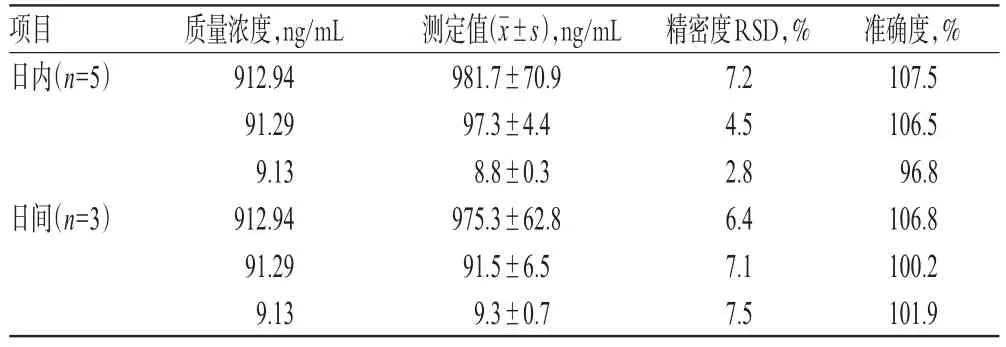
表2 精密度和准确度考察结果Tab 2 Results of precision and accuracy tests
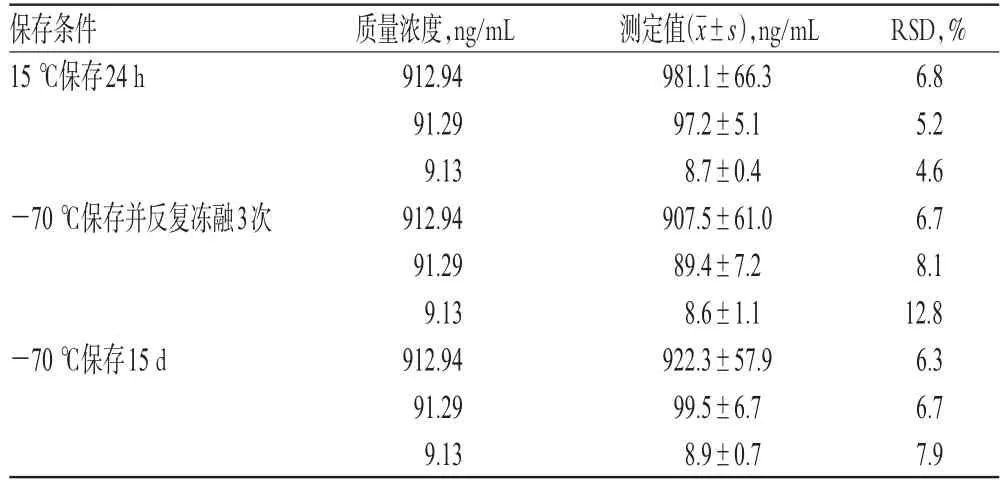
表3 稳定性考察结果(n=3)Tab 3Results of stability tests(n=3)
2.12 一测多评法计算血浆样品中石斛碱代谢产物M-250、M-280的浓度
按一测多评法,取“2.11”项下给药组小鼠的血浆样品,以石斛碱对照品为对照,按“2.5”项下条件进样测定,按Wk=fs/k×[(Ws×Ak)/As]计算其代谢产物 M-250、M-280的浓度。式中,Wk为待测物质量浓度;fs/k为相对校正因子,此处为1.0;Ws为石斛碱对照品质量浓度;As为石斛碱对照品峰面积;Ak为待测物峰面积。结果显示,血浆样品中石斛碱代谢产物M-250、M-280的质量浓度分别为(493.0±73.1)、(41.4±3.0)ng/mL(n=12)。
3 讨论
在本课题组前期研究中,通过精确相对分子质量和二级碎片离子信息,鉴定了石斛碱在人肝微粒体中Ⅰ相代谢的4个主要代谢产物M-250、M-262、M-280和M-296,以及Ⅱ相代谢的1个主要代谢产物M-440[10]。本文检测了小鼠灌胃石斛碱后,血浆中石斛碱及其主要代谢产物M-250、M-280的浓度。但获得石斛碱代谢产物的标准品,以及对其进行准确定量还存在比较大的困难。因此,本研究借鉴了天然药物质量评价中的一测多评法,以其进行两种主要代谢产物M-250、M-280的定量研究。
一测多评法对于对照品难以得到的多指标测定有其特殊的优势[11],目前在天然药物及其制剂的质量评价中应用已较成熟,如《美国药典》34版中有25个天然药物及制剂、《欧洲药典》7.0版中有9个天然药物、2015年版《中国药典》(一部)中黄连及银杏叶提取物等的质量评价均采用该方法[12]。在多指标检测中,以某一组分的对照品为对照,建立与其他待测组分之间的fs/k(即RCF),计算其他组分的含量,公式为:fs/k=(Wk×As)/(Ws×Ak)。式中,Wk为待测物质量浓度;As为对照品峰面积;Ws为对照品质量浓度;Ak为待测物峰面积。
结构类型相同的化合物,RCF的值往往接近1,如2015年版《中国药典》(一部)中黄连药材各生物碱的RCF值均为1.0,可直接以盐酸小檗碱对照品的峰面积为对照,分别计算小檗碱、表小檗碱、黄连碱和巴马汀的含量。考虑到石斛碱代谢产物M-250、M-280的结构与石斛碱十分相似,如图1,故暂定这两个代谢产物的RCF值均为1.0,并以峰面积相当的石斛碱对照品质量浓度进行计算。但上述推测还需要进一步的试验证实。
综上所述,本研究建立了一种灵敏、准确,可用于小鼠血浆中石斛碱及其代谢产物M-250、M-280的浓度测定的方法,为研究石斛碱的药动学奠定了基础。
[1]国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:92.
[2]马继兴.神农本草经辑注[S].北京:人民卫生出版社,1995:37.
[3]王亚芸,任建武.石斛碱的研究进展[J].山东农业大学学报(自然科学版),2015,46(1):152-158.
[4]陶凤,金徽,杨贵忠,等.金钗石斛水提物对糖尿病大鼠肾组织非酶糖基化及氧化的影响[J].山东大学学报(医学版),2012,50(10):11-15、22.
[5]白金丽,温淑香.金钗石斛提取物抗白内障的体外实验研究[J].云南中医中药杂志,2009,30(9):57-59.
[6]刘名昆,李国庆.石斛提取物抗肿瘤作用研究进展[J].现代医药卫生,2015,31(23):3571-3574.
[7]YANG S,GONG QH,WU Q,et al.Alkaloids enriched extract from Dendrobium nobile Lindl.attenuates tau protein hyperphosphorylation and apoptosis induced by lipopolysaccharide in rat brain[J].Phytomedicine,2014,21(5):712-716.
[8]宾捷,胡余明,尹进,等.金钗石斛对老龄小鼠抗氧化作用的实验研究[J].实用预防医学,2010,17(6):1063-1064.
[9]姚寅.金钗石斛生物碱对老年痴呆症的保护作用和机制的研究进展[J].医药前沿,2013,2(4):47-48.
[10]鲁艳柳,黄思,汪敏,等.UPLC/LTQ-Orbitrap-MS技术鉴定石斛碱在人肝微粒体中的代谢产物[J].中国实验方剂学杂志,2018,24(4):32-37.
[11]左岚,孟胜男.一测多评法在中药药物分析中的应用进展[J].中国药房,2016,27(18):2589-2592.
[12]王欣,覃瑶,王德江,等.一测多评法在中药质量控制中的应用进展[J].中成药,2016,38(2):395-402.

