基于SSR的高粱光敏特性分析
牛皓 平俊爱 张福耀 吕鑫 杜志宏 李慧明 王玉斌
摘要 [目的]探明控制高粱抽穗期基因的遗传机理,为高粱品种选育提供新思路新方法。[方法]利用已知抽穗性状的3个高粱材料晋粱五、Ma、IS722,对144对SSR引物进行聚丙烯酰胺凝胶电泳检测,分析差异,筛选光敏感特异性引物。[结果]有4对引物产生特异性条带,分别为xtxp217、xtxp12、xtxp15、xtxp4,且片段大小在100 bp左右,其中xtxp217位于10号染色体、xtxp12位于4号染色体、xtxp15位于5号染色体、xtxp4位于2号染色体。[结论]该研究为后续对高粱杂交种进行光敏鉴定提供了基础。
关键词 高粱;光敏感;SSR
中图分类号 S514文献标识码 A文章编号 0517-6611(2018)35-0097-03
高粱是一种起源于东非的热带短日照单子叶C4植物,自8 000多年前在埃塞俄比亚和苏丹被驯化后作为食物、饲料、纤维和燃料被广泛种植在全球范围内的不同气候带[1]。由于高粱具有高产、适应性强、抗旱、耐盐、耐碱等特性,因而被认为是未来最有价值的作物[2-3]。时至今日在西非和中非,高粱依然作为大宗的进口粮食来保障数百万人民的温饱[4]。高粱的种类比较广泛,包括饲草高粱、酿造高粱、糖高粱等,这些不同的高粱分类一定程度上是由影响高粱抽穗期的环境因素决定的。
高粱抽穗期通常用播种到抽穗的天数来表示[4]。高粱抽穗期的合理调控对现代育种工作的成效至关重要,特别是作为青贮饲料用途的饲草高粱,对光照条件要求比较严格,当生长环境的光照时长超过12.2 h则不抽穗,始终维持营养生长状态,生物产量比非光敏饲草高粱要高,同时牲畜的适口性和消化率较普通高粱好[5-10]。高粱全基因组测序工作已完成,分子辅助育种技术的应用对了解抽穗期的调控基因和调控机理进而实现“订单化”育种有着重要的意义[11-14]。笔者以3个具有代表性的高粱材料为研究对象,提取DNA,通过聚丙烯酰胺凝胶电泳对144对与高粱抽穗期相关的SSR引物进行鉴别,分析差异,筛选光敏感特异性引物,为选育光敏型饲草高粱提供新思路、新方法。
1 材料与方法
1.1 材料
1.1.1 高粱材料。3份高粱材料,分别为酿造粒用高粱晋粱五,饲草高粱IS722,光敏感普通高粱Ma。
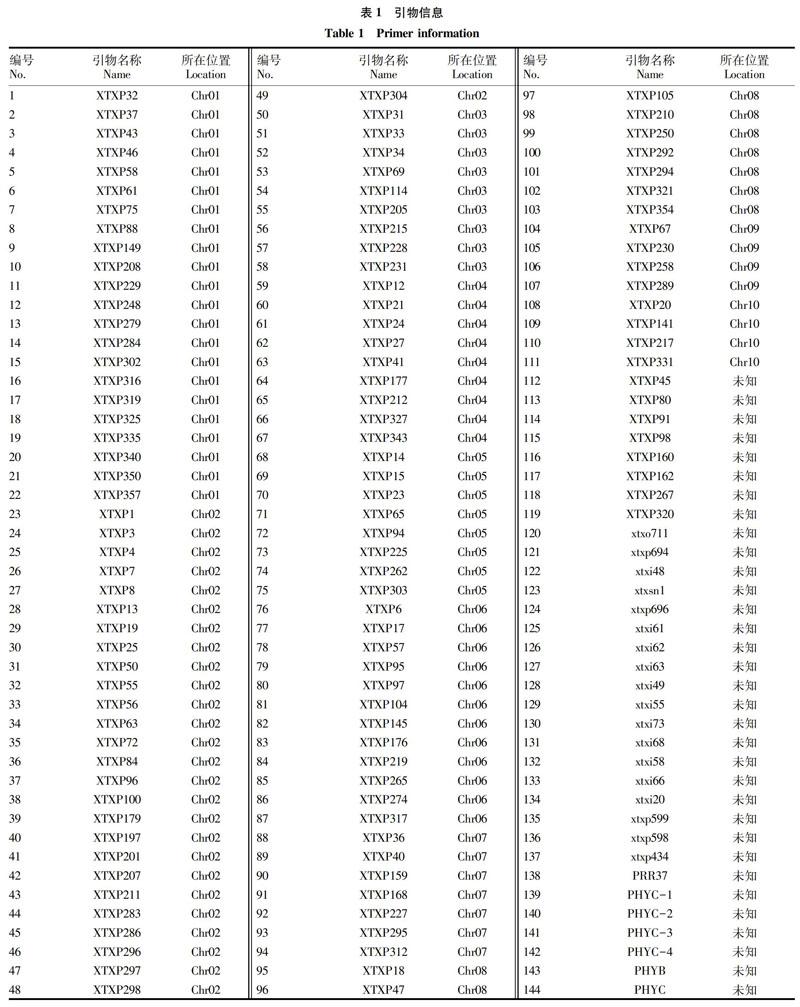
1.1.2 SSR引物。通过查阅文献共搜集到144对分布于高粱10条染色体上的SSR引物,其中有111对明确位置,另有33对没有查询到具体定位。引物合成由生工生物工程(上海)股份有限公司完成(表1)。
1.2 方法
1.2.1 育苗。将晋粱五、Ma、IS722这3个材料分别种植于铺有营养土的96孔育苗盘中,浇足底墒水,待3~4片叶时,用剪刀剪下足量叶片置于2 mL离心管中,液氮速冻后备用。
1.2.2 DNA提取。3个材料DNA提取是采用生工生物工程(上海)股份有限公司生产的Ezup柱式植物基因组DNA抽提试剂盒完成的,经过纯度和浓度检测后置于-20 ℃冰箱保存待用。
1.2.3 PCR扩增。扩增反应在Thermal Cycler C1000 touch扩增仪上进行,PCR反应总体系是10 μL,DNA模板1 μL,前后引物共1 μL,Taq PCR Master Mix 3 μL,ddH2O补足10 μL。PCR反应体系为94 ℃预变性4 min;94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸1 min,共34个循环;72 ℃最后延伸10 min。4 ℃待机备用。
1.2.4 聚丙烯酰胺凝胶电泳。将晋粱五、Ma、IS722这3个高粱恢复系材料,按照此顺序组成1组,每组对应1对引物。电泳版用双蒸水清洗沥干,1%琼脂糖封底待用;30%的丙烯酰胺溶液15 mL,10×TBE溶液6 mL,双蒸水24 mL,20%过硫酸铵300 μL,TEMED溶液30 μL,各成分称量好,待封底琼脂糖凝固后,灌胶,点样,电压220 V,100 min。
试验选用生工生物工程(上海)股份有限公司50~1 000 bp DNA Ladder-H2作为参照,跑胶结束后用干净玻璃板铺平,拍照分析。
2 结果与分析
通过聚丙烯酰胺凝胶电泳检测,结果出现多态性条带的共96组即96对引物,与maker对照出现特异性条带的引物共有4对,其余组引物并未出现明显多态性。
这4对引物分别为xtxp217、xtxp12、xtxp15、xtxp47。对应序列分别为F:5′-GGCCTCGACTACGGAGTT-3′,R:5′-TCGGCATATTGATTTGGTTT-3′;F:5′-AGATCTGGCGGCAACG-3′,R:5′-AGTCACCCATCGATCATC-3′;F:5′-CACAAACACTAGTGCCTTATC-3′,R:5′-CATAGACACCTAGGCCATC-3′;F:5′-CAATGGCTTGCACATGTCCTA-3′,R:5′-GGTGCGAGCTAGTTAAGTGGG-3′。
3 結论与讨论
结果表明,产生特异性条带的引物分别为xtxp217、xtxp12、xtxp15、xtxp4,且片段大小在100 bp左右,其中xtxp217位于10号染色体、xtxp12位于4号染色体、xtxp15位于5号染色体、xtxp4位于2号染色体。国外科学家对高粱的前期遗传研究揭示了4个与开花时间(成熟度)相关的遗传位点,命名为Ma1、Ma2、Ma3、Ma4,其分别位于高粱的第6号、2号、1号和10号染色体上[15-19]。最近又发现了另外2个能增加光周期敏感性,并且能延长饲草及高生物量高粱杂交种营养生长时长的基因Ma5、Ma6[20]。该研究将筛选出的这4对特异性SSR引物用于后代材料的表型鉴定,通过实验室“预判”就可得出材料的抽穗性状,省去田间种植鉴别环节,节省育种的成本,缩短育种时间,提高育种效率。
隨着高粱全基因组测序完成和遗传图谱及物理图谱的不断完善,通过分子辅助育种手段就可以进一步明确与高粱抽穗期相关的基因性状,这将在作物改良中发挥巨大的作用。另外,随着全球煤炭、石油和天然气等不可再生能源储量的日趋减少,生物质能源的开发和利用已经成为全球科研焦点,而通过生物技术对高粱抽穗期进行调控进而选育出的高生物量、强抗逆性、种植范围广、乙醇转化率高等优势品种,必将成为生物质能源必不可少的原材料。
因此,高粱抽穗期基因表达的研究和控制,对于培育饲草高粱和对木质素生物燃料含量要求高的生物质高粱而言具有重要的意义[17,21]。
参考文献
[1] 王燕.高粱抽穗期基因Ma1和Ma3的分子进化及抽穗期的QTL分析[D].北京:中国农业大学,2015.
[2] ROONEY W L,BLUMENTHAL J,BEAN B,et al.Designing sorghum as a dedicated bioenergy feedstock[J].Biofuels Bioprod Bioref,2007,1(2):147-157.
[3] VERMERRISM W,SABALLOS A,EJETA G,et al.Molecular breeding to enhance ethanol production from corn and sorghum stover[J].Crop Sci,2007,47:142-153.
[4] BHOSALE S U,STICH B,FREDERICK H,et al.Association analysis of photoperiodic flowering time genes in west and central African sorghum[Sorghum bicolor(L.)Moench][J].BMC Plant Biology,2012,12:1-10.
[5] LIN Y R,SCHERTZ K F,PATERSON A H.Comparative analysis of QTLs affecting plant height and maturity across the Poaceae,in reference to an interspecific sorghum population[J].Genetics,1995,141(1):391-411.
[6] NIANGADO O.The state of millet diversity and its use in West Africa[C]//COOPER H D,SPILLANE C,HODGIN T.Broadening the genetic base of crop production.Rome:IPGRI/FAO,2001:147-157.
[7] VAKSMAN M,TRAO S,NIANGADO O.Le photopériodisme des sorghos africains[J].Agriculture et dévélopment,1996,9:13-18.
[8] CLERGET B,DINGKUHN M,GOZ E,et al.Variability of phyllochron,plastochron and rate of increase in height in photoperiodsensitive sorghum varieties[J].Ann Bot,2008,101(4):579-594.
[9] HAUSSMANN B I G,BOUREIMA S S,KASSARI I A,et al.Mechanisms of adaptation to climate variability in West African pearl millet landraces:A preliminary assessment[J].SAT ejournal,2007,3(1):1-3.
[10] SEARLE I,COUPLAND G.Induction of flowering by seasonal changes in photoperiod[J].EMBO J,2004,23(6):1217-1222.
[11] THOMAS B,VINCEPRUE B.Photoperiodism in plants[M].2nd edition.California:Academic Press,1997.
[12] MOURADOV A,CREMER F,COUPLAND G.Control of flowering time:Interacting pathways as a basis for diversity[J].Plant cell,2002,14(S1):111-130.
[13] SIMPSON G G,DEAN C.Arabidopsis,the Rosetta stone of flowering time?[J].Science,2002,296:285-289.
[14] IZAWA T,TAKAHASHI Y,YANO M.Comparative biology comes into bloom:Genomic and genetic comparison of flowering pathways in rice and Arabidopsis[J].Curr Opin Plant Biol,2003,6:113-120.
[15] HENDERSON I R,DEAN C.Control of Arabidopsis flowering:The chill before the bloom[J].Development,2004,131(16):3829-3838.
[16] BURLE I,DEAN C.The timing of developmental transitions in plants[J].Cell,2006,125(4):655-664.
[17] MURPHY R L,KLEIN R R,MORISHIGE D T,et al.Coincident light and clock regulation of pseudoresponse regulator protein 37(PRR37)controls photoperiodic flowering in sorghum[J].PNAS,2011,108(39):16469-16474.
[18] ROONEY W L,AYDIN S.Genetic control of a photoperiodsensitive response in Sorghum bicolor (L.)Moench[J].Crop Sci,1999,39:397-400.
[19] KOURESSY M,NIANGADO O,DEMBL T,et al.La sélection de sorghos photopériodiques[M]//BACCI L,REYNIERS F N.Le futur des céréales photopériodiques pour une production durable en afrique tropicale semiaride.Montpellier:CeSIA/CIRAD,1998:247-262.
[20] AYDIN S,ROONEY W L,MILLER F R.Identification and characterization of the Ma5 and Ma6 maturity loci in sorghum[C]//Proceedings of the international conference on genetic improvement of sorghum and pearl millet.Lubbock,USA:INTSORMIL and ICRISAT,1997:641-642.
[21] CHILDS K L,CORDONNIERPRATT M M,PRATT L H,et al.Genetic regulation of development in Sorghum bicolo.VII.ma3R flowering mutant lacks a phytochrome that predominates in green tissue[J].Plant Physiol,1992,99(2):765-770.

