鸭坦布苏病毒病灭活疫苗(HB株)安全和效力的临床评价
何平有 郁宏伟 吴雅清 邹立宏 张德宝 杨保收 朱秀同

摘要:为进一步了解鸭坦布苏病毒病灭活疫苗(HB株)在生产中的使用效果,我们对该产品的临床安全和效力进行了评价。临床试验结果表明,鸭坦布苏病毒病灭活疫苗安全且有效。试验分为两个处理组:1)安全试验组,免疫后21d注射部位疫苗无残留,且该疫苗免疫对雏鸭体重、种鸭的产蛋率和孵化率均无明显影响;2)效力试验组,免疫鸭的ELISA抗体免疫后14d开始转阳,免疫后28d、60d、90d、120d和135d的阳性率均不低于90%。免疫后28d和135d的攻毒保护率均不低于80%。
关键词:鸭,坦布苏病毒病,疫苗,安全,效力
从2010年春季开始,中国浙江、江苏、山东、河北和北京等地区相继暴发了一种以鸭产蛋下降为主要特征的疫病。在病原不清楚的情况下,根据卵巢出血的大体病变,将该病暂命名为鸭出血性卵巢炎( duckhemorrhagic ovaritis,DHO)。2011年首届水禽疫病防控研讨会将该病统一命名为“鸭坦布苏病毒病”。不同日龄的北京鸭、樱桃谷鸭、金定鸭、麻鸭和康贝尔鸭等均可发病,雏鸭发病后期出现精神沉郁、体重减轻、仰翻、侧翻和死亡等临床症状,若细菌继发感染,出现肝周炎、心包炎和气囊炎等,死淘率增加,给养鸭业造成了严重的经济损失。产蛋鸭发病后表现为持续性产蛋率低下,由于继发感染和饲养管理不当等因素可致死亡率达到15%~20%。疫苗免疫是预防该病流行、传播的有效手段。为了进一步弄清鸭坦布苏病毒病的疫苗实际防控效果,我们选取河北、北京和广西等地的北京鸭、樱桃谷鸭进行鸭坦布苏病毒病灭活疫苗临床安全和效力进行评价,现报告如下。
1材料与方法
1.1毒种
生产和检验用毒均为鸭坦布苏病毒(HB株),由北京市农林科学院畜牧兽医研究所分离、鉴定和提供。
1.2疫苗
采用鸭坦布苏病毒(HB株)毒种,按照试行规程在瑞普(保定)生物药业有限公司GMP车间生产5批鸭坦布苏病毒病灭活疫苗(HB株),批号为160502、160703、160804、160805和161006.
1.3试验地点及动物
免疫试验地点为北京、河北和广西地区,攻毒试验地点为瑞普(保定)生物药业有公司负压动物舍,试验动物所在试验地点未发生过鸭坦布苏病毒病,试验用鸭也是未免疫过鸭坦布苏病毒病疫苗的健康鸭。
1.4试剂盒
ELISA试剂盒(ID ScreenWest Nile Competition,产品编号WNC-2P),购自法国IDVET公司。
1.5疫苗评价
1.5.1疫苗安全性评价选用7日龄樱桃谷鸭和北京鸭肉雏鸭各3,000只,均分成6组,500只/比,其中5组为免疫组,分别制备5批疫苗,1.OmL/只,另1组为非免疫对照,各组鸭单独隔离饲养。观察鸭免疫后1—3周的采食和精神状态。并于免疫后21d各免疫组随机取5只免疫鸭连同5只免疫对照鸭,剖检观察疫苗在注射部位的吸收情况(注射部位是否水肿、渗出和出血等病理变化),免疫后28d每组随机抽取50只免疫鸭连同对照50只非免鸭,称重,比较其对增重的影响。
开产后50d北京鸭600只,均分成6组,100只/批,其中5组为免疫组,分别制备5批疫苗,2.Oml/只,另1组为非免疫对照,其中两侧胸部肌肉各注射l.OmL疫苗,各组鸭隔离饲养。记录种鸭免疫后30d内的产蛋数量,并进行标记,与非免疫种鸭同期产蛋数与孵化率进行比较
1.5.2疫苗效力评价将35日龄后备鸭北京鸭4,000只分成6组,1—5组,每组750只,分别免疫5批疫苗,颈胸部肌内注射1.OmL/只,余下250只不免疫,作空白对照,各组鸭隔离饲养。首次免疫后2周,进行二次免疫。免疫后0、14、28、60、90、120和135d连同非免疫组随机抽取10只鸭,采血,检测ELISA抗体,统计并分析抗体阳性率的变化规律。并于免疫后28、135d连同非免疫组随机抽取10只鸭,按照文献所述方法在负压动物舍进行攻毒,计算各组的攻毒保护率。
将开产后30d北京鸭4,000只分成6组,1~5组,每组750只,分别免疫5批疫苗,经胸部肌内注射1.OmL/只,余下250只不免疫,作空白对照,各组鸭隔离饲养。首次免疫后2周,进行二次免疫。免疫后0、14、28、60、90、120和135天连同非免疫组随机抽取10只鸭,采血,检测ELISA抗体,统计并分析抗体阳性率的变化规律。并在免疫后28、1 35天连同非免疫组随机抽取10只鸭,按照文献所述方法在负压动物舍进行攻毒,计算各组的攻毒保护率。
2结果与分析
2.1疫苗安全性
2.1.1全身不良反应情况所有免疫疫苗的雏鸭和种鸭,按照说明书要求的2倍免疫剂量免疫后,连续观察21d。所有免疫鸭与非免疫鸭相比未见异常,免疫鸭精神状况、采食正常,未出现任何全身不良反应。
2.1.2注射部位疫苗吸收情况免疫后21d,每组随机取出5只免疫鸭,用手检查注射部位,均未发现有肿胀或肉芽肿块。剖检:免疫鸭2/5在注射部位可见极其微小的疫苗痕迹,其余鸭的注射部位均无疫苗颗粒存在,吸收良好,注射部位局部均无水肿、渗出和出血。
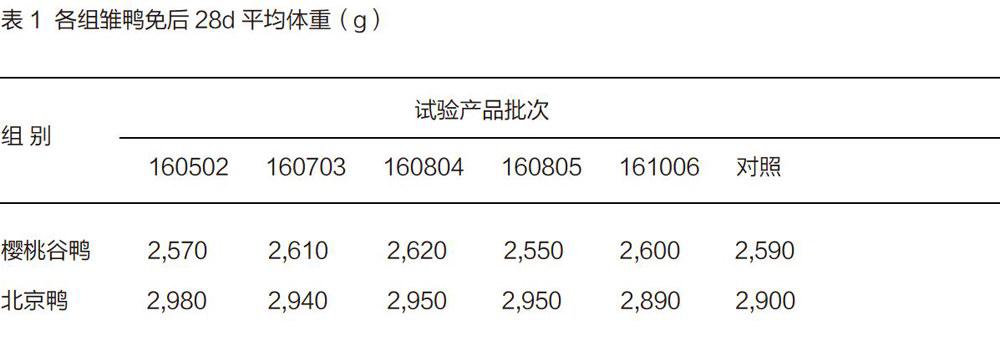
2.1.3鴨群生产性能
1)雏鸭体重:具体结果见表1。从表1可以看出,雏鸭免疫后28d时,5批疫苗免疫组鸭和非免疫对照组鸭的体重无明显差异,疫苗免疫未给雏鸭的增重带来负面影响。
2)种鸭的产蛋和孵化情况:种鸭免疫后,每天统计各组产蛋情况,连续统计30d。产蛋量在免疫后第3d开始下降,下降3~4个百分点,然后逐渐恢复,到第10d已经基本恢复到非免疫对照鸭的同样水平。且从种鸭免疫后4~ 6d内每组随机抽取80枚入孵蛋,通过统计孵化率,发现免疫组与对照组无明显差异,说明疫苗对免疫后30d内的产蛋率和免疫后4~ 6d孵化率无明显影响,结果详见表2。
2.2疫苗的免疫效力
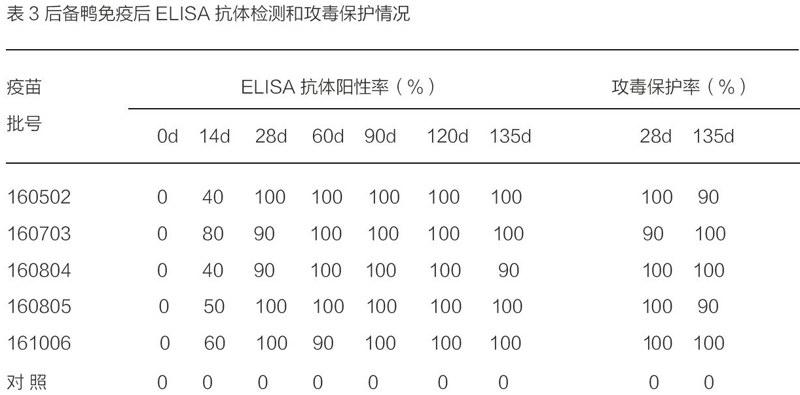
2.2.1對后备鸭的免疫效力后备鸭免疫前和对照鸭ELISA抗体均为阴性,一次免疫后14d,ELISA抗体阳性率40%~80%,一次免疫后28d~135d抗体阳性率为90%~100%,其免疫后28d和135d攻毒保护率分别为90%~100%,相应对照发病率均为100%,说明疫苗免后14d产生保护力,免疫后28d~135d均能提供良好的保护,抗体检测方法与病毒分离法结果吻合,结果详见表3。
2.2.3对产蛋鸭的免疫效力种鸭免疫前和对照鸭ELISA抗体均为阴性,一次免疫后14d,ELISA抗体阳性率为20%~30%,一次免疫后28天抗体阳性率为90%~100%,60~135d的抗体阳性率均为90%~100%,其免疫后28d和135d攻毒保护率分别为90%~100%和100%,相应对照发病率均为100%。解剖观察免疫组卵巢均发育正常且部分有成形蛋,对照组出现不同程度卯泡膜变性、卯泡变形和严重出血,且输卯管内无成形蛋,说明疫苗免疫后14d产生保护力,免疫后28~135d均能提供良好的保护,抗体检测方法与病毒分离法、大体病变法结果均符合,个别组大体病变法判定的保护率偏低,这可能与产蛋期鸭对该病毒更为敏感有关。
3讨论与结论
生物制品的安全性是养殖业健康发展的前提条件。本研究通过5批GMP车间生产的鸭坦布苏病毒病灭活疫苗双倍剂量免疫生产中的雏鸭(樱桃谷鸭和北京鸭)和产蛋北京鸭,结果发现均没有明显免疫副反应,免疫后21d疫苗吸收良好,且对雏鸭的增重和产蛋鸭产蛋率无明显影响,说明疫苗安全性好。但不同品种的鸭对外界因素的敏感性差异比较大,为了不影响实际生产业绩,建议产蛋鸭在开产前进行免疫。
疫苗的效力是关键,尤其是临床效力更为直接和可靠。本研究通过5批GMP车间生产的鸭坦布苏病毒病灭活疫苗免疫生产中的北京鸭雏鸭和北京鸭产蛋鸭,免疫后14d发现抗体开始转阳,转阳率在40%~80%,免疫后28~135d的抗体转阳率不低于90%,且免疫后28d和135d攻毒血清的病毒分离率和卵巢病变发生率均可减少80%以上,说明疫苗保护效果好,免疫可以用于临床鸭坦布苏病毒病的防治。具体免疫过程为免疫后14d产生保护力,免疫持续期可以达免疫后135d。抗体检测法可用于临床疫苗效果评价,为临床疫苗的正确使用提供有效支撑。
参考文献:
[1]曹贞贞,张存,黄瑜等鸭坦布苏病毒病的初步研究[J]中国兽医杂志,2010,12(46):3-6
[2] SUN X.Y., DIAO Y.X., WANG J., et al Tembusu virus infection in Cherry Valley ducks: the effect of age at infection[J] Veterinary Microbiology, 2014,168(1):16-24

