盐种类对常压盐溶液法制备半水石膏的影响*
胡俊要,李 军,金 央,贾晓艳,余德芳
(四川大学化学工程学院,四川成都610065)
常压盐溶液法制备α半水石膏是近十几年发展起来的一种新方法,其具备不需要压力容器、反应条件较为温和等优点,但由于所需设备较复杂,目前尚处于实验室探索阶段[1]。 陈燕[2]指出 α半水石膏生长习性是针状或棒状。所以常压盐溶液法制备α半水石膏的关键在于对结晶形态的控制,而结晶形态受盐介质体系、转晶剂、温度、pH、搅拌转速、石膏原料性质、杂质等多种因素影响[3]。目前,关于常压盐溶液法制备α半水石膏的研究主要放在寻求合适的有机类转晶剂以及探究杂质对转晶的影响上,却对最基础的盐介质体系的研究甚少[4-7]。
盐介质体系及其浓度的确定是常压盐溶液法制备半水石膏的基础。岳文海等[8]通过常压盐溶液法制备半水石膏的实验证明了不同的盐介质对半水石膏的晶形有一定的影响。刘先锋[9]和郭会宾等[10]研究NaCl介质浓度对常压盐溶液法制备半水石膏晶形和转晶速率的影响时发现,NaCl浓度不仅影响二水石膏转晶速率,而且影响半水石膏晶体尺寸。盐介质体系通过影响二水石膏和半水石膏溶解度来影响二水石膏转晶速率,通过改变半水石膏各晶面比表面自由能来影响最终晶体形态[11]。 但何伟[12]研究CaCl2、MgCl2、KCl 3种盐浓度对脱硫石膏转晶的影响中并未发现3种盐的浓度对脱硫石膏转晶的影响规律。
笔者较系统地研究了几种常见的阴阳离子对二水石膏脱水转晶的影响,并参考几种盐介质在20℃下的溶解度,探究了盐介质的种类及浓度对转晶速率和产品晶体形貌的影响,从而为常压法制备半水石膏提供必要的理论和实践基础。
1 实验部分
实验原料为分析纯二水石膏,结晶水质量分数为 18.52%。 盐 介 质 有 NaCl、Na2SO4、NaNO3、CaCl2、MgCl2、NH4Cl、KCl、MgSO4、Ca(NO3)2,以氢氧化钠和盐酸调节盐溶液pH,以无水乙醇终止反应,以上试剂均为分析纯。采用常压盐溶液法制备半水石膏。将盐介质配成一定浓度的溶液,并用氢氧化钠和盐酸调节pH为5,按液固质量比为5∶1加入二水石膏,升温至95℃,持续搅拌反应4 h。每隔一定时间取样,用XDS-1B型倒置生物显微镜观察晶体形态,并记录转晶开始及终止时间,若转晶在4 h内完成则提前终止反应。每隔一定时间取样,过滤并用沸水洗涤3次,用无水乙醇终止反应,于60℃烘箱中干燥至质量恒定,参照GB/T 17669.2—1999《建筑石膏结晶水含量的测定》测定产品结晶水含量。
2 结果与讨论
2.1 不同阳离子对二水石膏脱水速率及产物晶形的影响
在液固质量比为5∶1、pH=5、反应温度为95℃、搅拌转速为200 r/min、盐溶液浓度为2.56×10-3mol/g条件下,反应时间设为4 h,考察不同阳离子对二水硫酸钙脱水速率以及产物晶体形貌的影响,结果见图1和图2。
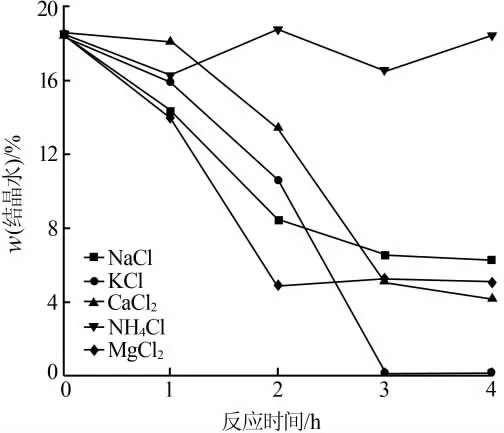
图1 不同阳离子体系对产物结晶水含量的影响
由图1可见,在保持阴离子全部为Cl-、阳离子浓度相同情况下, 转晶速率按 NH4+、Ca2+、K+、Na+、Mg2+顺序递增。这与陈燕[2]指出的二水石膏分解速率按 Ca2+、Mg2+、K+、NH4+、Na+顺序递增的规律不符,其原因是由于石膏原料的不同造成的。在NH4Cl溶液体系中没有发生转晶,其原因是该体系中二水石膏溶解度远低于半水硫酸钙溶解度,导致脱水转晶过程无法进行。在KCl溶液体系中,反应3 h产品所含结晶水降到0.11%,可见二水石膏完全脱水转变成无水石膏,通过对转晶过程的观察发现二水石膏先转变成长棒状半水石膏然后继续脱水生成无水石膏,说明二水硫酸钙、半水硫酸钙、无水硫酸钙溶解度依次降低,在KCl溶液体系中3种石膏中能稳定存在的是无水石膏。该结果与马宪法等[13]实验结果相吻合,其指出在较高KCl浓度和较高温度范围内(如95℃),α半水石膏会直接脱水转变成无水石膏。

图2 不同阳离子体系反应4 h时产物晶体的形貌
由图2看出,MgCl2溶液体系Mg2+对半水石膏晶形的控制效果最佳,晶体形态为棒状且尺寸最大,长径比为(10.6~14.7)∶1;NaCl溶液体系 Na+对半水石膏的晶形无控制作用,晶体习性仍长成针状,长径比为(13.2~18.0)∶1;KCl溶液体系,产品晶体形态并不是六方柱状,而是斜方片状,结合图1得知反应4 h后产品结晶水含量为0.11%,进一步验证了产品为无水石膏;CaCl2溶液体系Ca2+对半水石膏晶形的控制效果仅次于MgCl2溶液体系Mg2+对半水石膏晶形的控制效果,半水石膏的晶形为棒状,长径比为(10.0~12.8)∶1;在 NH4Cl溶液体系中,二水石膏无明显变化,体现不出NH4+对半水石膏晶体形态的影响。
从转晶产品半水石膏的晶体形态和转晶速率两方面考虑,在选择盐溶液介质体系时,优先考虑含有阳离子为Mg2+和Ca2+的盐介质溶液体系。
2.2 不同阴离子对二水石膏脱水速率及产物晶形的影响
在液固质量比 5∶1、pH=5.0、反应温度为 95 ℃、搅拌转速为200 r/min、盐溶液浓度为1.056×10-3mol/g条件下,反应时间设为4 h,考察不同阴离子对二水硫酸钙脱水速率以及产物晶体形貌的影响,结果见图3和图4。
由图3可见,在保持阳离子为Na+、阴离子浓度相同情况下,转晶速率按Cl-≈NO3-、SO42-顺序递增。其中在NaNO3和NaCl两种溶液体系中没有明显转晶现象,而在Na2SO4溶液体系中反应1 h后产物结晶水含量达到6.54%,转晶过程进行得很快。对比图1二水石膏在高浓度NaCl溶液体系中转晶成半水石膏,说明转晶速率不仅与盐介质种类有关,还与盐溶液浓度有关,盐溶液浓度通过造成二水石膏和半水石膏溶解度差来影响转晶速率,溶解度差越大转晶速率越快。
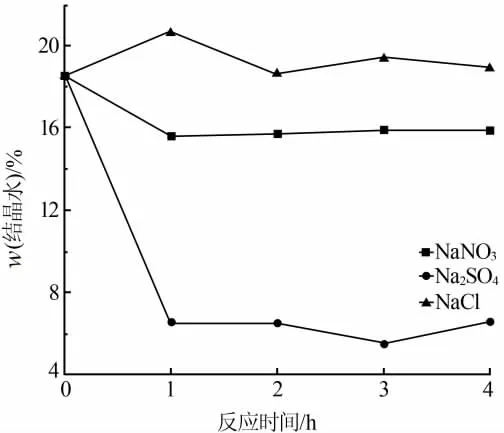
图3 不同阴离子体系对产物结晶水含量的影响

图4 不同阴离子体系反应4 h产物晶体的形貌
由图4看出,在NaNO3和NaCl两种体系中没有发生转晶,故不能分析出NO3-和Cl-对半水石膏晶形的影响,需要进一步进行实验验证分析。而在Na2SO4体系中存在针状和棒状两种晶体形态,说明SO42-通过改变部分半水石膏晶体表面自由能,达到控制晶体生长的效果。
2.3 盐介质体系的确立
通过对2.1节和2.2节阳离子和阴离子对二水石膏脱水速率以及产物晶体形貌的分析,为进一步探究和确立盐介质种类和浓度对二水石膏转晶速率和半水石膏晶形的影响,分别选择MgSO4、MgCl2、CaCl2、Ca(NO3)2盐介质体系进行实验。 以各种盐在20 ℃下溶解度为依据(见表1)[14],测试同种盐介质在不同浓度下对转晶过程的影响。在固液质量比为1∶5、pH=5.0、反应温度为 95 ℃、搅拌转速为 230 r/min条件下,反应时间最长控制在4 h,盐介质体系对二水石膏转晶起止时间的影响见表2,反应结束时产物晶体形貌见图5。

表1 20℃无机盐溶解度[14]
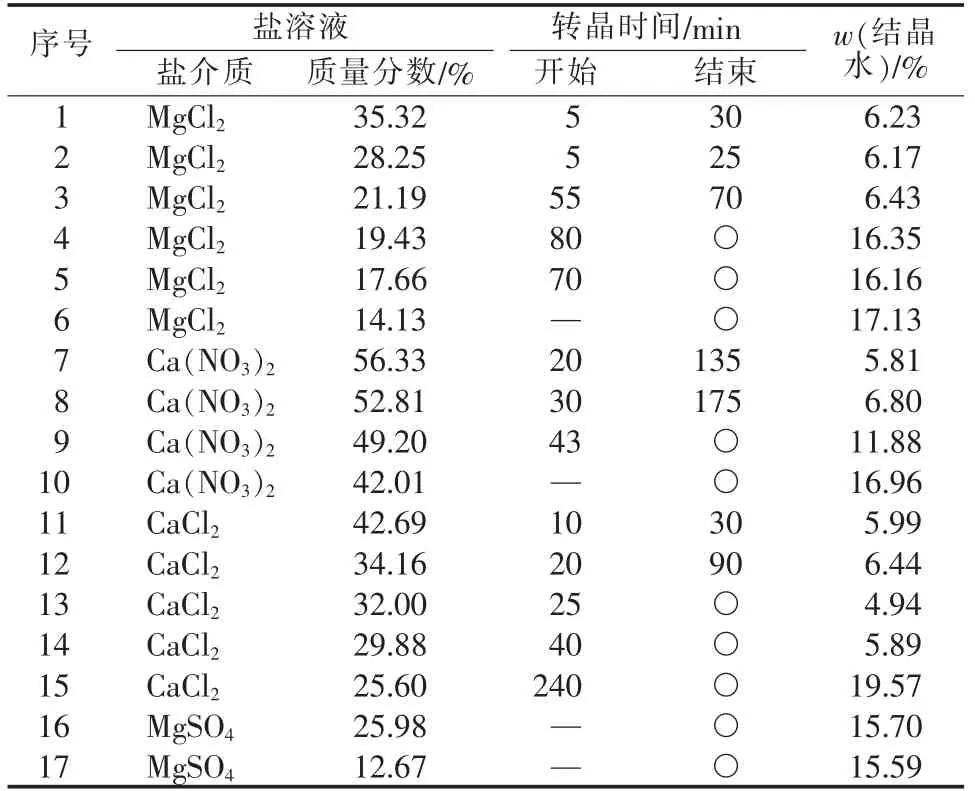
表2 盐介质体系对二水石膏转晶起止时间的影响
由表2 看出,二水硫酸钙在 MgCl2、CaCl2、Ca(NO3)23个体系中均发生了转晶。当盐介质浓度降低时转晶速率降低,当盐介质浓度低于一定值时转晶作用不再发生。如:在Ca(NO3)2质量分数为56.33%体系中转晶完成时间为135 min,当其质量分数降低到52.81%时转晶完成时间需要175 min,当其质量分数继续降低至42.01%时在4 h内并没有发生转晶。同时,每种盐介质体系使二水石膏在4 h内完成转晶的最低浓度差异也较大。如:在MgCl2体系中最低质量分数需要21.19%,在CaCl2体系中最低质量分数需要 34.16%,在Ca(NO3)2体系中最低质量分数需要52.81%。而在MgSO4介质体系中并没有发生转晶。在MgSO4质量分数为25.98%体系中反应结束时结晶水质量分数降低至15.70%,但并未有新的晶体出现,说明二水石膏和半水石膏在该体系中溶解度都较大,但这两种石膏溶解度差值较小使得转晶过程无法进行。

图5 盐介质体系对反应结束时晶体形态的影响
由图5看出:二水石膏在MgCl2、CaCl2浓度较高体系中转晶产物的晶体形貌都是针状,当MgCl2、CaCl2浓度降低时产物晶体尺寸变大,其中MgCl2体系中晶体形态呈纤维状,而CaCl2体系中晶体形态呈棒状。出现这种现象的原因是,在高浓度盐介质中二水硫酸钙和半水硫酸钙溶解度差值过大,使得转晶速率过快,钙、镁离子对半水晶体晶面微弱的吸附作用没有体现出来,半水晶体习性长成针状。但是在Ca(NO3)2体系中,无论盐介质浓度高低,最终产品晶体形态都呈细小棒状。主要是由于硝酸根吸附于半水石膏(111)面,减缓该晶面在c轴方向的生长,使得晶体生长成细小棒状。
3 结论
1)在NH4+、Ca2+、K+、Na+、Mg2+几种阳离子中,对二水硫酸钙转晶影响较大的是Mg2+、Ca2+、Na+,其不仅能提高转晶速率,而且对半水晶体形态也有一定的控制作用。 在 Cl-、NO3-、SO42-几种阴离子中,SO42-对转晶速率和晶体形态的影响更为明显。2)二水硫酸钙转晶与盐介质种类和浓度有关。在MgCl2、CaCl2、Ca(NO3)23 种体系中,二水石膏转晶速率随盐浓度降低而减小,同时阴阳离子对晶体晶面能的影响也会显现出来,使生成的半水晶体尺寸增大,但低于对应的盐浓度阈值转晶过程在4 h内无法进行。在MgSO4体系中,由于二水石膏和半水石膏溶解度差较小,导致转晶过程始终不能进行。3)利用常压盐溶液法制备半水石膏,在液固质量比为5∶1、pH=5.0、反应温度为95℃、搅拌转速为200~250 r/min条件下,在 21.19%MgCl2、34.16%CaCl2、52.81%Ca(NO3)23种盐介质体系中比较合适。

