利用DNA条形码技术的两种实蝇鉴定研究
王溪桥 尤 佳 王军平 文朝慧 满 岳
(甘肃出入境检验检疫局检验检疫综合技术中心,甘肃 兰州 730010)
实蝇,昆虫纲、双翅目Diptera、实蝇科Tephritidae昆虫的通称,英文名称fuit fly。全世界已知实蝇约500个属,4500多种,中国约存在400多种。实蝇体形中小,圆球形头部,中胸部发达,双翅具斑。实蝇是植食性昆虫,为害植物的根、茎、叶、花乃至果实。其中,35%的种类(约1500种)可能为害各种果,对农业有重要经济意义的实蝇种类超过100种,还有150多种是次要的或潜在的害虫。这些为害水果和蔬菜实蝇大部分属于寡鬃实蝇属Dacus、果实蝇属Bactrocera、小条实蝇属Ceratitis、绕实蝇属Rhagoletis和按实蝇属Anastrepha等。其中,具明显重要性的种类,如地中海实蝇、桔小实蝇、昆士兰实蝇、枣实蝇都是著名的有害实蝇种,这些种类在世界各国均属检疫对象。中国已发现若干种类为害柑橘、芒果、青枣、杨桃、枣、番石榴、梨、瓜等果蔬的重要害虫,例如桔小实蝇、柑橘大实蝇、蜜柑大实蝇、南瓜实蝇、枣实蝇、番石柳实蝇、瓜实蝇、枣实蝇、枸杞实蝇等[1]。具条实蝇Bactrocera scutellata和南瓜实蝇Bactrocera tau均隶属于双翅目Diptera实蝇科Tephritidae果实蝇属Bactrocera,该属昆虫主要分布于亚洲热带、亚热带和暖温带以及澳大利亚和南太平洋地区,少数种类分布于非洲南部和夏威夷群岛[2]。对实蝇类害虫进行积极防控和严格检疫,防止其侵入我国,对保障国内农业生产安全具有重大意义。
传统形态鉴定只能针对成虫,对成虫虫体的完整性要求较高,需要有较丰富的分类经验和技能的鉴定人员完成。此外,近似种之间的外部形态特征区别微小,部分形态非常相似,这也给传统形态分类增加了难度。近年来,随着分子生物学技术技术的快速发展,各种分子水平的检测手段被广泛应用于实蝇的种类鉴定,如AFLP、RFLP以及DNA测序等[3]。DNA条形码(DNA barcode)是指生物体内能够代表该物种的、标准的、有足够变异的、易扩增且相对较短的DNA片段。受零售业中被作为产品通用代码的商品条形码的启发,加拿大Guelph 大学的分类学家Paul Hebert在2003年首次提出DNA 条形码概念, 即利用线粒体细胞色素C氧化酶亚单位I(COI)的特定基因序列区域来做DNA 条形编码的基础,用于物种鉴定[4]。通过分析COI基因及其来源基因组核苷酸含量之间的关系,结果表明800余个COI基因5 端的DNA条形码序列准确地代表了其来源完整线粒体的基因信息,证明对于未测序的基因组,从DNA 条形码序列可以快速检测并预测其完整基因组的组成。目前,随着DNA条形码技术的迅速发展,全球分类学家认识到分子手段检测鉴定物种的重要性,对Genbank数据库中COI基因序列的条目的贡献不断增加,使DNA条形码鉴定技术的优势愈发凸显,与传统鉴定方法相比,操作简便,准确度高,检测样本范围扩大,即使样本部分受损,仅用少量生物样本即可检测鉴定,也不会影响识别结果[5-14]。
我国对果实蝇属的条形码研究也取得了一定进展,梁亮等(2011)对中国果实蝇属25种的155条COⅠ基因序列进行了遗传距离分析和构建发育树,最终得出,COI基因条码序列能对除桔小实蝇复合体外的部分中国果实蝇属种类能进行准确鉴定[15]。刘慎思等(2012)针对桔小实蝇桔小实蝇 B.dorsalis 的卵、幼虫、蛹以及成虫的残缺肢体样本,利用DNA条形码技术,建立了利用DNA条形码技术的实蝇类害虫快速鉴定技术体系,结果表明DNA条形码技术完全可以用于口岸截获的实蝇幼体及残体的准确鉴定[16]。李静等(2014)利用COI基因片段,对入境旅客非法携带的实蝇幼虫进行了序列测定,并对培养出的成虫进行了形态鉴定,最终确定了实蝇种类,为检疫部门的DNA条码技术在实蝇鉴定中的应用提供了重要依据[17]。
1 材料和方法
1.1 供试样品
供试具条实蝇Bactrocera scutellata (Hendel)、南瓜实蝇Bactrocera tau标本由甘肃出入境检验检疫局检验检疫综合技术中心外繁种子实验室采集,标本浸入100%无水乙醇中-20℃条件下保存。
1.2 方法
1.2.1 形态鉴定
依据吴佳教等[1]资料,测量并综合分析各实蝇形态特征,采用LEICA M205A体式显微镜及LEICA DMC4500显微成像系统拍摄整体和局部形态特征进行鉴定。
1.2.2 DNA提取
实蝇标本的DNA提取使用TaKaRa公司MiniBEST Universal Genomic DNA Extraction Kit试剂盒。剪取实蝇标本25mg肢体,参照试剂盒说明书进行DNA提取。以ddH2O为空白对照,使用试剂盒进行提取操作。使用Eppendorf BioSpectrometer微量核酸蛋白检测仪对提取得到DNA进行检测。
1.2.3 样本DNA的PCR扩增及测序
1.2.3.1 PCR扩增
参考Folmer所使用的PCR扩增引物[18],使用通用引物进行DNA扩增,引物序列LCO1490,5'-GGTCAACAATCATAAAGATATTGG-3';HCO21985'-TAAACTTCAGGGTGACCAAAAAATCA-3'。由宝生物(TAKARA)公司委托合成。PCR反应使用TAKARA公司Premix Taq(R004A)试剂盒,反应扩增体系为 25.0μl, 包 含 premix taq12.5μl、20μmol/L 上、 下 游引 物 各 1.0μl、 模 板 DNA2.0μl、ddH2O8.5μl。PCR 仪使 用Eppendorf Mastercycler nexus,反 应 程 序:94℃预 变 性 3min;94℃ 45s,50℃ 45s,72℃ 45s,35个循环;72℃延伸10min。COI基因PCR扩增粗产物大小应为为685bp。PCR产物4℃保存,1.5%琼脂糖凝胶进行电泳检测,DNAmarker使用TAKARA公司DL1000DNAmarker。
1.2.3.2 PCR产物测序及基因序列比对分析
PCR产物经琼脂糖凝胶电泳检测确证后,送苏州金唯智公司进行PCR产物纯化及测序。将得到的DNA序 列 在 NCBI( 网 址 https∶//blast.ncbi.nlm.nih.gov) 及BOLDsystem(网址 http∶//www.boldsystems.org)在线数据库进行比对分析。
2 结果与分析
2.1 形态鉴定结果
2.1.1 具条实蝇 B.(Zeugodacus)scutellata
形态特征:成虫黑色与黄色相间。头部中颜板具一对黑色大颜面斑,呈卵圆形。上侧额鬃1对,下侧额鬃3对;具内顶鬃、外顶鬃和颊鬃;单眼鬃细小或缺如。中胸背板黑色,缝后侧黄色条终于翅内鬃着生处或其之后处,缝后中黄色条梭形或线形;肩胛和背侧板胛黄色,横缝两侧具黄色斑伸向中部;前翅上鬃、小盾前鬃和翅内鬃存在,背中鬃缺如。小盾片较扁平,黄色,具黑色端斑,此斑大并伸越到两小盾端鬃之外,小盾鬃1对。后小盾片和中背片全为黑色。翅前缘带黑色,翅端扩展成斑;dm-cu横脉覆盖褐色斑,该斑伸达翅后缘,前端可能不连续;臀条宽;bm室长是宽的2倍;cup室后端角延伸段长,其长度超过A1+CuA2脉段长。足淡黄色,各足腿节不具暗色斑,后足胫节基部1/3黑褐色。第2~4节腹背板黑色,基横带宽,但第4和第5腹背板的基横带中部有时分离;第3~5节腹背板具黑褐色中纵带,该纵带有时在各节的端部处中断;第5腹背板具椭圆形腺斑。(图1、2)

图1 具条实蝇背面

图2 具条实蝇侧面
2.1.2 南瓜实蝇 B.(Zeugodacus)tau
形态特征:成虫黑色与黄色相间。头部颜面黄色;颜面斑黑色,中等大,近卵形。上侧额鬃1对,下侧额鬃2对或3对或以上;具内顶鬃、外顶鬃和颊鬃;单眼鬃细小或缺如。触角显长于颜面长。中胸背板黑色带橙色或红褐色区;介于缝后中黄色条和侧黄色条之间的大部分区域、肩胛后至横缝间的2大斑、背板中部前缘至黄色中纵条前端的狭纵纹均为黑色;肩胛、背侧胛、缝前1对小斑均为黄色;缝后侧黄色条终止于翅内鬃着生处或其后之处,缝后中黄色条泪珠状;前翅上鬃、小盾前鬃和翅内鬃存在、背中鬃缺如。小盾片黄色,具黑色基横带,小盾鬃2对。后小盾片和中背片中部均为浅黄色或褐橙色,两侧带暗色斑。翅斑褐色,前缘带于翅端扩成1椭圆形斑,该斑约占据R4+5室宽度的1/3;dm-cu和r-m横脉上均无横带;臀条宽阔,伸达后缘;A1+CuA2脉段长。足淡黄色,前足、中足和后足腿节暗色斑段占其各自腿节长的比例约为0%~30%。第2和第3腹背板的前部各具1黑色横带;第4和第5腹背板的前侧部常具黑色短带;黑色中纵条自第3腹背板的前缘伸达第5腹板后缘,第5腹背板具腺斑。(图3、4)

图3 南瓜实蝇背面

图4 南瓜实蝇侧面
经形态鉴定,2种实蝇的形态特征与资料中具条实蝇B.(Zeugodacus)scutellata 和南瓜实蝇 B.(Zeugodacus)tau一致。
2.2 DNA提取结果
根据试剂盒说明书提取得到DNA溶液经检测,具条实蝇DNA溶液浓度为35.3μg/ml,A260/280=1.93;南瓜实蝇DNA浓度为29.6μg/ml,A260/A280=1.75。故所得实蝇标本DNA浓度及纯度质量较高,可以进行下一步PCR反应。
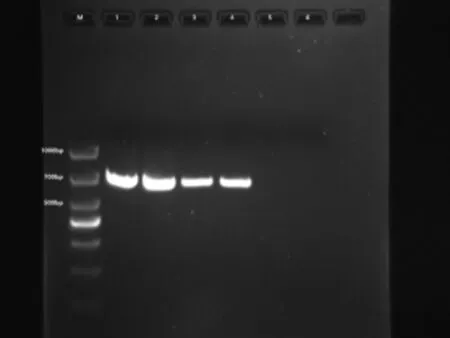
图5 实蝇标本各样品PCR产物1.5%琼脂糖凝胶电泳检测结果
2.3 PCR扩增结果
以本研究中2种实蝇标本所提取的样品DNA为模版进行的PCR扩增反应,扩增所得PCR产物经1.5%琼脂糖凝胶电泳。检测结果如图5所示,M泳道为DNAmarker(TAKARA,DL1000)1-4泳道在 685bp处有清晰条带。其中1、2泳道为具条实蝇标本样品,3、4泳道为南瓜实蝇标本样品,5、6泳道为空白对照。
2.4 PCR产物测序及基因序列比对分析结果
将2种实蝇样品DNA扩增产物测序获得的线粒体COI基因序列,在NCBI及BOLDsystem数据库比对结果显示,具条实蝇样品的COI基因序列同NCBI及BOLDsystem数据库中具条实蝇标准序列的相似度最高分别为99%(GENEBANK登录号KJ753946.1)、99.53%;南瓜实蝇样品的COI基因序列相似度最高分别为99%(GENEBANK登录号KJ753947.1)、99.85%。2种数据库对比结果中,相似度最高的前20个已公开COI标准序列均为目标物种序列。结果表明,实验用样品扩增其COI基因序列,通过序列比对,可以证实为具条实蝇及南瓜实蝇。
3 结论与讨论
本研究通过传统形态鉴定方法,辅助以DNA条形码技术,对2种常见有害实蝇进行了鉴定研究。实验结果表明,传统形态学鉴定结果同DNA条形码分子鉴定结果一致,可以相互印证,对2种实蝇成功进行了鉴定。
植物检疫实验室对实蝇类害虫的鉴定,不仅需要依靠检疫人员具有丰富的经验积累,也完全依赖对实蝇虫体完整性的依赖。随着分子生物学检测鉴定方法的发展,利用DNA 条形码技术建立的物种鉴定方法已广泛应用于实蝇及各类有害生物的检疫鉴定。本试验在形态鉴定的基础上,采用分子生物学方法,仅使用25mg虫体材料,既能对样品进行比对鉴定,是实蝇鉴定传统形态学方法的良好补充和辅助。从DNA提取、PCR扩增到测序比对得到结果,仅需要3d,大大提高了植物检疫实验室检疫鉴定的周期。特别是利用DNA条形码技术,使用少量样品材料未来可以对无法形态学鉴定的幼虫、蛹及昆虫残体等进行初步鉴定,为植物检疫人员提供了新的检疫鉴定手段。
[1]吴佳教,梁帆,梁广勤.实蝇类重要害虫鉴定图册[M].广州:广东科技出版社,2009.
[2]中华人民共和国WTO/TBT-SPS 国家通报咨询中心.中国国家有害生物检疫信息平台.2017.//www.pestchina.com/SitePages/Home.aspx[OL].
[3]朱振华,叶辉,张智英.基于mtDNA Cytb 的六种果实蝇的分子鉴定(双翅目:实蝇科)[J].昆虫学报,2007,48(3):386-390.
[4]傅美兰,彭建军,王莹,等.DNA条形码技术的应用与分析[J].河南师范大学学报(自然科学版),2010,38(4):118-122.
[5]王建国,刘志文,汪涛,等.DNA条码技术在检疫性实蝇分类中的运用[C].第三届全国生物入侵大会论文摘要集.海南,海口:441.
[6]赵广宇,李虎,杨海林,等.DNA 条形码技术在昆虫学中的应用[J].植物保护学报,2014,41(2):129-140.
[7]闫娇,姜丽,郭琴,等.DNA 条形码技术在双翅目昆虫中的应用[J].天津师范大学学报(自然科学版),2015,35(3):66-72.
[8]乔玮娜,万方浩,张爱兵,等.DNA条形码技术在田间常见蓟马种类识别中的应用[J].昆虫学报,2012,55(3):344-356.
[9]莫帮辉,屈莉,韩松,等.DNA条形码识别Ⅰ.DNA条形码研究进展及应用前景[J].四川动物,2008,27(2):303-306.
[10]杜启艳,常重杰.DNA条形码在鉴定物种中的应用[J].生物学教学,2010,35(12):60-61.
[11]姜帆,刘佳琪,李志红,等.基于DNA条形码的广西苦瓜中实蝇幼虫分子鉴定研究[J].植物保护,2011,37(4):150-153.
[12]常虹.口岸截获小蠹科昆虫DNA条形码技术研究[M].南京:南京林业大学,2013.
[13]龚秀泽,Buahom Noppara,卢厚林,等,利用DNA条形码技术对截获瓜实蝇幼虫的鉴定研究[J].植物检疫,2014,28(1):57-60.
[14]尤欢,周力兵,邓裕亮,等.云南边境地区果实蝇属种类DNA条形码鉴定[J].昆虫学报,2014,57(11):1343-1350.
[15]梁亮,江威,余慧,等.中国果实蝇属种类的DNA条形码鉴定(双翅目,实蝇科).动物分类学报,2011,36(4):325-932.
[16]刘慎思,张桂芬,万方浩.基于mtDNA COI基因的离腹寡毛实蝇属常见种DNA条形码识别和系统发育分析[J].昆虫学报,2014,57(3):343-355.
[17]李静,王珅,王建昌,等.入境旅客非法携带番石榴中实蝇幼虫的分子鉴定[J].安徽农业科学,2014,42(32):11350–11352.
[18]Folmer O,Black M,Hoeh W,et al.DNA peimers for amplification of mitochondrial cytochrome C oxidase subunit I from diverse metazoan inver-tebrate[J].Mol Mar Blot Biotechnol,1994(3):294-299.

