水环境中海水小球藻和塔胞藻对苯并[K]荧蒽致毒胁迫的响应
王洪斌 成群 谢冰倩 高力 丁浚哲 韩秉言

摘要:以2种海洋微藻的生长量、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、过氧化氢酶(CAT)和丙二醛(MDA)为检测指标,研究海水小球藻(Chlorella vulgaris)和塔胞藻(Pyramidomonas delicatula)对苯并[k]荧蒽的致毒胁迫的生理响应,揭示出多环芳烃化合物对水环境污染的重要性。结果顯示,苯并[k]荧蒽对2种海洋微藻生长都存在抑制作用,海水小球藻的抑制率最高达62%,并存在剂量效应;适当浓度的苯并[k]荧蒽对塔胞藻生长有短时刺激作用,高浓度的苯并[k]荧蒽对塔胞藻有强烈的抑制作用,其最大抑制率达到89%。添加固定浓度(9 μg/L)苯并[k]荧蒽处理2种微藻,海水小球藻体内ACP活性至72 h达最大值,与对照组相比,增加32%,塔胞藻48 h达到最大,升高105%;AKP活性变化趋势与ACP活性基本一致;海水小球藻CAT活性至72 h达到最大值,是对照组的2.3倍,塔胞藻CAT活性至48 h即达最高,为对照组的2.5倍;2种微藻MDA含量随着苯并[k]荧蒽暴露时间的增加而升高,与对照组相比,海水小球藻和塔胞藻在72 h MDA含量分别升高73%、81%;苯并[k]荧蒽对海洋微藻的致毒效应存在种属差异,对塔胞藻的致毒效应大于海水小球藻。
关键词:苯并[k]荧蒽;海水小球藻(Chlorella vulgaris);塔胞藻(Pyramidomonas delicatula);致毒胁迫效应
中图分类号:TQ450.2 文献标识码:A 文章编号:0439-8114(2018)07-0036-05
DOI:10.14088/j.cnki.issn0439-8114.2018.07.008
Responses of Chlorella vulgaris and Pyramidomonas delicatula to the Toxic Effects of Benzo [k] Fluoranthene in Water Environment
WANG Hong-bin1,CHENG Qun1,XIE Bing-qian1,GAO Li1,DING Jun-jie2,HAN Bing-yan2
(1.College of Marine Life and Fisheries,Huaihai Institute of Technology,Lianyungang 222005,Jiangsu,China;
2.Jiangsu Xinhai Senior High School,Lianyungang 222005,Jiangsu,China)
Abstract: In this paper,the growth of two kinds of marine microalgae,acid phosphatase(ACP),alkaline phosphatase (AKP),catalase(CAT) and malondialdehyde(MDA) were used as indicators to study the responses of Chlorella vulgaris and Pyramidomonas delicatula to the toxic effects of benzo[k] fluoranthene in water environment and to reveal the importance of polycyclicaromatic-hydrocarbons for water pollution. The results showed that benzo[k] fluoranthene had inhibitory effect on the growth of two kinds of marine microalgae, and the inhibition rate of benzofluoranthene to C. vulgaris was up to 62%,and there was dose effect. The proper concentration of benzo[k] fluoranthene had a short time stimulating effect on P. delicatula,while high concentration of benzo[k] fluoranthenes had a strong inhibitory effect on P. delicatula,and its maximum inhibition rate was 89%. Two kinds of microalgae were prepared by adding fixed concentration(9 μg/L) of benzo[k] fluoranthene,the results showed the ACP of C. vulgaris reached the maximum at 72 h,which was 32% higher than that of the control group,while the ACP activity of P. delicatula reached the maximum at 48 h and increased by 105%. The trend of AKP activity was consistent with that of ACP. The CAT activity in C. vulgaris reached the maximum at 72 h,which was 2.3 times higher than that in the control group,and the activity of CAT was up to 48 h,which was 2.5 times of that of the control group. The content of MDA in two kinds of microalgae increased with the exposure time of benzo[k] fluoranthene. Compared with the control group,the contents of MDA in C. vulgaris and P. delicatula were increased by 73% and 81% at 72 h respectively. There was a difference in the toxic effects of benzo[k] fluoranthene on marine microalgae,and the toxic effects on P. delicatul were serious on C. vulgaris.
Key words: benzo[k] fluoranthene; Chlorella vulgaris; Pyramidomonas delicatula; toxic effects
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是指分子中含有兩个或两个以上苯环的碳氢化合物,是一种广泛分布的持久性环境污染物,形成于所有有机物质的高温分解过程[1],例如煤、石油、汽油以及木材的不完全燃烧[2]。多环芳烃广泛分布在环境介质当中,虽然其含量较低,但可以通过水质、大气、土壤、食物等多种有效途径进入人体并富集,具有致癌变、致畸变、致突变的三致作用,还具有高毒性、低流动性、难降解性[3],是诱导人类癌症的重要环境污染物之一,引起了各界学者及环境保护界人士的广泛关注。美国环保局[3]先后确定出16种PAHs作为优先控制污染物,其中苯并[k]荧蒽(Benzo[k] fluoranthene,BkF)等7种多环芳烃具有致癌性质[4]。多环芳烃广泛分布在中国海洋近岸的水体和地质中,丘耀文等[5]对深圳湾海域多环芳烃含量的分析发现,2004年2月深圳湾海水中多环芳烃总含量为(69.4±24.7) ng/L,而且在1948-2004年,深圳海湾柱状沉积物中PAHs的浓度总体上呈上升趋势。苯并[k]荧蒽是一种较为典型且具有代表性的PAHs,它对近海海域造成的污染已经引起了人们的高度重视。
微藻在海洋生物中所占的比重约为40.86%[6],其固定碳的量约占全球有机物的50%[7],藻类作为各大类水体中重要的初级生产者,在整个生态系统中有着举足轻重的地位[8]。而苯并[k]荧蒽可以通过各种途径进入水体,藻类则会首先遭受其毒害作用。本研究从浮游藻类的视角,通过研究海水小球藻(Chlorella vulgaris)和塔胞藻(Pyramidomonas delicatula)对苯并[k]荧蒽的致毒胁迫的生理响应,为多环芳烃化合物对水环境污染的危害程度提供理论依据。
1 材料与方法
1.1 材料
海水小球藻和塔胞藻藻种均由淮海工学院海洋生命与水产学院藻类实验室保存;本试验中所用海水均取自江苏省连云港市连岛海域涨潮时,海水盐度为31.00‰~32.00‰,经醋酸纤维素薄膜过滤后,于121 ℃下,高压灭菌20 min后备用;苯并[k]荧蒽购自上海源叶生物有限公司(纯度为98%);酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、过氧化氢酶(CAT)和丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所;微藻培养采用通用的f/2营养液;其他化学试剂均为分析纯。
1.2 方法
1.2.1 微藻培养及微藻细胞破碎 250 mL的三角烧瓶中加入150 mL的f/2营养液和10 mL的藻种,混合均匀,置于光照培养箱中进行封闭式培养,光照度为3 000 lx,培养温度为(22±1) ℃,明暗周期为12 h/12 h。培养过程中每天定时摇动3次,摇瓶过程中随机调换位置,以避免光照不均。
量取待测藻液20 mL,5 000 r/min离心10 min,弃上清,沉淀物加入10 mL 0.05 mol/L磷酸缓冲液(pH 7.8),采用超声波破碎藻细胞(破碎条件为功率300 W,时间10 min,超声破碎3 s、间隔7 s循环),镜检无完整细胞,5 000 r/min离心10 min,取上清液用作检测ACP、AKP、CAT活性以及MDA含量用。
1.2.2 甲醇对微藻生长量的影响 苯并[k]荧蒽溶液是用甲醇配制而成,所以在研究苯并[k]荧蒽对海洋微藻影响时可能会受到甲醇的干扰。在藻类生长至对数生长期时加入与苯并[k]荧蒽等体积梯度的纯甲醇溶液,2种微藻试验组分别加入0、100、200、300、400、500 μL的甲醇,吸光度法(680 nm)检测其生长量,24 h测定一次,直至120 h,试验设置3个平行。
1.2.3 苯并[k]荧蒽对微藻生长量的影响 150 mL对数期微藻藻液,添加不同浓度梯度苯并[k]荧蒽,参考文献[9],2种微藻试验组分别加入0、100、200、300、400、500 μL的苯并[k]荧蒽甲醇溶液,对应浓度为0、3、6、9、12、15 μg/L;吸光度法(680 nm)检测其生长量,24 h测定一次,直至120 h,试验设置3个平行。
1.2.4 ACP、AKP、CAT活性和MDA含量的测定
对数期微藻,添加0、9 μg/L的苯并[k]荧蒽,对其ACP、AKP、CAT活性和MDA含量进行测定,时间间隔 24 h,直至120 h,试验设置3个平行。
ACP、AKP、CAT活性和MDA含量的测定按照试剂盒的说明书进行。
2 结果与分析
2.1 甲醇对2种海洋微藻生长量的影响
按“1.2.2”方法,海水小球藻和塔胞藻试验组中分别添加与苯并[k]荧蒽相同体积的甲醇溶液,其结果见图1。由图1可知,甲醇溶液对2种海洋微藻的生长无影响,试验组与对照组均生长良好,增长趋势基本一致,由此表明,由甲醇配制出的苯并[k]荧蒽溶液中的甲醇载体未对本试验设计产生干扰。
2.2 苯并[k]荧蒽对2种海洋微藻生长量的影响
苯并[k]荧蒽对2种微藻生长量的影响见图2。由图2A可知,随着海水小球藻培养时间延长,未加苯并[k]荧蒽的对照组具明显增长趋势,苯并[k]荧蒽的暴露浓度在海水小球藻生长前期基本无影响,48 h后,试验组有明显被抑制现象,生长缓慢,且随着苯并[k]荧蒽浓度增大抑制作用加强,至120 h,浓度为3、6、9、12、15 μg/L苯并[k]荧蒽对海水小球藻的抑制率分别为50%、51%、51%、58%、62%,抑制率均大于50%,并存在剂量效应,经t检验分析,5个浓度试验组均与对照组存在极显著差异(P<0.01)。苯并[k]荧蒽处理塔胞藻120 h后的生长量见图2B,在试验前期(24 h前),暴露在苯并[k]荧蒽中的塔胞藻同对照组基本无差别,均生长良好,48 h后,苯并[k]荧蒽对塔胞藻有明显抑制生长现象,与海水小球藻相比,抑制存在波动性,表明适当浓度的苯并[k]荧蒽对塔胞藻生长有短时刺激作用,至120 h,浓度为3、6、9、12、15 μg/L苯并[k]荧蒽对塔胞藻的抑制率分别为63%、58%、70%、76%及89%,后期及高浓度的苯并[k]荧蒽具强烈的毒性效应,经t检验分析,5个浓度试验组均与对照组存在极显著差异(P<0.01)。
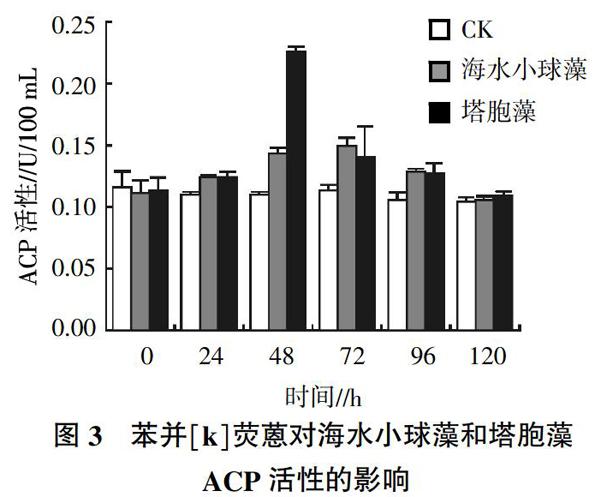
2.3 苯并[k]荧蒽对2种海洋微藻ACP活性的影响
按“1.2.4”方法所述,添加9 μg/L苯并[k]荧蒽处理2种微藻,ACP活性变化见图3,随着培养时间的递增,海水小球藻体内ACP活性逐渐增高,持续至72 h达最大值,增加32%,后缓慢降低,120 h恢复对照组水平;而塔胞藻随着培养时间延长,24 h后开始升高,48 h达到最大,与对照组相比,升高105%,经t检验分析,与对照组差异极显著(P<0.01)。
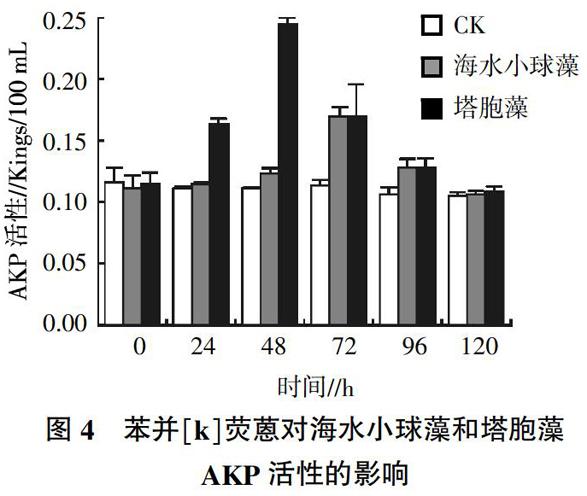
2.4 苯并[k]荧蒽对2种海洋微藻AKP活性的影响
由图4可知,苯并[k]荧蒽处理2种微藻的AKP活性变化趋势与ACP基本一致,就整体趋势而言,试验初期,海水小球藻体内的AKP活性较稳定,直至48 h后,小球藻体内AKP才略有增加,海水小球藻培养至72 h,体内AKP活性最高,与对照组相比,升高49%,120 h后恢复到对照组水平;塔胞藻体内AKP活性随着培养时间延长而逐渐升高,24 h即增加49%,48 h即达最高值,与对照组相比,升高123%,经t检验分析,与对照组差异极显著(P<0.01),72 h AKP活性仍然高出对照组近50%,120 h后试验组与对照组基本无差异。
2.5 苯并[k]荧蒽对2种海洋微藻CAT活性的影响
苯并[k]荧蒽处理2种微藻的CAT活性变化结果见图5,24 h CAT活性即迅速升高,2种微藻体内CAT活性增加与苯并[k]荧蒽暴露时间呈现正相关趋势,海水小球藻增加趋势持续至72 h达到最大值,是对照组的2.3倍,经t检验分析,与对照组差异极显著(P<0.01),自96 h开始,CAT活性降低,120 h恢复至对照组水平;随着培养时间的延长,塔胞藻CAT活性自24 h急剧升高,趋势较海水小球藻更为明显,至48 h即达最高值,为对照组的2.5倍,经t检验分析,与对照组差异极显著(P<0.01),CAT活性在高位持续至96 h,120 h后,试验组又基本恢复至对照组水平。
2.6 苯并[k]荧蒽对2种海洋微藻MDA含量的影响
苯并[k]荧蒽处理2种微藻MDA含量变化见图6,随着培养时间的延长,2种微藻MDA含量随着苯并[k]荧蒽暴露时间的增加而升高,与对照组相比,海水小球藻在24、48、72、96 h MDA含量分别升高59%、70%、73%、72%,经t检验分析,与对照组差异极显著(P<0.01),继續培养至120 h后,海水小球藻MDA恢复对照组水平;塔胞藻MDA含量24 h即开始剧烈升高,在24、48、72、96 h MDA含量分别升高55%、68%、81%、61%,经t检验分析,与对照组差异极显著(P<0.01),与海水小球藻不同,塔胞藻继续培养至120 h,其MDA含量依然高出对照组65%。
3 讨论
苯并[k]荧蒽对2种海洋微藻生长都存在抑制作用,本研究设计的所有质量浓度试验组对海水小球藻的抑制率均大于50%,最高达62%,并存在剂量效应;与对照组相比,后期及高浓度的苯并[k]荧蒽具强烈的毒性效应,生长量的变化与MDA含量检测结果相一致,张智华等[10]研究也指出,低浓度的蒽菲芘(50 μg/L)对小新月菱形藻具有促进作用,而高浓度的蒽菲芘(100~200 μg/L)对小新月菱形藻生长具有抑制作用,本试验结果也呈现类似结论。苯并[k]荧蒽的暴露浓度对于海水小球藻的作用效果没有明显差异性,而塔胞藻的作用效果具有波动性,表明适当浓度的苯并[k]荧蒽对塔胞藻生长有短时刺激作用,高浓度的苯并[k]荧蒽对塔胞藻有强烈的抑制作用,其最大抑制率达到89%。苯并[k]荧蒽对2种微藻的致毒胁迫存在种属差异性。
本试验设计添加固定浓度(9 μg/L)苯并[k]荧蒽处理2种微藻,随着培养时间的递增,海水小球藻体内ACP活性至72 h达最大值,增加32%,而塔胞藻随着培养时间延长,48 h达到最大,与对照组相比,升高105%。对2种微藻AKP活性的影响趋势与ACP基本一致;2种微藻体内CAT活性增加与苯并[k]荧蒽暴露时间呈现正相关趋势,小球藻增加趋势持续至72 h达到最大值,与对照组相比,是其2.3倍,塔胞藻CAT活性自24 h急剧升高,趋势较小球藻更为明显,至48 h即达最高值,为对照组的2.5倍,CAT活性在高位持续至96 h,ACP、AKP和CAT活性变化说明2种海洋微藻对苯并[k]荧蒽的致毒胁迫产生应激响应,短时间内刺激ACP、AKP和CAT活性升高,特别是CAT活性变化明显,结果与生长量的变化一致。
张智华等[10]也指出,小新月菱形藻的CAT活性和MDA含量在蒽菲芘作用下会有不同程度的升高,细胞损伤加剧。任加云等[11]、沈忱[12]指出进入生物体中的污染物在分解代谢过程中能够形成多种中间产物,并产生大量的活性氧物质,造成生物体的氧化损伤,一些抗氧化防御系统能够转化超氧阴离子自由基,从而使得机体免受损伤。本试验苯并[k]荧蒽胁迫2种微藻,2种微藻MDA含量随着苯并[k]荧蒽暴露时间的增加而升高,与对照组相比,小球藻在72 h MDA含量升高73%,继续培养至120 h后,小球藻MDA含量恢复对照组水平;塔胞藻24 h即开始剧烈升高,塔胞藻在72 h MDA含量分别升高81%,与小球藻不同,塔胞藻继续培养至120 h,其MDA含量依然高出对照组65%,可能由于苯并[k]荧蒽对塔胞藻致毒效应强,塔胞藻120 h后本身藻体活性减弱,死亡率加剧而导致MDA含量仍然维持高位。王丽平等[9]也指出,荧蒽胁迫对藻细胞的膜脂质过氧化作用有明显增强的迹象,藻细胞的MDA含量对苯并[k]荧蒽毒性较为敏感,是个潜在的有价值的参考指标。
本试验从浮游藻类的视角,通过研究海水小球藻和塔胞藻的生长、部分抗氧化酶活性及MDA含量对苯并[k]荧蒽的致毒胁迫的响应,旨在为揭示多环芳烃化合物对水环境污染的重要性,并研究海洋微藻在水环境污染治理及修复中的潜在应用。
参考文献:
[1] HONG D D,KIM T H,HWANG M S,et al. Effects of salinity on chlorophyll fluorescence from Porphyra thalli and comparison of species with different intertidal distribution[J].Fishery Aquaculture Technology,1998,1(1):122-128.
[2] 黄 仿,武 宝.热胁对球等鞭金藻作用机制的叶绿素荧光的研究[J].广西师范大学学报(自然科学版),1995,13(2):72-76.
[3] TERAWAKI T,YOSHIKAWA K,YOSHIDA G. Ecology and restoration techniques for Sargassum beds in the Seto Inland Sea,Japan[J].Marine Pollution Bulletin,2003,47(1):198-201.
[4] 董繼元,王式功,尚可政.黄河兰州段多环芳烃生态风险的初步评价[J].农业环境科学学报,2009,28(9):1892-1897.
[5] 丘耀文,张 干,郭玲利,等.深圳湾生态系统多环芳烃(PAHs)特征及生态危害[J].环境科学,2007,28(5):1054-1061.
[6] 刘新宁.重金属离子处理塔胞藻生物学效应的研究[D].济南:山东大学,2006.
[7] 冯一宁,刘均洪.转基因微藻的研究进展[J].江苏化工,2004, 32(5):15-18.
[8] 王洪斌,花文凤,李信书,等.硝基苯和间苯二酚对3种海洋微藻的毒理效应[J].海洋科学,2013,37(5):39-44.
[9] 王丽平,郑丙辉,孟 伟.荧蒽对两种海洋硅藻生长、SOD活力和MDA含量的影响[J].海洋通报,2008,27(4):53-58.
[10] 张智华,蔡恒江,张俊新.蒽、菲、芘对小新月菱形藻的毒性研究[J].广州化工,2015,43(19):95-98.
[11] 任加云,潘鲁青,苗晶晶.苯并(a)芘和苯并(k)荧蒽混合物对栉孔扇贝毒理学指标的影响[J].环境科学学报,2006,26(7):1180-1186.
[12] 沈 忱.苯并(a)芘对海洋微藻毒性和生理的研究[D].山东青岛:中国海洋大学,2012.

