颈动脉支架植入术围术期风险评估模型
余 纯(综述) 朱 珠 韩 翔(审校)
(复旦大学附属华山医院神经内科 上海 200032)
颈动脉粥样硬化狭窄及其相关的血栓形成、栓子脱落是卒中的主要原因之一。在西方国家约10%脑梗与严重颈动脉狭窄相关[1]。无症状、颈动脉狭窄>50%的患者卒中率仅为0.93%[2]。而对于6个月内有同侧的短暂性脑缺血发作、单眼黒曚或缺血性卒中等缺血事件的症状性颈动脉狭窄患者,5年内卒中再发风险超过20%[3]。
颈动脉支架植入术(carotid artery stenting,CAS)是治疗颈动脉粥样硬化狭窄的重要手段,较颈动脉内膜剥脱术(carotid artery endarterectomy,CEA)创伤性更小。2012年,Cochrane发表了颈动脉球囊血管成形术及颈动脉支架治疗颈动脉狭窄的Meta分析[4],共纳入16项研究,包含7 572名患者,CAS和CEA对于卒中的长期预防效果(同侧卒中再发)相当(OR=0.93,95% CI:0.60~1.45)。
围术期并发症是影响颈动脉狭窄患者长期预后的重要因素。从目前的临床试验结果看,CAS对于致残性卒中再发的长期预防效果与CEA类似,区别主要在围术期[5-8]:CAS围术期任意卒中尤其是非致残性卒中的发生率较高[4],而CEA则存在更高的围术期心梗风险及局部颅神经损伤的风险[9-11]。由此可知围术期并发症是影响颈动脉狭窄患者长期预后的重要因素。在进行颈动脉狭窄患者治疗决策时,围术期并发症风险应作为临床医师决策的重要参考因素。对于CAS围术期并发症风险高而CEA围术期并发症风险较低的患者,应推荐其行CEA,对于CAS围术期并发症风险较低的患者,CAS可减少心梗的发生率及局部创伤。
如何评估颈动脉手术的风险呢?围术期风险评估模型是一个重要的工具。CEA的风险评估已经写入英国第4版国家卒中临床指南[12],而CAS目前尚无广泛使用的手术风险评估模型,本文将目前国外已发表的CAS围术期风险评估模型进行综述。
文献报道的模型概述
CHAS评分 Hofmann等[13]在2006年提出的模型只有5个评测项目(表1),其中年龄及症状性颈动脉狭窄是目前比较公认的CAS围术期危险因素[14-15],控制不佳的糖尿病、对侧狭窄≥50%、溃疡型斑块也是较多文献报道的围术期并发症危险因子[16-18]。我们将该模型简称为“CHAS模型”即:对侧狭窄≥50%(C)、HbA1C>7%(H)、年龄≥80岁(A)、症状性颈动脉狭窄/斑块溃疡(S)。用于建立模型的样本来自单中心,样本量较少,模型预测能力只达到中等水平。但这些项目较为常见,可以覆盖临床上大部分患者,且评价较为简便,可以作为神经内科医师临床决策的辅助工具。
CAPTURE评分 Gray等[19]利用CAPTURE研究的结果,提出围术期风险的相关因素为年龄、临床症状、需预扩及多根支架治疗,但CAPTURE研究只使用Abbott颈动脉支架和栓子保护装置,纳入人群中症状性颈动脉狭窄的比例较低,缺少确定血管病变程度与性质的相关辅助检查,症状性患者比例过少,且该研究未提供模型的预测能力。
SIENA评分 Setacci等[18]在2010年提出了一个命名为“SIENA”的颈动脉支架围术期风险评估模型,模型的敏感性及特异性均较高,纳入人群中症状性颈动脉狭窄比例达43.8%,但该模型进行评估的项目多达14项(表1),包括患者相关因素(心脏疾病、神经系统症状、糖尿病),病灶相关因素(病灶钙化、病灶溃疡、再狭窄、病灶长度≥15 mm、颈内动脉开口处病灶),操作相关因素(Ⅲ型主动脉弓、牛型主动脉弓、主动脉弓钙化、需要预扩、手术时间≥30 min)和手术者因素(CAS手术经验<50例是危险因素,而CAS手术经验>100例则是保护因素),研究者还对这些因素进行了危险程度的加权(表2)。利用SIENA评分进行评估,要求评估者具有良好的影像学评估技巧,且涉及手术技巧及手术预估,更适宜外科医师进行术前评估,而对于内科医师,SIENA评分中的一些项目是难以进行评估,如是否需要预扩、手术时间估计、手术者经验等项目。
SAPPHIRE评分 SAPPHIRE研究是一个针对颈动脉内膜剥脱术高危患者进行CAS的研究,Wimmer等[20]通过对SAPPHIRE研究人群的分析,提出了一个CAS围术期风险评估模型,模型包含了10个项目(表1),由于纳入人群为颈动脉内膜剥脱术高危患者,且模型中包含许多临床上比较罕见的项目如透析治疗、需心脏手术、颈动脉畸形等,这个模型对于普通CAS患者是否具有良好的预测力仍有待验证。
NCDR CAS评分 Hawkins等[21]提出的模型是基于NCDR CARE队列的数据,NCDR CARE队列是美国国家心血管数据登记(National Cardiovascular Data Registry,NCDR)的一部分,纳入了因颈动脉狭窄而进行CEA或CAS的患者,其中大部分为无症状颈动脉狭窄,研究者分析了与围术期卒中或死亡相关的因素,提出了一个包含6个项目的评分模型,并根据其危险程度附以不同的分值,根据不同年龄段给予不同的评分(表1,表3)。模型达到了中等的预测力:对于评分≥6分的患者,围术期卒中/死亡率>3%;而评分≥10分的患者,围术期卒中或死亡率>6%。这个模型是基于一般手术患者登记数据,其研究样本可能更具有代表性,其结论推广至普通临床患者可能更准确,但这个模型对于中国人群是否具有同样的预测力需要进一步研究。
MACCE风险预测模型 MACCE风险预测模型[22]是一个基于中国人群的CAS围术期风险评估模型。这个模型的病例基于单中心队列,其中症状性颈动脉狭窄比例达65.76%,建模样本量为403例,未设置验证组。该模型的主要项目为:年龄≥70岁(5分),溃疡性斑块(3分),严重颈动脉狭窄(3.5分),双侧颈动脉支架植入(5分)及CAS后血流动力学抑制(6分)。由于模型未设置独立验证组,其有效性有待更多临床数据验证。
除了上述6个模型,尚有2个模型在此不作详述。一个是Fanous等[23]提出的BRASS模型(表1),其构建模型的样本量较小(仅为221人),围术期事件少(15例),分析因素多(7个),且未对影响CAS的重要因素——年龄进行分析。另一个是Touzé[24]提出的SCAR评分,该评分用于挑选CAS围术期并发症风险与CEA相当的人群。

表1 CAS风险评估模型汇总Tab 1 Summarization of CAS risk score
AUC:Area under curve;CAS:Carotid artery stenting;CEA:Carotid artery endarterectomy;Se:Sensitivity;Sp:Specificity;TIA:Transient ischemia attack;MI:Myocardial infarction;NIHSS:National Institute of Health stroke scale.
各个模型的实用性分析目前尚无临床数据对这6个模型进行分析比较。可以从样本代表性、模型构建方法、模型预测能力等方面对这些评分模型的临床效用进行分析。这6个模型分别称为CHAS[13]、SIENA[18]、CAPTURE[19]、SAPPHIRE[20]、NCRD CAS[21]及MACCE[22]。
模型样本的代表性 从模型取样与临床患者实际情况看,6个模型均包括了症状性及无症状颈动脉狭窄人群,其中基于单中心队列数据的有3个(CHAS、SIENA及MACCE),基于单种支架及保护装置的登记队列1个(CAPTURE),基于单支架临床试验1个(SAPPHIRE),基于国家级登记数据库1个(NCRD CAS),值得注意的是CAPTURE研究及SAPPHIRE研究均使用单一支架,且纳入人群均为含有CEA高危因素的患者。从人群代表性考虑,NCRD CAS模型的人群可能最能反映临床的实际情况,但这些样本都是基于西方人群。MACCE模型的数据来源于单中心,是6个模型中唯一一个来源于中国人群的模型,对于中国人群具有一定临床参考价值。
模型构建的方法 从数据收集看,CHAS、SIENA及MACCE均为单中心的数据库,其中CHAS及SIENA围术期事件的评估由独立的神经科医师完成,而MACCE通过电话随访。SAPPHIRE的事件由独立的评估委员会判断而CAPTURE研究也在30天进行神经科评估,NCDR CAS评分是基于既成的数据库,故存在某些评估项目的数据不完整,事件的确立也基于治疗医师的判断。从评价结局的客观性及可靠性而言,CHAS、SIENA及SAPPHIR更佳。从模型的构建看,CHAS、CAPTURE及MACCE未提供验证组。SAPPHIRE模型则通过 对样本进行多次随机抽样(bootstrapping算法)进行模型的验证。而SIENA评分及NCRD CAS评分首先设定建模人群与验证人群,其模型的可重复性可能更佳。

表2 SIENA CAS风险评估模型 [18]Tab 2 SIENA CAS risk score model [18]
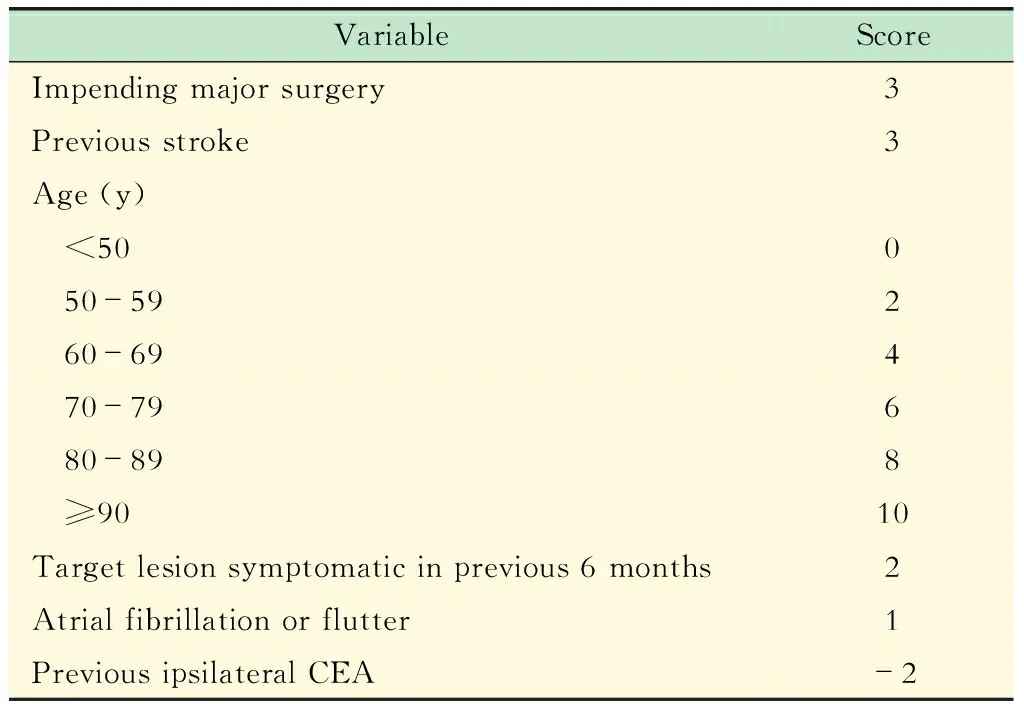
表3 NCDR CAS风险评估模型 [21]Tab 3 NCDR CAS risk score system [21]
The risk of peri-procedural stroke or death was>3% for score ≥6 and >6% for score≥10.
模型的预测能力 提供AUC的模型有4个,其中MACCE预测能力最佳(AUC为 0.875),但MACCE的ROC曲线绘制是来源于模型构建人群,其余预测能力均为中等(AUC均约为0.7),CAPTURE未提供模型的ROC曲线,SIENA评分给出了模型的敏感性和特异性。根据SIENA评分的危险度分级,我们可以计算模型的预测能力,根据SIENA评分对于高危组的界定(围术期风险>3%),敏感性为0.82,特异性为0.79,可计算出对于SIENA评分为高危组的患者,其阳性预测值仅有10.8%,而对于评分为中低危(≤3%)的患者,其阴性预测值可高达99.2%。这是因为各个模型的危险度分层标准是基于目前指南的推荐,即对于症状性颈动脉狭窄≥50%的患者,围术期并发症要求控制在6%以下,而无症状颈动脉狭窄≥70%的患者,围术期并发症风险要求控制在3%以下,故这些模型多以3%或6%作为高危标准。在这一低概率的条件下,这些模型具有较低的阳性预测值和较高的阴性预测值。
临床运用在临床使用CAS评分过程中,评分低的患者进行CAS的安全性较高(阴性预测值高),而对于评分高者,其实际手术并发症风险不一定很高(阳性预测值低)。在这种情况下,我们对于具有手术指征而CAS围术期风险评分为低危的患者,可以推荐CAS治疗,而对于CAS围术期风险评分为高危的患者,则应进一步进行临床的分析,比如进行CEA的风险评估,若CEA风险较低,则首选CEA,若2种手术风险均为高危,则需结合单纯药物治疗的风险评估,才能制定最优的治疗方案。同时,可以针对CAS评分为高危的患者进行危险因素分析,制定针对这群患者的危险评分模型,对这部分人群进行二次评估,从而增加临床评分的阳性预测值。
综上所述,在CAS之前根据患者的临床及病灶因素可以对患者的手术风险进行评估,从而为治疗决策提供参考。本文就国内外发表的CAS围术期风险评估模型进行汇总,并对其有效性及局限性进行分析,以供临床医师参考,从而在术前对患者的手术风险进行预估,更好地制定治疗策略。
参 考 文 献
[1] TOUZÉ E.Natural history of asymptomatic carotid artery stenosis[J].RevNeurol(Paris),2008,164(10):793-800.
[2] DIVYA KP,SANDEEP N,SARMA S,etal.Risk of stroke and cardiac events in medically treated asymptomatic carotid stenosis[J].JStrokeCerebrovascDis,2015,24(9):2149-2153.
[3] BARNETT H,TAYLOR DW,ELIASZIW M.Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis[J].NEnglJMed,1998,339(20):1415-1425.
[4] BONATI LH,LYRER P,EDERLE J,etal.Percutaneous transluminal balloon angioplasty and stenting for carotid artery stenosis[J].CochraneDatabaseSystRev,2012,9(9):CD000515.
[5] BONATI LH,DOBSON J,FEATHERSTONE RL,etal.Long-term outcomes after stenting versus endarterectomy for treatment of symptomatic carotid stenosis:the International Carotid Stenting Study (ICSS) ran-domisedtrial[J].Lancet,2015,385(9967):529-538.
[6] ECKSTEIN HH,RINGLEB P,ALLENBERG JR,etal.Results of the Stent-Protected Angioplasty versus Carotid Endarterectomy (SPACE) study to treat symptomatic stenoses at 2 years:a multinational,prospective,randomised trial [J].Lancet,2008,7(10):893-902.
[7] BROTT TG,HOBSON RW,HOWARD G,etal.Stenting versus endarterectomy for treatment of carotid-artery stenosis[J].NEnglJMed,2010,363(1):11-23.
[8] MAS JL,TRINQUART L,LEYS D,etal.Endarterectomy versus angioplasty in patients with symptomatic severe carotid stenosis (EVA-3S) trial:results up to 4 years from a randomised,multicentretrial[J].LancetNeurol,2008,7(10):885-892.
[9] SPACE COLLABORATIVE GROUP,RINGLEB PA,ALLENBERG J,etal.30 day results from the SPACE trial of stent-protected angioplasty versus carotid endarterectomy in symptomatic patients:a randomised non-inferiority trial[J].Lancet,2006,368(9543):1239-1247.
[10] MAS JL,CHATELLIER G,BEYSSEN B,etal.Endarterectomy versus stenting in patients with symptomatic severe carotid stenosis[J].NEnglJMed,2006,355(16):1660-1671.
[11] INTERNATIONAL CAROTID STENTING STUDY INVESTIGATORS,EDERLE J,DOBSON J,etal.Carotid artery stenting compared with endarterectomy in patients with symptomatic carotid stenosis (International Carotid Stenting Study):an interim analysis of arandomised controlled trial[J].Lancet,2010,375(9719):985-997.
[12] INTERCOLLEGIATE STROKE WORKING PARTY.National clinical guideline for stroke[M].London:RoyalCollegeofPhysicians,4thEd,2012.
[13] HOFMANN R,NIESSNER A,KYPTA A,etal.Risk score for peri-interventional complications of carotid artery stenting[J].Stroke,2006,37(10):2557-2561.
[14] JIAO LQ,SONG G,LI SM,etal.Thirty-day outcome of carotid artery stenting in Chinese patients:a single-center experience[J].ChinMedJ,2013,126(20):3915-3920.
[15] KERNAN WN,OVBIAGELE B,BLACK HR,etal.Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J].Stroke,2014,45(7):2160-2236.
[16] SCHLÜTER M,REIMERS B,CASTRIOTA F,etal.Impact of diabetes,patient age,and gender on the 30-day incidence of stroke and death in patients undergoing carotid artery stenting with embolus protection:a post-hoc subanalysis of a prospective multicenter registry[J].JEndovascTher,2007,14(3):271-278.
[17] VESELKA J,ZIMOLOVP,EK M,etal.Comparison of carotid artery stenting in patients with single versus bilateral carotid artery disease and factors affecting midterm outcome[J].AnnVascSurg,2011,25(6):796-804.
[18] SETACCI C,CHISCI E,SETACCI F,etal.Siena carotid artery stenting score:a risk modelling study for individual patients[J].Stroke,2010,41(6):1259-1265.
[19] GRAY WA,YADAV JS,VERTA P,etal.The CAPTURE registry:predictors of outcomes in carotid artery stenting with embolic protection for high surgical risk patients in the early post-approval setting[J].CathetCardiovascIntervent,2007,70(7):1025-1033.
[20] WIMMER NJ,YEH RW,CUTLIP DE,etal.Risk prediction for adverse events after carotid artery stenting in higher surgical risk patients[J].Stroke,2012,43(12):3218-3224.
[21] HAWKINS BM,KENNEDY KF,GIRI J,etal.Pre-procedural risk quantification for carotid stenting using the CAS score[J].JAC,2012,60(17):1617-1622.
[22] LIU J,XU ZQ,CUI M,etal.Assessing risk factors for major adverse cardiovascular and cerebrovascular events during the perioperative period of carotid angioplasty with stenting patients[J].ExpTherMed2016,12(2):1039-1047.
[23] FANOUS AA,NATARAJAN SK,JOWDY PK,etal.High-risk factors in symptomatic patients undergoing carotid artery stenting with distal protection:Buffalo Risk Assessment Scale (BRASS)[J].Neurosurgery,2015,77(4):531-42-discussion 542-3.
[24] TOUZÉ E,TRINQUART L,FELGUEIRAS R,etal.A clinical rule (sex,contralateral occlusion,age,and restenosis) to select patients for stenting versus carotid endarterectomy systematic review of observational studies with validation in randomized trials[J].Stroke,2013,44(12):3394-3400.

