青霉菌株F36对不同来源风化煤的降解特性
闫 敏, 李 磊, 张 强, 冯悦晨, 孙 捷, 武文丽
(1.山西省农业科学院农业环境与资源研究所,山西太原 030031; 2.山西省土壤环境与养分资源重点实验室,山西太原 030031)
风化煤是煤层的露头部分长期氧化、风化、水解形成的一种低级别煤[1],其共生的矿物质较多,富集着较多的微量元素,且含有大量再生腐殖酸(HA)和多种含氧活性官能团[2],是腐殖酸的重要来源之一。腐殖酸不仅用于工业、医药和环保等领域[3-4],而且广泛用于农业[5-7]。随着腐殖酸应用的深入研究,风化煤中的腐殖酸具有广阔的开发利用前景。我国风化煤贮藏量丰富,集中分布于山西、新疆、内蒙古、黑龙江、云南等地区[8],但其理化性质却存在明显差异,这直接影响风化煤的降解效果。随着微生物转化技术处理煤炭成为了国内外研究的热点,大量的研究表明,利用微生物可显著提高风化煤的降解效果,但受到风化煤样品、微生物菌株及其发酵工艺等的影响,同一微生物菌株因不同风化煤样而存在明显的转化差异, 不同微生物菌株对同一风化煤样也存在明显的
转化差异,即微生物菌株对不同的风化煤样存在不同的降解特性,同时发酵工艺的优化可以提高降解率,这就使得微生物菌种与风化煤之间匹配及降解特性的研究显得十分重要。本研究以3个不同来源的风化煤样为研究材料,其总腐殖酸、游离腐殖酸和黄腐酸的含量存在明显差异,筛选出具有降解作用的微生物菌株F36,并在液体培养条件下,从各腐殖酸含量及结构的变化上分析菌株对其的降解特性,为优化其发酵工艺、提高风化煤的降解效率及进一步应用提供理论依据。
1 材料与方法
1.1 供试材料
供试菌株F36以风化煤为唯一碳源,分离自菜园土壤,保存于笔者所在实验室。供试3种风化煤的理化性质见表1。

表1 3种风化煤的理化性质
以上检测由中国腐殖酸工业协会腐殖酸质量检测中心(太原)完成。
供试培养基有固体定性培养基和液体培养基2种,其中固体定性培养基[9]:Na2HPO44.0 g,KH2PO41.0 g,NaCl 0.2 g,MgSO4·7H2O 0.2 g,CaCl2·2H2O 0.05 g,酵母浸出粉6.0 g,去离子水1 000 mL,琼脂15~20 g;液体培养基[9]:(NH4)2SO42.6 g,K2HPO41.0 g,KH2PO40.5 g,MgSO4·7H2O 0.2 g,CaCl2·2H2O 0.01 g,去离子水1 000 mL,风化煤10.0 g,pH值6.0。
1.2 风化煤在固体平板上的定性降解测定
将纯化的菌种F36接种到固体定性培养基上,28 ℃下培养;待菌丝基本长满平板表面后,将灭菌的3个风化煤样均匀洒在菌苔上,继续培养,每天观察并记录风化煤颗粒的变化情况。
1.3 风化煤降解菌株的鉴定
形态学鉴定:将菌株F36采用PDA平板、显微镜(乳酸石炭酸棉兰染色)对菌落、菌丝、孢子等结构进行观察,并参照文献[10-11]进行鉴定。
分子生物学鉴定:将纯化的菌株F36活化培养后,委托生工生物工程(上海)股份有限公司进行测序。将18S rDNA测序结果提交到NCBI数据库并进行BLAST比对。
1.4 风化煤液体降解特性的研究
将菌株F36活化后,接种到液体培养基中,每50 mL培养基接种量为1/4个平板,28 ℃下培养7 d后离心(12 000 r/min)15 min,上清液稀释12.5倍后测定190~280 nm(间距5 nm)的吸光度;测定上清液中黄腐酸、水溶性腐殖酸的含量[11]。同时,将上清液先用6 mol/L H2SO4调节pH值至1,形成絮状沉淀,然后离心(12 000 r/min)15 min,沉降物在75 ℃下烘干,即得固体水溶性组分并进行FT-IR分析[9-10]。液体培养沉降物在75 ℃下烘至恒质量,计算损失的质量,失质量率为培养基中加入的风化煤质量与沉降物质量(包括菌体和未分解的风化煤)之间的差值与原加入风化煤的质量之比,用百分数表示,同时做不接种的空白对照(CK),重复3次。
1.5 数据分析
试验数据采用Minitab 14软件进行统计分析,采用Tukey’s进行多重比较。文中图采用Excel绘制,图中数据表示为3个重复的“平均值±标准差”。
2 结果与分析
2.1 菌株F36对3个风化煤样在固体定性培养基上的降解作用
菌株F36在固体定型培养基上生长,待菌丝基本长满平板后加入3个风化煤样继续培养3 d,培养基被染成了棕黄色,说明菌株对3个风化煤样均出现了不同程度的溶媒现象(图1)。

2.2 菌种鉴定
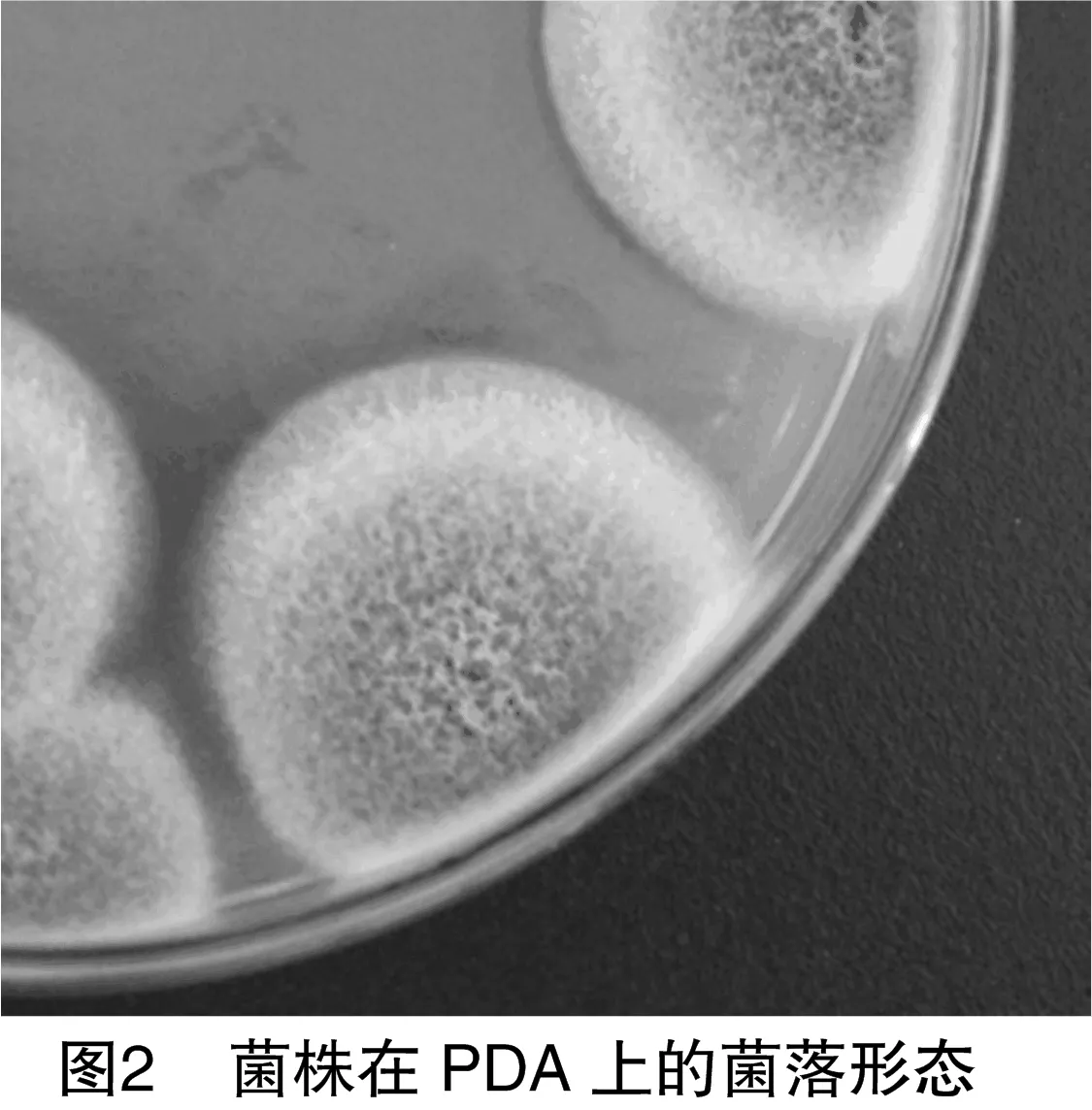
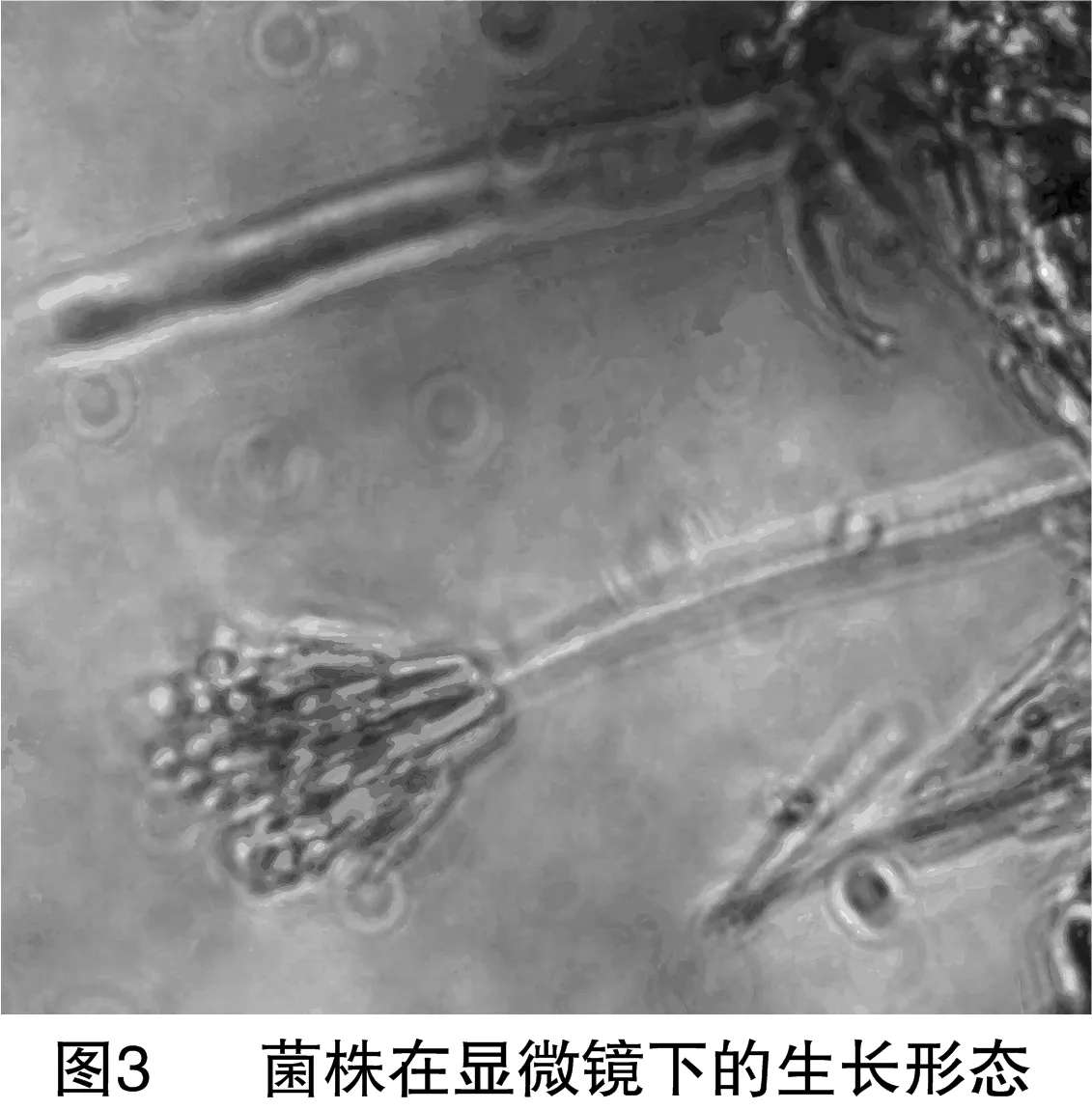
2.2.1 形态学鉴定 菌株F36菌落在PDA的呈现橙色的色素,分生孢子梗顶端不形成膨大的顶囊,经过多次分支,产生几轮对称或不对称的小梗,形如扫帚,称为帚状体,分生孢子为球形、椭圆形或短柱形(图2、图3),初步判定为青霉属。
2.2.2 分子生物学鉴定 将测得的18S rDNA基因序列(图4)在NCBI上进行同源性检索,结果表明,所测序列与青霉属(Penicilliumsp.)同源性为99%。综合形态特征和18S rDNA基因序列同源性两方面分析,该菌株鉴定为青霉属(Penicilliumsp.)。
2.3 风化煤液体降解特性的研究
2.3.1 液体培养下降解物紫外分析 从图5可以看出,在液体培养条件下,菌株F36对3个风化煤样培养的上清液的吸光度曲线即菌株对3个风化煤样的降解特性是相似的。接种微生物处理的吸光度曲线与不接种的处理相似, 但吸光度显著增强,并且波长越短,增加的幅度越高,其中菌株F36对YF06号风化煤的降解作用较强。这说明培养过程中风化煤中有大量的物质,极有可能是腐殖酸类物质转化为水溶性状态,所溶解出来的物质组成也受到接种的影响,吸收低波长紫外光的物质显著增加。


2.3.2 液体培养下降解物红外分析 液体培养后风化煤YF01降解物的红外光谱分析结果(图6)表明,接种菌种F36与对照相比,谱图的形状基本相似,在1 620 cm-1处的峰形减弱,1 540 cm-1处的有一小峰,1 400 cm-1(脂族C—H变形振动)处的峰形明显减弱且呈现4个肩峰,1 240 cm-1峰形有明显的减弱,1 120、910、600~760 cm-1处发生了不同程度的位移,而在 850 cm-1处有加强峰。说明可能是碳链缩短、羧基官能团和芳香共轭双键含量存在差异,结构较复杂且另含有其他官能团,降解作用较强,对于失质量的效果应较为突出。



图8显示了液体培养后,风化煤YF09降解物的红外光谱分析结果。接种菌株F36与对照相比,谱图的形状变得复杂且有明显的加强作用。1 400、1 240~1 010、912、858~468 cm-1没有明显的特异峰,但各峰均有明显的加强,特别是在1 400、1 240~1 010 cm-1处加强,表明其降解产物中有趋于棕腐酸类物质,有利于更好地利用,并且降解作用应在失质量和水溶性腐殖酸类物质的含量上具有较好的效果。

2.3.3 液体培养下风化煤的降解特性 从风化煤液体培养后的失质量率(图9)变化看出,接种F36后各风化煤的失质量率明显高于对照。对照风化煤YF01、YF06、YF09的失质量率分别是4.7%、4.3%、10.9%;接种菌株F36后的失质量率约为23.7%、20.5%、31.9%,且接种F36后,对风化煤YF01的降解效果最好。

从风化煤液体培养后的上清液中水溶性腐殖酸含量的变化看出,接种F36后各风化煤培养液中水溶性腐殖酸的含量相较于对照均明显提高。YF01、YF06、YF09对照风化煤的培养液中水溶性腐殖酸含量分别是1.26%、0.29%、1.55%;接种菌株F36后的培养液中水溶性腐殖酸含量约为3.69%、1.74%、3.15%。其中,接种F36的培养液对风化煤YF06的降解效果增强幅度最大,而风化煤YF01的培养液中水溶性腐殖酸的含量最高(图10)。
从风化煤液体培养后的上清液中黄腐酸含量的变化可以看出,接种F36后各风化煤培养液中黄腐酸含量相较于对照均明显提高。YF01、YF06、YF09对照风化煤的培养液中黄腐酸的含量分别是0.54%、0.31%、0.59%;接种菌株F36后的培养液中黄腐酸的含量约为1.30%、0.76%、1.44%。其中,接种F36的培养液对3个风化煤样的降解效果差异不大,而风化煤YF09的培养液中黄腐酸的含量最高(图11)。


3 讨论与结论
我国风化煤储量巨大,约为1 000亿t,且煤种丰富[8]。风化煤作为腐殖酸的重要来源之一,其总腐殖酸含量10%~60%,且不同风化煤样间存在明显的差异。笔者根据总腐殖酸、游离腐殖酸和黄腐酸的含量以及pH值的差异,选取YF01、YF06和YF09号风化煤作为研究材料,其中风化煤YF01和YF09的总腐殖酸和游离腐殖酸含量基本接近,但风化煤YF01中腐殖酸类物质含量都较高,而风化煤YF09中腐殖酸类物质含量都较低;风化煤YF06的总腐殖酸含量较高,但游离腐殖酸含量较低。以期从3个差异较大风化煤样入手,解析它们对菌株F36降解作用的响应,为青霉菌株F36的降解机理的进一步研究和生产提供依据。
随着利用微生物转化煤类物质研究的广泛开展,越来越多的微生物菌种进入了研究的范围,主要包括白腐菌、曲霉、木霉、青霉、链霉菌、假单胞菌及芽孢杆菌等属的微生物。本研究中的降解微生物是青霉,对3个风化煤样均具有不同程度的降解作用。这些微生物以煤中腐殖酸类物质作为碳源和能源,使其发生降解,并且对煤类物质中的缩合芳香结构有较明显的选择性降解作用[12],所以也使得降解效果存在明显的差异,不同微生物与不同煤样的作用有一定的匹配关系。韩威等对8种微生物对23个煤样的研究表明,菌种对煤样的生物溶媒效果差异较大[13];张昕等研究了4种真菌降解山西临汾和内蒙古风化煤后的失质量率,其平均差异在10%左右[9];冯晓霄等研究的微生物菌株对新疆低阶煤的转化率为50%左右[14];王春颖等通过优化工艺参数使风化煤的降解率达到29.28%[15]。本研究中菌株F36对失质量率的差异在10%以上,液体培养后腐殖酸类物质也存在差异。红外光谱分析表明,菌株F36对3个风化煤样的作用集中在羧基官能团上,表现为水溶性腐殖酸含量的增加,而且在羧基振动上变化较多,结构复杂,可能存在多种腐殖酸类物质,有利于降解产物的利用;而且对风化煤YF01和YF06的作用集中在碳链的缩短上,表现为失质量率较高;这一结果和液体培养后3个风化煤样在失质量率和水溶性腐殖酸含量的变化结果相一致。因此,可以从菌株F36对3个风化煤的降解特性差异的角度进一步对其降解机理和降解效果进行研究。
参考文献:
[1]李善祥. 我国煤炭腐殖酸资源及其利用[J]. 腐植酸,2002(3):7-13.
[2]武瑞平,李 华,曹 鹏. 风化煤施用对复垦土壤理化性质酶活性及植被恢复的影响研究[J]. 农业环境科学学报,2009,28(9):1855-1861.
[3]Scott C D,Scott T C,Woodward C A. the chemical modification of enzymes to enhance solubilization in organic-solvents for interaction with coal[J]. Fuel,1993,72(12):1695-1700.
[4]张学才,张德祥. 我国的腐殖酸资源及其工农业应用[J]. 中国煤炭,2000,26(12):13-15,18.
[5]宋 轩,曾德慧,林鹤鸣,等. 草炭和风化煤对水稻根系活力和养分吸收的影响[J]. 应用生态学报,2001,12(6):867-870.
[6]任志胜,齐瑞鹏,王彤彤,等. 风化煤对晋陕蒙矿区排土场新构土体土壤呼吸的影响[J]. 农业工程学报,2015,31(23):230-237.
[7]何 杰,张 强,冯悦晨,等. 风化煤对苏打盐化土的改良效果研究[J]. 中国农学通报,2015,31(24):199-203.
[8]马秀欣,赵宏波. 我国泥炭、褐煤和风化煤的资源优势及其应用领域[J]. 中国煤炭,2004,30(9):47-49,56.
[9]张 昕,林启美,赵小蓉. 风化煤的微生物转化:Ⅰ菌种筛选及转化能力测定[J]. 腐植酸,2002(3):18-23.
[10]魏景超遗. 真菌鉴定手册[M]. 上海:上海科学技术出版社,1979.
[11]齐祖同. 中国真菌志(第35卷)[M]. 北京:科学出版社,1997.
[12]陈文求,王仁宗,陈敏杰,等. 腐殖酸的降解研究及进展[J]. 化工进展,2013,32(增刊1):207-212.
[13]韩 威,佟 威,杨海波,等. 煤的微生物溶(降)解及其产物研究[J]. 大连理工大学学报,1994,34(6):653-660.
[14]冯晓霄,杨红梅,张 涛,等. 新疆低阶煤微生物转化菌种的选育及转化能力测定[J]. 新疆农业科学,2014,51(3):511-516.
[15]王春颖,田瑞华,段开红,等. 一株放线菌降解风化煤的工艺研究[J]. 内蒙古农业大学学报(自然科学版),2011,32(2):166-169.

