白茅根总黄酮提取工艺及其抗氧化性研究
翁 梁, 李西腾
(江苏食品药品职业技术学院食品学院,江苏淮安 223003)
白茅根为禾本科植物白茅[ImperatecylindriaBeauv. var.major(Nees) C. E. Hubb.]的根茎,又称白花茅根、茅草根、甜草根等[1],是我国传统的中药材。白茅根性甘、味寒,有凉血止血、清热利尿之功效,临床可用于治疗热病烦渴、血淋、水肿、黄疸等症[2-3]。近几年的研究显示,白茅根的主要化学成分有三萜类化合物、有机酸、多糖、黄酮类物质等[4]。药理研究的结果表明,白茅根具有调节免疫力、抗肿瘤、抗氧化、抗菌、抗炎、降血糖、降血脂等作用[5]。
目前,国内对白茅根活性成分提取工艺的研究多集中在多糖的提取,并做了大量系统的研究[6]。还有科技工作者对白茅根的绿原酸、总酚酸和总三萜物质的提取进行了研究[7-8],但有关白茅根中总黄酮的提取工艺及其抗氧化活性的研究尚未见报道。因此,本试验采用乙醇溶液作为浸提剂,用水浴浸提法提取白茅根中的总黄酮,并对白茅根总黄酮体外抗氧化活性进行初步研究。
1 材料与方法
1.1 材料与仪器
白茅根,购自安徽省亳州市志民药业有限公司。芦丁,购自上海恒远生化试剂有限公司。无水乙醇、氢氧化钠、亚硝酸钠、硝酸铝、铁氰化钾、三氯乙酸、氯化铁、1,1-二苯基-2-苦基肼(DPPH)、维生素C等均为分析纯,2,6-二叔丁基-4-甲基苯酚(BHT)为食品级,均购自江苏省淮安国药化学试剂有限公司。
粉碎机,购自上海隆拓仪器设备有限公司;UV765-可见分光光度计,购自上海精密科学仪器有限公司;电子精密天平,购自奥豪斯仪器(上海)有限公司;恒温水浴锅,购自上海乔跃电子有限公司;电热恒温鼓风干燥箱,购自上海精宏实验设备有限公司。
1.2 试验方法
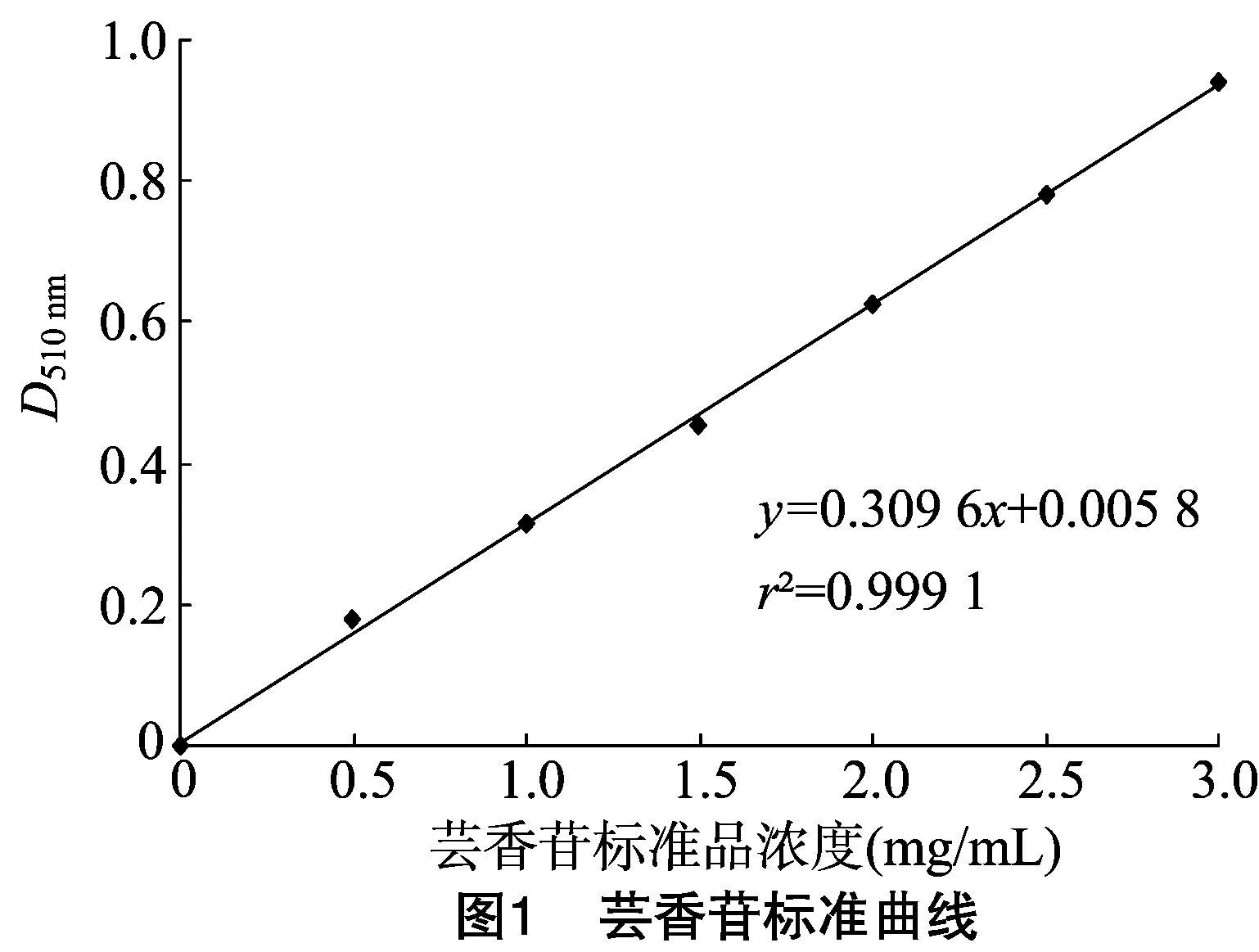
1.2.1 标准曲线的绘制 参照文献[9]绘制标准曲线。准确称取5 g芦丁标准品置于20 mL容量瓶中,用60%乙醇溶液溶解并定容,分别吸取0、0.02、0.04、0.06、0.08、0.10、0.12 mL 置于10 mL比色管中,加入0.3 mL 5%亚硝酸钠溶液,放置6 min,再加入0.3 mL 10%硝酸铝钠溶液,放置 6 min 后加入4.0 mL 5%氢氧化钠溶液,加水至刻度线,摇匀,放置15 min,在510 nm处测吸光度,以芦丁浓度(C)为横坐标、吸光度(D)为纵坐标绘制标准曲线。得回归方程D=0.309 6C+0.005 8,r2=0.999 1,表明在0~0.12 mg/mL范围内,芸香苷浓度与吸光度具有线性关系。标准曲线如图1所示。
1.2.2 白茅根总黄酮提取方法 将白茅根于60 ℃烘干,粉碎过60目筛。准确称取1.0 g粉末样品,加入乙醇溶液,置于水浴锅中提取,提取3次,合并提取液。按标准曲线绘制方法显色后,在510 nm波长处测量样品溶液的吸光度。
白茅根总黄酮含量的计算公式:总黄酮含量=C×N×V/M。其中,C为样品的吸光度代入回归方程计算得到的总黄酮浓度,mg/mL;N为样品稀释倍数;V为加入乙醇提取液的体积,mL;M为粉末样品质量,g。
1.2.3 单因素试验设计 试验采用水浴法,用乙醇溶液作为浸提剂,按料液比1 g ∶30 mL、乙醇浓度70%、提取温度 60 ℃、提取时间60 min的基本提取工艺,以总黄酮提取量为指标,确定其他条件不变,改变单因素的值,分别考察料液比[1 ∶10、1 ∶20、1 ∶30、1 ∶40、1 ∶50(g ∶mL)]、乙醇浓度(40%、50%、60%、70%、80%)、提取温度(40、50、60、70、80 ℃)、提取时间(30、60、90、120、150 min)对白茅根总黄酮提取量的影响。
1.2.4 正交试验设计 根据单因素试验结果,选取料液比、乙醇浓度、提取温度、提取时间等4个因素,采用L9(34)正交表进行试验,通过对白茅根总黄酮提取量和正交试验结果进行分析,确定最佳提取工艺。
1.2.5 抗氧化活性研究
1.2.5.1 DPPH自由基清除率的测定 将白茅根总黄酮提取液、BHT、维生素C配制成不同浓度的待测样品液,再与0.01 mmol/L DPPH溶液混匀,室温下反应30 min,然后在 517 nm 波长处测定其吸光度[9]。
DPPH自由基清除率计算公式:清除率=(1-D/D0)×100%。式中,D为样品溶液的吸光度,D0为用无水乙醇代替样品溶液作为空白对照的吸光度。
1.2.5.2 白茅根总黄酮还原能力测定 采用普鲁士兰法[10]测定白茅根总黄酮的还原力,以普鲁士兰的生成量为指标,在700 nm波长处测定其吸光度。试验用相同浓度的BHT、维生素C作为对照品,吸光度越大表示还原能力越强。
2 结果与分析
2.1 单因素试验结果
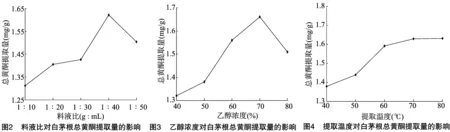
2.1.1 料液比对白茅根总黄酮提取量的影响 按乙醇浓度70%、提取温度60 ℃、提取时间60 min,考察当料液比分别为1 ∶10、1 ∶20、1 ∶30、1 ∶40、1 ∶50(g ∶mL)时对白茅根总黄酮提取量的影响。由图2可知,随着料液比的变化,白茅根总黄酮提取量先升后降。当料液比为1 g ∶40 mL时,总黄酮提取量最高,达到1.622 mg/g。随后当料液比为1 g ∶50 mL时,总黄酮提取量下降。
2.1.2 乙醇浓度对白茅根总黄酮提取量的影响 按料液比1 g ∶30 mL、提取温度60 ℃、提取时间60 min,考察当乙醇浓度分别为40%、50%、60%、70%、80%时对白茅根总黄酮提取量的影响。由图3可知,随着乙醇浓度逐渐增大,白茅根总黄酮的提取量也逐渐增加,当乙醇浓度为70%时提取量达到最大值,当乙醇浓度达到80%时,总黄酮的提取量明显下降。
2.1.3 提取温度对白茅根总黄酮提取量的影响 按料液比1 g ∶30 mL、乙醇浓度70%、提取时间60 min,考察当提取温度分别为40、50、60、70、80 ℃时对白茅根总黄酮提取量的影响。由图4可知,随着提取温度的升高,总黄酮提取量逐渐增加。当提取温度达到60 ℃及以上时,总黄酮提取量增加的较少且趋于平稳。
2.1.4 提取时间对白茅根总黄酮提取量的影响 按料液比1 g ∶30 mL、乙醇浓度70%、提取温度60 ℃,考察当提取时间分别为30、60、90、120、150 min时对白茅根总黄酮提取量的影响。由图5可知,提取时间在30~90 min内,白茅根总黄酮提取量增加的较为明显。当提取时间达到90 min及以后时,总黄酮提取量趋于稳定,增加量较小。
2.2 正交试验结果
由表1可知,正交试验的极差(R)表现为A>D>C>B,说明对白茅根总黄酮提取量的影响表现为料液比>提取时间>提取温度>乙醇浓度。白茅根总黄酮最佳提取工艺组合为A2B3C3D3,即料液比为1 g ∶40 mL、乙醇浓度为80%、提取温度为80 ℃、提取时间为150 min。根据表2方差分析的结果可知,料液比、提取时间、提取温度对总黄酮提取量具有显著影响(P<0.05)。
2.3 抗氧化试验结果
2.3.1 DPPH自由基清除率测定结果 由图6可知,白茅根总黄酮对DPPH自由基有明显的清除作用。在试验的浓度范围内,白茅根总黄酮对DPPH自由基清除作用随着浓度的升高逐步增强,当浓度为1.50 mg/mL时,清除率达到45.17%。但白茅根总黄酮对DPPH自由基的清除率明显低于相同浓度的维生素C,略好于相同浓度的BHT,说明白茅根总黄酮具有较好的抗氧化作用。
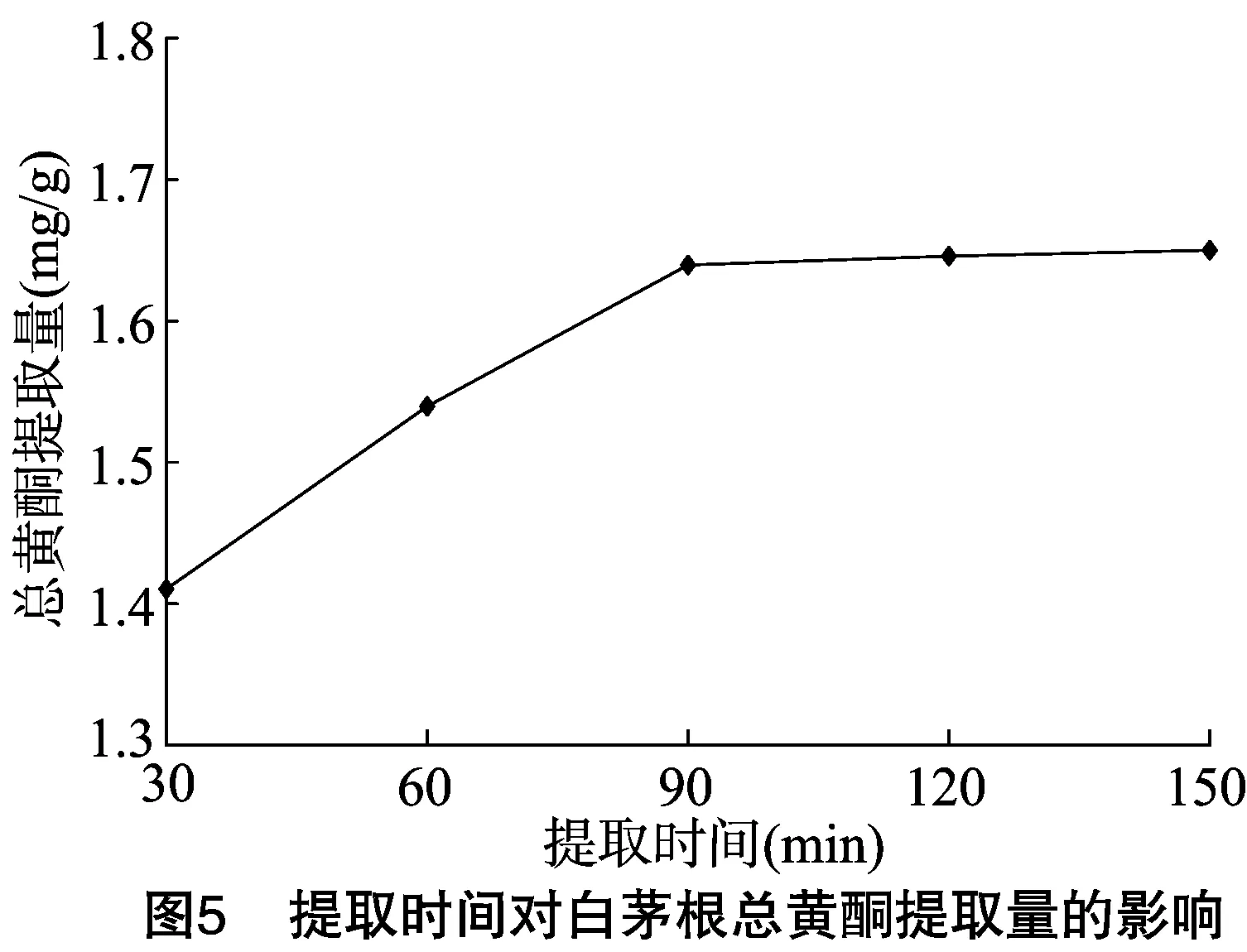
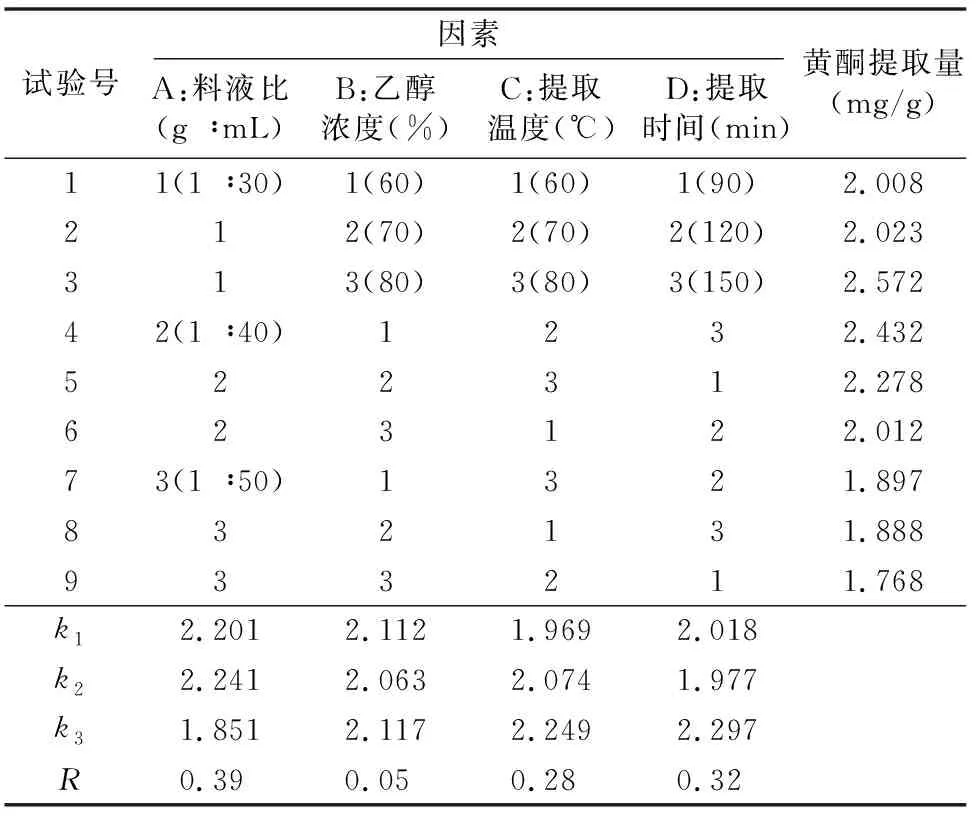
表1 正交试验结果

表2 方差分析结果
注:“*”表示在0.05水平上影响显著。

2.3.2 白茅根总黄酮还原能力测定结果 吸光度的变化反映样品还原能力的强弱,吸光度越大,样品的还原能力越强,还原能力越强,抗氧化性越强。由图7可知,在试验的浓度范围内,白茅根总黄酮的还原能力随着浓度的升高逐步增强,且还原力与浓度有线性关系。与相同浓度的维生素C相比,白茅根总黄酮的还原力明显较差,但好于相同质量浓度的BHT,说明白茅根总黄酮具有较好的抗氧化性。

3 结论与讨论
试验以乙醇溶液作为浸提剂,用水浴浸提法提取白茅根总黄酮,采用分光光度法测定总黄酮含量。结果表明,最佳提取工艺条件为料液比1 g ∶40 mL、乙醇浓度80%、提取温度80 ℃、提取时间150 min。该提取工艺稳定可靠,如若结合其他提取技术,能否进一步提高总黄酮的提取量,还须再做深入研究。
试验测定白茅根总黄酮提取物清除DPPH自由基的能力及还原能力,并以相同浓度的BHT、维生素C作对照。结果表明,白茅根总黄酮清除DPPH自由基的能力及还原能力明显小于相同浓度的维生素C,略高于相同浓度的BHT。说明白茅根总黄酮具有一定的抗氧化作用,但其抗氧化的具体成分还须做进一步研究。
参考文献:
[1]国家药典委员会.中华人民共和国药典:一部[M]. 北京:中国医药科技出版社,2010:82.
[2]王 伟,郭庆梅,周凤琴. 白茅根的药效考证与现代研究比较[J]. 中国海洋药物,2014,33(4):92-96.
[3]付丽娜,陈兰英,刘荣华,等. 白茅根的化学成分及其抗补体活性[J]. 中药材,2010,33(12):1871-1874.
[4]刘 轩,张彬锋,侴桂新,等. 白茅根的化学成分研究[J]. 中国中药杂志,2012,37(15):2296-2300.
[5]刘荣华,付丽娜,陈兰英,等. 白茅根化学成分与药理研究进展[J]. 江西中医学院学报,2010,22(4):80-83.
[6]王 莹,孟宪生,包永睿,等. 白茅根多糖提取工艺优化及含量测定[J]. 亚太传统医药,2009,5(11):24-26.
[7]熊科元,刘荣华,陈石生,等. 不同产地白茅根总酚酸的含量比较[J]. 时珍国医国药,2012,23(4):844-845.
[8]李 容,卢小雪,张德威,等. 综合评分优选白茅根总酚酸和总三萜提取工艺[J]. 食品研究与开发,2013,34(24):77-80.
[9]陈燕芹,刘 红,蔡 丽. 蕨菜总黄酮的提取及抗氧化性[J]. 江苏农业科学,2014,42(12):299-301.
[10]刘品华,刘明研,杨 涛,等. 干巴菌抗氧化性的研究[J]. 西南农业学报,2016,29(10):2330-2334.

