核桃楸皮提(萃)取物的抑菌性能研究
陈苛蒙,金黎明,包艳春,王晓彤,孙 怡,胡文忠(大连民族大学 生命科学学院 生物技术与资源利用教育部重点实验室,辽宁 大连 116605)
核桃楸(JuglansmandshuricaMaxim)为胡桃科胡桃属落叶乔木,根、皮、叶和种子都有一定的药用价值,其中对核桃楸皮(bark ofJuglansmandshuricaMaxim)的研究和应用最多。核桃楸皮是核桃楸的树皮,几乎无气味,味道略微苦涩,有清热解毒、止痢、明目的功能,可用于治疗细菌性痢疾、骨结核、麦粒肿等疾病[1-2],民间偏方也有用其水煎剂治疗乳腺炎、肝炎、肿瘤等[3-4]。已知核桃楸皮中含有较多的活性物质,主要有胡桃醌、黄酮类、生物碱、二芳基庚酸类化合物、甙类化合物、鞣质类化合物、萘醌及其衍生物等[5-7],在这些活性物质中,人们只对胡桃醌的研究较多,且一般集中在抗氧化、消炎、镇痛、抗肿瘤等方面[8-10],而对核桃楸皮抑菌性能的研究较少。
本实验研究了核桃楸皮提取物对金黄色葡萄球菌、大肠埃希氏菌、沙门氏菌、弧菌、白色念珠菌5种致病菌的抑菌性能,对核桃楸皮活性成分的功能研究进一步补充了数据,也为开发抗菌药物奠定了一定的基础。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料与试剂
核桃楸皮,辽宁丹东药业有限公司提供。清洗核桃楸皮并剪碎,于阴凉干燥处自然风干,置于橱柜中避光保存待用。
乙醇、石油醚、乙酸乙酯、氯仿、甲醇等,国产优级纯试剂。
1.1.2 指示菌与培养基
指示菌:弧菌、金黄色葡萄球菌、大肠杆菌、沙门氏菌和白色念珠菌,实验室保藏菌。
LB培养基:胰蛋白胨10 g·L-1,酵母提取物5 g,氯化钠5 g,琼脂20 g,去离子水1 000 mL,pH约为7.0。
1.1.3 仪器与设备
BSA224S电子分析天平(赛多利斯科学仪器有限公司);SW-CJ-2FD洁净工作台(苏州安泰空气技术有限公司);DHG-9070A电热恒温干燥箱(上海精宏实验设备有限公司);RE-52A旋转蒸发仪(上海亚荣生化仪器厂);MT-180B生化恒温培养箱(上海新苗医疗器械制造有限公司);KQ5200E超声波双频清洗机(宁波新枝生物科技股份有限公司);HVE-50高压灭菌器(日本HIRAYAMA);ZWY-A2102C双层可编程恒温摇床(上海智诚分析仪器制造有限公司);G80F23CN1P-G5(S0)微波炉(格兰仕微波炉电器有限公司)。
1.2 实验方法
1.2.1 核桃楸皮活性物质的提取
(1)核桃楸皮的乙醇提取。称取一定量核桃楸皮,应用超声波提取法提取核桃楸皮中的活性物质。工艺参数为:料液比1:8(g·mL-1),乙醇体积分数95%,浸提温度35 ℃,作用时间30 min。收集提取液,提取容器中重新加入8倍量的溶剂进行提取,重复3次,将得到的抽提液合并进行减压抽滤,除去不溶性杂质,35 ℃下将滤液减压蒸馏,得到黑褐色膏状物。
称取一定量膏状物,用70%乙醇配制成3个浓度梯度,分别为50、5、0.5 mg·mL-1,并做好标记,保存待用。
(2)核桃楸皮的萃取。称取一定量的上述膏状物,加入适量去离子水,超声波振荡,使其形成分布均匀的悬浮液,依次使用适量的石油醚、氯仿、乙酸乙酯进行萃取,每种有机溶剂各萃取3次。将各相萃取液用旋转蒸发仪40 ℃下真空浓缩,分别得到石油醚相、氯仿相、乙酸乙酯相及水相物质[11]。
用甲醇溶解各有机相物质,并配制成3个浓度梯度,分别为50、5、0.5 mg·mL-1,水相物质使用超纯水配制成相同的浓度,留存待用。
1.2.2 抑菌活性测定
采用琼脂平板打孔法测试核桃楸皮提取物的抑菌活性[12]。
LB培养基融化后,室温放置温度至40 ℃左右,接入供试菌种,倒平板,待培养基凝固后,用打孔器在平板内的培养基上打4个孔,分别注入3个浓度的核桃楸皮提取物溶液各200 μL,对照孔加入200 μL相对应的溶剂。
将培养皿放入培养箱内,37 ℃条件下培养12 h,观察抑菌圈的大小并测量抑菌圈的直径,做好记录。对所得结果进行分析。
2 结果与分析
2.1 乙醇提取物的抑菌结果
乙醇提取物的抑菌效果如图1,其中标号1~3分别为50、5、0.5 mg·mL-1的乙醇提取物,标号4为70%乙醇的对照。乙醇提取物对5种致病菌均有抑制作用,其中对金黄色葡萄球菌的抑制效果最好,浓度为50 mg·mL-1时(若无提示以下均默认此浓度)抑菌圈直径为22.05 mm,对白色念珠菌的抑制效果最差,抑菌圈直径为10.50 mm。

(a)副溶血弧菌 (b)金黄色葡萄球菌 (c)大肠埃希氏菌 (d)鼠伤寒沙门氏菌 (e)白色念珠菌
2.2 萃取物抑菌结果
2.2.1 石油醚萃取物抑菌结果
石油醚萃取物经旋转蒸发后得到的浸膏有一部分不溶于甲醇,将这部分物质使用石油醚溶解后做抑菌实验,发现这些不溶于甲醇的物质对5种致病菌都无抑菌活性,故对实验结果无影响。其中溶于甲醇的物质只对金黄色葡萄球菌和弧菌有抑制作用,且对弧菌的抑制效果较好,抑菌圈直径达到22.69 mm,如图2(1~3分别为50、5、0.5 mg·mL-1的石油醚萃取物,4为甲醇对照)。

(a)副溶血弧菌 (b)金黄色葡萄球菌 (c)大肠埃希氏菌 (d)鼠伤寒沙门氏菌 (e)白色念珠菌
2.2.2 氯仿萃取物抑菌结果
氯仿萃取物的抑菌效果如图3(1~3分别为50、5、0.5 mg·mL-1的氯仿萃取物,4为甲醇对照)。氯仿萃取物对金黄色葡萄球菌、弧菌和白色念珠菌有抑制作用,对金黄色葡萄球菌抑制作用最好,抑菌圈直径为27.34 mm,对白色念珠菌的抑菌圈直径为14.30 mm。
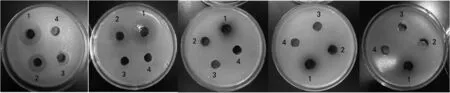
(a)副溶血弧菌 (b)金黄色葡萄球菌 (c)大肠埃希氏菌 (d)鼠伤寒沙门氏菌 (e)白色念珠菌
2.2.3 乙酸乙酯萃取物抑菌结果
乙酸乙酯萃取物对5种致病菌均有抑制作用,其中对金黄色葡萄球菌的抑制作用最好,抑菌圈直径为26.25 mm,如图4(1~3分别为50、5、0.5 mg·mL-1的乙酸乙酯萃取物,4为甲醇对照)。

(a)副溶血弧菌 (b)金黄色葡萄球菌 (c)大肠埃希氏菌 (d)鼠伤寒沙门氏菌 (e)白色念珠菌
2.2.4 水相物质抑菌结果
剩余的水相中物质只对金黄色葡萄球菌有抑制效果,对其他4种致病菌无抑菌活性,实验结果如图5(1~3分别为50、5、0.5 mg·mL-1的水相物质,4为超纯水对照)。

(a)副溶血弧菌 (b)金黄色葡萄球菌 (c)大肠埃希氏菌 (d)鼠伤寒沙门氏菌 (e)白色念珠菌
2.3 分析与讨论
萃取物质对致病菌抑制作用的标准按照中国药品生物制品鉴定所、卫生部抗菌药物细菌耐药性检测中心制定的《抗菌药物药敏试验判断标准》进行判定,即抑菌圈20 mm以上为极度敏感,15~20 mm为高度敏感,10~15 mm为中度敏感,10 mm以下为低度敏感。实验结果汇总见表1。
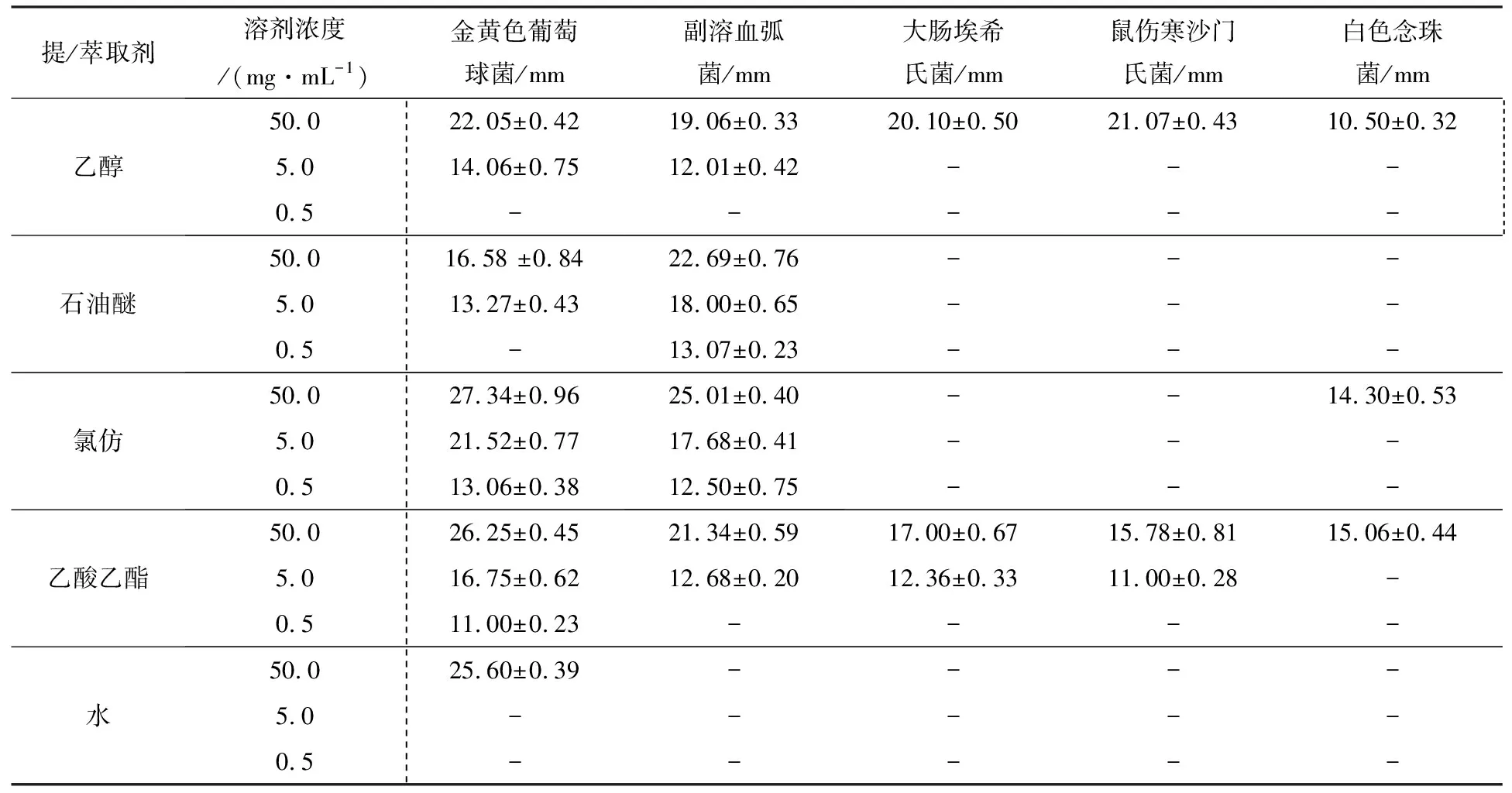
表1 实验结果汇总
注:打孔器直径9 mm
乙醇提取物对5种致病菌都有抑制作用,且对副溶血弧菌和金黄色葡萄球菌的抑制效果最好(5 mg·mL-1的浓度即对其有抑菌作用)。浓度为50 mg·mL-1时对金黄色葡萄菌、大肠杆菌和鼠伤寒沙门氏菌为极度敏感,对副溶血弧菌为高度敏感,对白色念珠菌为中度敏感,此结果为后续分离萃取提供了实验基础。
对于同一液相萃取物,石油醚相物质的最大浓度50 mg·mL-1对弧菌为极度敏感,对金黄色葡萄球菌为高度敏感,对其他3种致病菌均无影响;氯仿相物质的最大浓度对弧菌和金黄色葡萄球菌极度敏感,另外其对真菌中度敏感;乙酸乙酯相对5种致病菌都有抑制效果,其中对金黄色葡萄球菌极度敏感;剩余的水相中含有的活性物质极少,只对金黄色葡萄球菌极度敏感。
对于不同萃取相来说,对弧菌和金黄色葡萄球菌抑制效果最好的是氯仿相,但是萃取活性物质种类最多的是乙酸乙酯相。
袁海舰[11]对核桃楸皮中的活性物质进行了提取与分析,结果表明,核桃楸皮的乙醇提取物、氯仿相和乙酸乙酯相是核桃楸皮中抑菌活性成分的富集组分,与本实验的结果较为一致。
3 结 论
本研究对核桃楸皮活性成分功能的进一步分析补充了数据,也为开发抗菌药物奠定了一定的基础。核桃楸皮经乙醇提取后,依次用石油醚、氯仿、乙酸乙酯萃取,采用琼脂扩散法测试其对5种致病菌的抑菌活性。结果表明,乙醇和乙酸乙酯萃取物对5种致病菌都有抑制作用;石油醚萃取物只对弧菌和金黄色葡萄球菌有较强的抑制作用,50 mg·mL-1浓度下的抑菌圈直径分别为22.69 mm和16.58 mm;氯仿萃取物对弧菌、金黄色葡萄球菌和白色念珠菌有抑制作用,50 mg·mL-1浓度下的抑菌圈直径分别为25.01 mm和27.34 mm。具体不同萃取相中的活性物质成分有待于进一步的探索。
参考文献:
[1] KYUNG S L, GAO L, SUNG H K, et al. Cytotoxic diarylhetanoids form the roots ofjuglansmandshurica[J]. Nat Prod, 2002, 65: 1707-1708.
[2] 于海玲. 核桃楸的研究进展[J]. 延边大学学报, 2005, 28(2): 154-156.
[3] 宋玉荣,姜春霞. 满药复方木鸡颗粒研究新进展[J].中国医药导报,2013, 10(1): 4-5.
[4] 钟美玲,刘宝全,鲁晓莉,等.煎煮方式对满药木鸡汤药对溶出组分的影响[J].时珍国医国药,2017,28(10):2396-2400.
[5] 赵玉佳,雷涛,张春军,等.核桃楸皮化学成分研究进展[J].牡丹江医学院学报,2010,31(4):61-63.
[6] 梁慧峰. 核桃楸的化学成分及利用研究进展[J].北方园艺, 2010(16): 219-221.
[7] 王莲萍, 张莲珠, 吕雪峰,等. 胡桃楸树皮的研究进展[J]. 西北药学杂志, 2010, 25(3): 231-232.
[8] 梁启超,刘爽,张朝立.核桃楸皮提取物对人肝癌细胞SMMC-7721的增殖抑制作用及对细胞周期的影响[J].林产化学与工业,2017,37(3) :136-140.
[9] 雷涛,梁启超,常乐,等.核桃楸皮乙醇提取液对人肝癌细胞抑制作用的研究[J].实验室科学,2012,15(6):81-82.
[10] 吴铁松,何文平,吴丽霞. 核桃楸树皮水提取物抗突变和抑瘤作用研究[J]. 国际医药卫生导报,2011, 17(12): 1412.
[11] 袁海舰. 核桃楸树皮中活性物质的提取与分析[D]. 哈尔滨:东北林业大学, 2007.
[12] 谭才邓,朱美娟,杜淑霞,等.抑菌试验中抑菌圈法的比较研究[J].食品工业,2016,37(11):122-125.

