胸腺肽α1用于肿瘤化疗患者疗效及生存预后的Meta分析
刘 欢,郭西芮,吴行伟,熊 欢,龙恩武,3
(1.电子科技大学医学院,四川 成都 611731;2.四川大学华西药学院,四川 成都 610041;3.四川省医学科学院·四川省人民医院药学部,个体化药物治疗四川省重点实验室,四川 成都 610072)
胸腺肽α1(thymosin α1,Tα1)能调节T细胞亚群比例、促进B细胞分化、增强巨噬细胞功能、改善肿瘤患者的细胞免疫系统功能[1~4]。2011年Wolf 等[5]发表在Cochrane的系统评价文章中回答了Tα1能提高放化疗患者的反应性和耐受性。肿瘤预后的好坏影响患者的生活质量[6],但未有研究系统评价Tα1是否可以影响肿瘤患者生存预后。此外生存资料数据合并是一个棘手的问题,由于原始数据较难获得,大多无法直接获得其效应量及可信区间[7]。本研究对Kaplan-Meier生存曲线中有效数据进行提取并计算,并使用危险比(hazard ratio,HR,Cochrane系统评价手册推荐[8])为生存资料测量指标,系统评价标准化疗方案联合Tα1能否改善肿瘤患者的生存预后情况,即延长总生存期(overall survival,OS)危险比和无进展生存期(progression-free survival,PFS)危险比,以期为临床实践提供依据。
1 材料与方法
1.1检索策略计算机检索Pubmed、EMBASE、Cochrane Library、Web of Science、中国期刊全文数据库(CNKI)、中国生物医学文献数据库(CBM)、中文科技期刊全文数据库(VIP)、万方中文科技期刊全文数据库(WANFANG),文献检索时限均从建库到2017年7月,RCT检索策略遵循Cochrane系统评价手册5.1.0,所有检索策略通过多次预检索后确定。检索词为(thymosin alpha1 OR thymosin α1 OR thymalfasin OR maipuxin OR zadaxin)AND AND chemotherapy,(胸腺肽alpha1或者胸腺肽α1或者胸腺法新或者迈普新或者日达仙)并且化学治疗。
1.2纳入与排除标准
1.2.1文献纳入标准 ①试验类型为随机对照试验(randomized controlled trial,RCT)。②研究对象为接受标准化疗的成人(年龄>18岁)恶性肿瘤患者,不论肿瘤类型、病程分期和前期治疗情况。③干预措施:试验组采用标准化疗方案+Tα1;对照组采用标准化疗方案+安慰剂或空白。④结局指标中含有疗效及预后指标:1年生存率;有效率:以完全缓解+部分缓解(CR+PR)为有效指标来计算有效率;总生存期危险比(hazard ratio,HR);无进展生存期危险比(或含Kaplan-Meier曲线图可间接计算出相应数据)。文中未直接报道5年生存期,通过半年或1年的生存率生成的Kaplan-Meier生存曲线来估算5年生存率,与现实可能存在较大偏差,故本文未纳入5年生存期。
1.2.2文献排除标准 ①综述及病例报告,只有摘要而缺乏全文的文献;②未报道生存资料或没有给出生存曲线的研究。
1.3文献筛选与资料提取两位研究者分别筛选符合纳排标准的研究,提取完成后交叉核对纳入研究的结果,对有分歧的意见通过小组讨论或由第三方决定。提取的信息资料主要包括:①一般资料:题目、作者姓名、发表日期、文献来源等;②研究特征:研究对象的基本特征、患者例数、年龄、肿瘤类型、分期及干预措施;③结局指标;④方法学质量评价的指标。
1.4质量评价按照Cochrane评价手册5.1.0评价RCT质量的评价标准[7],2位评价员独立对纳入文献,根据质量评价标准进行评价:①随机序列生成;②分配隐藏;③对患者、试验人员实施盲法;④对结局评估者实施盲法;⑤结果数据完整性;⑥选择性报告;⑦其它偏倚。针对每一项研究结果,对上述7条标准做出“是”(低度偏倚)、“否”(高度偏倚)和“不清楚”判断。完全满足上述7条质量标准,质量为A级;≥上述1条描述不清楚者,质量为B级;≥上述1条未描述者,质量为C级。
1.5统计学方法采用Cochrane协作网提供的Review Manager 5.3软件进行分析,根据异质性检验的结果,选择统计模型。采用方差倒数法合并效应量HR及其95%CI,计数资料采用风险比(risk ratio,RR)合并。各研究间的异质性采用Q检验和I2检验,当各研究间无统计学异质性(P> 0.1,I2<50%),采用固定效应模型;若研究间存在统计学异质性(P< 0.1,I2>50%),分析其异质性来源,对可能导致异质性的因素亚组分析,检查是否含有临床异质性时,若两项研究组之间无临床异质性但存在统计学异质性,采用随机效应模型进行分析。异质性源于低质量研究,则进行敏感性分析。当两组间异质性过大或无法找寻数据来源时,采用描述性分析。
2 结果
2.1纳入研究特征本次研究最终纳入7篇[3,9~14]符合条件的文献,共纳入517例患者(文献检索及筛选流程见图1,纳入研究的文献基本特征见表1。7项研究均报道了生存曲线,仅有1项研究[11]报道了HR值。纳入的研究均为RCT,其中2项研究[3,11]采用随机数字表法,1项研究[9]采用信封法,1项研究[10]采用抽签法;7项研究均未描述是否对分配方案进行隐藏、是否有测量偏倚和是否有其他偏倚;1项研究[4]的表述可推断出是实施盲法;3项研究[4,13,16]报道了缺失数据,其中1项[3]进行了意向性治疗分析;有2研究[10,12]的表述可推断出其很可能存在选择性报告(报告一个或多个主要结局指标未预先设定)。本研究纳入的7篇RCT研究,5项研究[3,9,11,13,14]被评为B级,2项研究被[10,12]评为C级,文献质量评价见表2。纳入研究均提及随机分配,均未描述是否对分配方案进行隐藏、是否有测量偏倚;6项研究[9~14]未描述盲法,4项研究[10,12~14]未报道缺失数据或原因。

图1 文献检索及筛选流程图
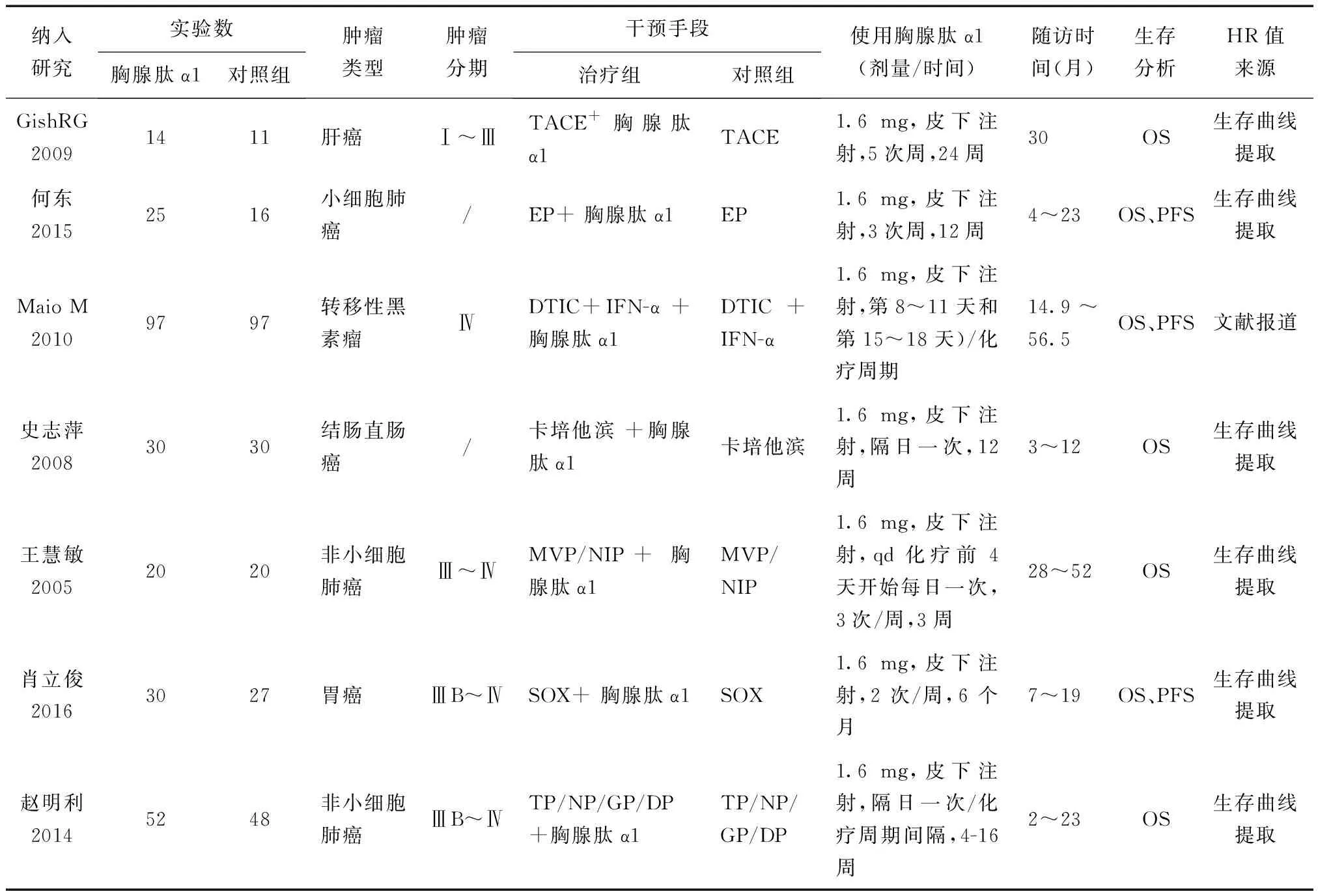
纳入研究实验数胸腺肽α1对照组肿瘤类型肿瘤分期干预手段治疗组对照组使用胸腺肽α1 (剂量/时间)随访时间(月)生存分析HR值来源GishRG20091411肝癌Ⅰ~ⅢTACE+ 胸腺肽α1TACE1.6 mg,皮下注射,5次周,24周30OS生存曲线提取何东20152516小细胞肺癌/EP+ 胸腺肽α1EP1.6 mg,皮下注射,3次周,12周4~23OS、PFS生存曲线提取Maio M 20109797转移性黑素瘤ⅣDTIC+IFN-α +胸腺肽α1DTIC+ IFN-α1.6 mg,皮下注射,第8~11天和第15~18天)/化疗周期14.9~56.5OS、PFS文献报道史志萍20083030结肠直肠癌/卡培他滨 +胸腺肽α1卡培他滨1.6 mg,皮下注射,隔日一次,12周3~12OS生存曲线提取王慧敏20052020非小细胞肺癌Ⅲ~ⅣMVP/NIP+ 胸腺肽α1MVP/NIP1.6 mg,皮下注射,qd化疗前4天开始每日一次,3次/周,3周28~52OS生存曲线提取肖立俊20163027胃癌ⅢB~Ⅳ SOX+ 胸腺肽α1SOX1.6 mg,皮下注射,2次/周,6个月7~19OS、PFS生存曲线提取赵明利20145248非小细胞肺癌ⅢB~ⅣTP/NP/GP/DP +胸腺肽α1TP/NP/GP/DP1.6 mg,皮下注射,隔日一次/化疗周期间隔,4-16周2~23OS生存曲线提取
2.2Meta分析结果化疗方案联合Tα1与单用化疗方案相比:在有效率方面差异有统计学意义(P< 0.05),提示化疗方案联合Tα1可提高肿瘤患者治疗的有效率;在1年生存率方面差异有统计学意义(P< 0.05),提示化疗方案联合Tα1可提高肿瘤患者的1年生存率;在OS危险比方面差异有统计学意义(HR=0.73,95%CI:0.62~0.87,P< 0.001),提示化疗方案联合Tα1在OS上预后较好,可延长肿瘤患者的总生存期;在PFS危险比方面差异有统计学意义(HR=0.83,95%CI:0.73~0.95,P< 0.01),提示化疗方案联合Tα1在PFS上预后较好,可延长肿瘤患者的无进展生存期。见表3。
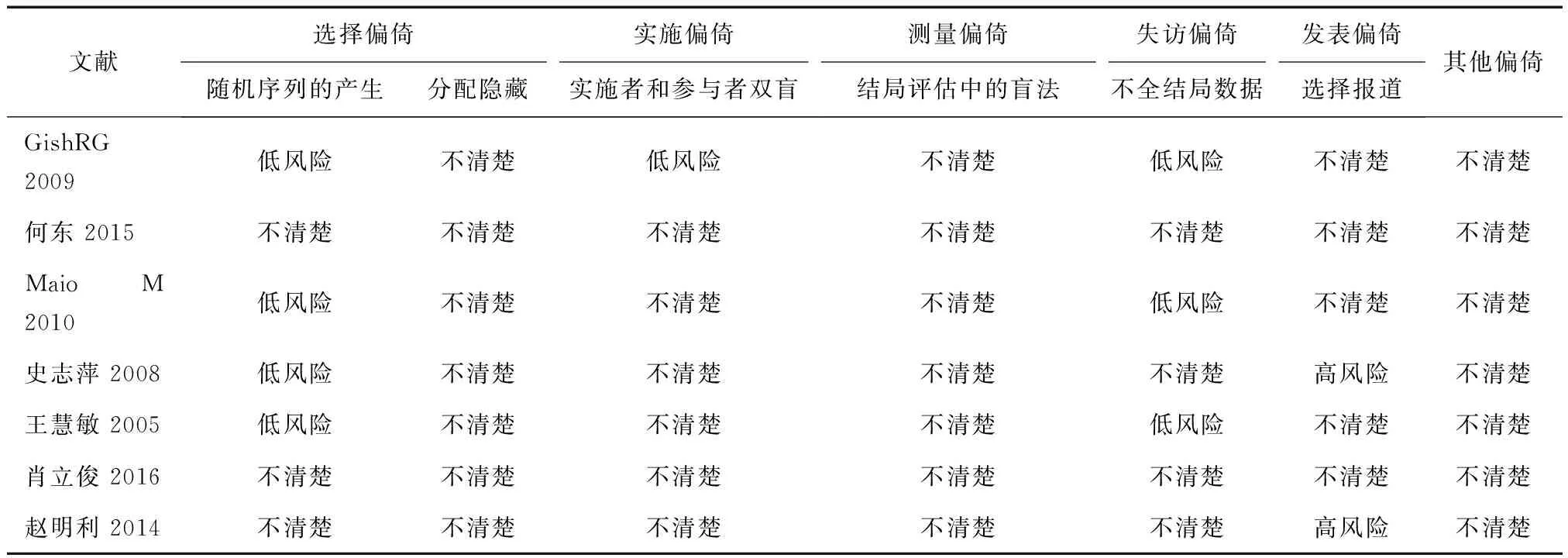
表2 纳入文献的质量评价Cochrane风险偏倚评估

表3 Meta分析结果
2.3敏感性分析7项RCT试验同质性较好,排除2篇可能存在报告偏移的文献[10,12]来检测其对结果的影响。有效率方面的Meta分析结果有统计学结果有变化,其P值由0.03变为0.09,见图2。OS方面的Meta分析结果未发生实质性变化,见图3。其余合并效应量的统计学结果均未发生改变,结果整体稳定性较好。由于研究小于10篇,故没有采用漏斗图评估发表偏移。

图2 有效率敏感性分析森林图

图3 OS敏感性分析森林图
3 讨论
Tα1在临床肿瘤治疗中的应用越来越广泛,有研究表明Tα1可以减少体外和体内肿瘤细胞的生长[15],并有RCT研究证明Tα1在非小细胞肺癌[16]、肝细胞癌[17]和恶性肿瘤黑色素瘤[11]等的治疗中具有改善免疫功能、抑制肿瘤复发和转移、提高恶性肿瘤缓解率、减轻放疗及化疗引起的不良反应、增强抵御感染的能力等作用。本研究在1年生存期、OS危险比、PFS危险比方面差异有统计学意义,在有效率方面虽然排除2篇可能存在报告偏移的文献后结果由P= 0.03变为P= 0.09,可能符合纳入条件的临床试验人数偏少,P在0.05附近需要扩大样本数据来验证提高统计检测效能。
目前胸腺肽α1的使用时间仍然没有定论。免疫药物会扰乱正常的免疫功能[18],当防御功能过高,可导致机体发生变态反应;稳定功能发生紊乱时,可引起自身免疫性疾病。肿瘤患者使用胸腺肽α1多是辅助化疗,随化疗周期使用,使用时间多为一年。长期使用胸腺肽α1的安全性需要长期的临床研究来验证。
有关肿瘤患者预后的临床试验,主要的研究指标为OS或PFS,虽然生存数据的系统评价在预后研究中应用广泛,但由于生存资料原始数据通常较难获得,许多研究无法直接获得其效应量及其可信区间。本研究对Kaplan-Meier生存曲线中有效数据使用Engauge Digitizer软件进行提取,并计算危险比HR值。系统评价化疗方案联合Tα1改善肿瘤患者的生存预后情况。有效率和1年生存率的Meta分析结果提示:与单用化疗方案相比,联合Tα1可以提高肿瘤患者的治疗有效率和1年生存率;对生存预后指标OS的危险比和PFS危险比方面的结果提示化疗方案联合Tα1可以延长肿瘤患者的OS和PFS。
综上所述,本研究纳入以OS和PFS的危险比为主要结局指标的研究合并效应量,结果提示在标准化疗的基础上使用Tα1可以提高近期有效率、改善肿瘤患者的生存预后、提高患者的生存质量。但尚需更多大规模、多中心、高质量的生存资料方面的临床研究验证Tα1在肿瘤患者长期生存预后方面的作用。
[1] Umeda Y,Sakamoto A,Nakamura J,et al.Thymosin alpha 1 restores NK-cell activity and prevents tumor progression in mice immunosuppressed by cytostatics or X-rays[J].Cancer Immunol Immunother,1983,15(2):78-83.
[2] Rasi G,Silecchia G,Sinibaldi-Vallebona P,et al.Anti-tumor effect of combined treatment with thymosin alpha 1 and interleukin-2 after 5-fluorouracil in liver metastases from colorectal cancer in rats[J].Int J Cancer,1994,57(5):701-705.
[3] Gish RG,Gordon SC,Nelson D,et al.A randomized controlled trial of thymalfasin plus transarterial chemoembolization for unresectable hepatocellular carcinoma[J].Hepatol Int,2009,3(3):480-489.
[4] Danielli R,Fonsatti E,Calabrò L,et al.Thymosin α1 in melanoma:from the clinical trial setting to the daily practice and beyond[J].Ann N Y Acad Sci,2012,1270(1):8-12.
[5] Wolf E,Milazzo S,Boehm K,et al.Thymic peptides for treatment of cancer patients[J].Cochrane Database Syst Rev,2011,(2):CD003993.
[6] 李世武,陈瑶,虞丽丽,等.X连锁凋亡抑制蛋白表达对肿瘤患者生存预后影响的Meta分析[J].中国新药与临床杂志,2015,34(4):262-270.
[7] 周支瑞,张天嵩,李博,等.生存曲线中Meta分析适宜数据的提取与转换[J].中国循证心血管医学杂志,2014,6(3):243-247.
[8] Higgins J,Green SE.Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0.The Cochrane Collaboration (Eds):[J].Naunyn-Schmiedebergs Archiv für experimentelle Pathologie und Pharmakologie,2011,2011(14):S38.
[9] 王慧敏,陈玉蓉,廖美琳,等.胸腺肽α1在非小细胞肺癌治疗中的应用[J].中国癌症杂志,2005,15(3):244- 247.
[10]史志萍,刘丽坤,李宜放,等.卡培他滨联合胸腺肽α1治疗高龄晚期结直肠癌临床观察[J].肿瘤研究与临床,2008,20(10):695-696.
[11]Maio M,Mackiewicz A,Testori A,et al.Large randomized study of thymosin alpha 1,interferon alfa,or both in combination with dacarbazine in patients with metastatic melanoma[J].J Clin Oncol,2010,28(10):1780-1787.
[12]赵明利,毕清,田青,等.胸腺法新对晚期非小细胞肺癌患者免疫功能的影响[J].疑难病杂志,2014,30(7):683-685.
[13]何东,陈志钊,李晶晶.胸腺肽α1治疗小细胞肺癌临床疗效观察[J].医学信息,2015,28(34):54.
[14]肖立俊,苏畅,曹奕鸥,等.胸腺肽α1联合SOX方案在进展期胃癌术后辅助化疗中的应用[J].中国临床医学,2016,23(2):207-210.
[15]Pica F,Fraschetti M,Matteucci C,et al.High doses of thymosin alpha 1 enhance the anti-tumor efficacy of combination chemo-immunotherapy for murine B16 melanoma[J].Anticancer Res,1998,18(5A):3571-3578.
[16]Garaci E,Lopez M,Bonsignore G,et al.Sequential chemoimmunotherapy for advanced non-small cell lung cancer using cisplatin,etoposide,thymosin-alpha 1 and interferon-alpha 2a[J].Eur J Cancer,1995,31A(13-14):2403-2405.
[17]He C,Peng W,Li C,et al.Thymalfasin,a promising adjuvant therapy in small hepatocellular carcinoma after liver resection[J].Medicine (Baltimore),2017,96(16):e6606.
[18]徐景煊.被扰乱的免疫系统生物钟[J].新发现,2014,26(10):22.

