巧用虚拟容器理解化学平衡中的有关问题
高衍文 陈德强
(山东省曲阜市第一中学 273100)
在化学平衡中经常考查气体的转化率、平均摩尔质量、浓度、压强及百分含量的变化.有些习题如果直接用所学有关原理去解,会感到无法着手,这类习题大多数可以用“虚拟容器法”解答.兹举例说明如下.
例1 向一体积不变的密闭容器中通入4 molM气体(如图所示),在一定条件下发生反应:

达到平衡后若再通入4 molM气体,再次达到平衡时,与原平衡相比,M的转化率( )
A.不变 B.增大 C.减小 D.无法判断
解析
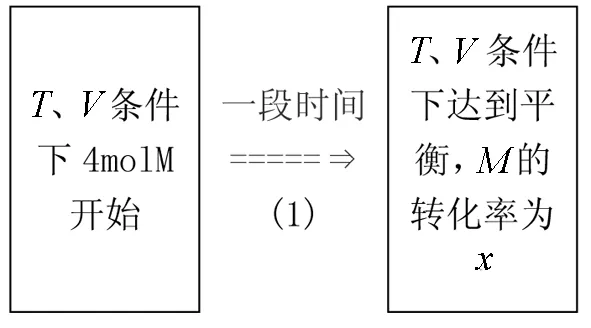
图1 原平衡的建立过程
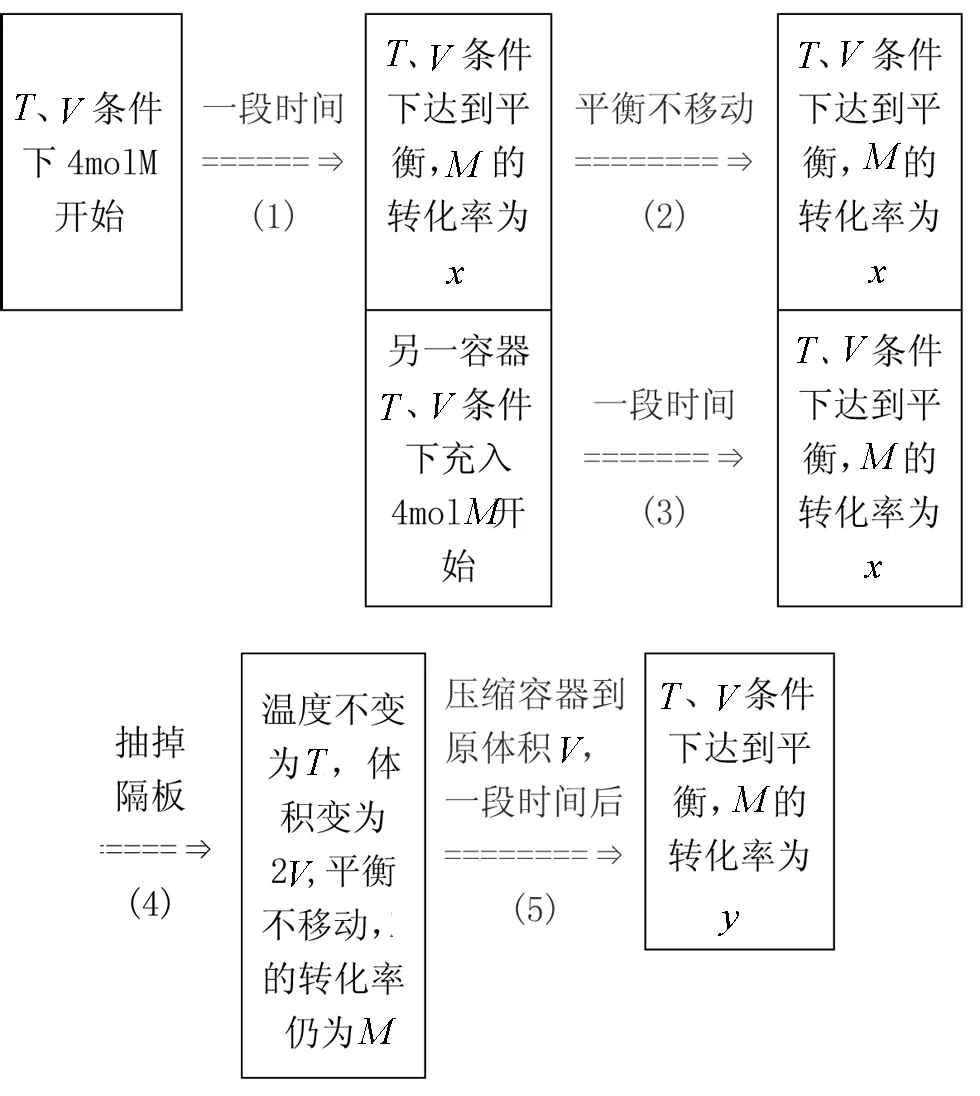
图2 新平衡的建立过程
把4 molM气体通入到与原容器温度和体积完全一样的另一个容器中,则达到平衡后,该容器中的平衡与原容器中的平衡完全相同,M的转化率当然也相等都为x.为了保持容器体积不变,把都平衡后的两个容器中间的隔板抽掉变成一个容器,温度不变为T,体积变为2V,平衡不移动,M的转化率仍为x(如图2所示),然后保持温度不变,再压缩体积到V,则平衡

向右移动,导致M的转化率增大.
答案B
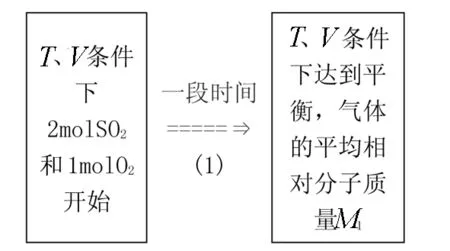
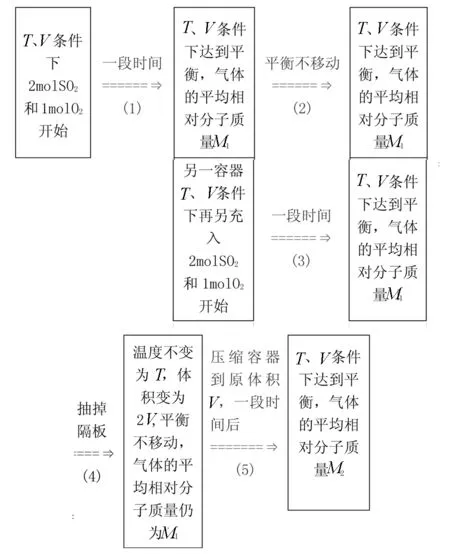
例2 在一定温度下,向体积为V的密闭容器里充入2 mol SO2和1 mol O2,发生如下反应
2SO2(g)+O2(g)2SO3(g)
达到平衡后,容器中气体的平均相对分子质量为M1(如图3所示),保持体积不变,再向该容器中充入2 mol SO2和1 mol O2,达到新的平衡后,气体的平均相对分子质量变为M2(如图4所示).则M1和M2的大小关系正确的是( )
A.M1 C.M1>M2D.无法判断 解析 图3 原平衡的建立过程 图4 新平衡的建立过程 根据图4设置的虚拟容器,通过图示的改变不难得出答案. 答案A 练习 1.一定温度下,在甲、乙、丙体积均为V的恒容密闭容器中反应 达到平衡.下列说法正确的是( ) A.该反应的正反应放热 B.达到平衡时,容器甲中反应物转化率比容器乙中的大 C.达到平衡时,容器乙中c(H2)大于容器丙中c(H2)的两倍 D.达到平衡时,容器丙中的正反应速率比容器甲中的大 2.在恒容密闭容器中投入等物质的量的NH3(g)、Cl2(g),在一定条件下发生 反应,这是工业上制备氯胺的原理,达到平衡状态. (1)下列情况能说明该反应达到平衡状态的是 ________ (填字母). A.混合气体的密度不再改变 B.氯胺的体积分数不再改变 C.混合气体的平均相对分子质量不再改变 D.混合气体中c(HCl)不再改变 (2)如果该反应达到平衡之后,其他条件不变,再充人1mol NH3(g)、1 mol Cl2(g),平衡________(填“向左”“向右”或“不”)移动,达到新平衡时NH3的转化率将 ________ (填“增大”“减小”或“不变). 答案1.D 2.(1)BD (2)向右 不变 参考文献: [1]洪云龙.化学平衡移动教学应用“三态”模型的研究[J].课程教学研究,2015(6):32-33. [2]张利琦.关于高中化学教师对化学平衡移动学科理解的探查研究[D].长春:东北师范大学,2013. [3]唐纪轩.等效假设法在解化学平衡习题中的应用[J].中学生数理化:高二版,2008(9):30-31.