彭泽鲫夏季低温休眠保活技术研究
秦 旭QIN Xu 涂宗财, -, 王 辉 张 露 沙小梅 - 张南海 -
(1. 南昌大学食品科学与技术国家重点实验室,江西 南昌 330047;2. 江西师范大学生命科学学院,江西 南昌 330022)
随着消费的不断升级,选择健康营养的膳食结构已经成为当下主流的生活方式,而鲜活鱼类由于其低脂肪、高蛋白的营养特点,已经成为合理膳食营养结构中不可或缺的组分[1]。中国是渔业大国,2016年淡水鱼产量3.411×107t,同比增长3.68%,其中鲫鱼产量排第五,为3.005×106t;2016年,中国人均鲜活水产品消费约为21.7 kg,预计到2035年,中国人均鲜活水产品消费将达到32.48 kg[2-3]。然而,中国地域辽阔,山川相隔,许多优质水产品远离广大消费市场,这在很大程度上限制了消费。因此,研究影响水产品保活运输的因素,寻求最佳的保活方法,延长保活时间,减少运输过程中的死亡损耗是解决活鱼远销的重要途径之一。
目前鲜活鱼类的运输方法主要有常温充氧运输、麻醉运输、低温休眠运输和生态冰温无水运输4种[4-5]。冰温贮藏技术最初由山根昭美在20世纪70年代提出,随后得到广泛研究[6]。白艳龙等[7]采用无水冰温技术保活黄颡鱼24 h后的成活率可达100%;吴云辉等[8]采用0 ℃无水保活黑鲷鱼36 h后存活率达到100%;徐中平等[9]采用低温无水保活星斑川鲽65 h 存活率为100%;任红梅等[10]采用无水低温技术保活青虾6 h后成活率为83.4%;韩利英[11]、米红波[12]等利用冰温技术结合麻醉剂对鲫鱼进行保活试验也取得了一定的成果,但是麻醉剂在水生动物体内代谢机理还不清楚,麻醉剂的安全性也缺乏权威性判断,存在一定的食品安全隐患[13-15]。而低温休眠运输和生态冰温无水运输的基本原理是通过低温来抑制水产品的新陈代谢速率,减少耗氧以达到保活长运的目的,它具有用水量少、保活时间长和运输密度大等优点[16-17]。
鱼类会因季节变化调节自身生理状态以适应环境,因此保活条件会因季节的差异而不同。在夏季,由于温度较高,鱼的新陈代谢旺盛,应激反应增强,代谢废物积累迅速,极易死亡[18],因此活鱼的夏季长途保活运输面临严峻考验。连凤英[19]曾采用17 ℃低温研究青鱼夏季保活运输,保活时间仅为8~10 h,难以满足长途运输需要。如果能够采用绿色、安全、有效的保活技术解决夏季长距离活运问题,不仅能够衔接产销两地,而且能大大促进渔业的健康发展。
彭泽鲫属于广温性鱼类,是江西省的特种水产[20],深受广大消费者的喜爱,但是关于彭泽鲫的夏季保活研究鲜有见闻。虽然韩利英等[11]使用MS-222有水保活鲫鱼达到3 d,但是MS-222的消退期要21 d,且化学麻醉剂用于食用鱼的保活运输的安全性缺乏权威性判断[13]。因此本研究拟以彭泽鲫为研究对象,通过单因素试验研究保活温度、鱼水质量比、暂养时间和NaCl添加量对鲫鱼夏季低温休眠保活时间的影响,找出各因素最优水平,再通过正交试验,确定其低温休眠保活的最佳保活工艺,以达到为鲫鱼夏季长途保活运输提供长时间且无麻醉剂安全隐患的保活技术提供支持的目的。
1 材料与方法
1.1 材料与试剂
彭泽鲫:于6~8月购自九江市水产科学研究所,鲫鱼送到实验室后在水箱中暂养一段时间,暂养水温24~27 ℃,暂养期间保持水质清洁及氧气泵工作,试验前选择体质健壮、体表无伤痕、重量为(440±30) g的鲫鱼作为试验对象;
氯化钠:≥99.5%,分析纯,天津大茂化学试剂厂。
1.2 试验器材
数字式温度计:Yenpa型,深圳元霸科技有限公司;
恒温恒湿箱:HH-150型,上海翰强仪器设备厂;
低温试验箱:DW-40型,绍兴富祥精密仪器有限公司;
电子天平:ML104/02型,梅特勒-托利仪器(上海)有限公司。
1.3 试验方法
1.3.1 鲜活与死亡的判定 将装在密闭自封袋中的鲫鱼从恒温箱中取出,若观察到鱼腮盖有张合或反复刺激后鲫鱼有反应则判定鱼是鲜活的,若经过反复刺激且放入水中一段时间后仍无反应则视为死亡,并且以鲫鱼死亡点前一次取出的时间点作为其保活时间的极限。
1.3.2 休眠温度的测定 将彭泽鲫放入盛有清水的保温箱内,以冰块为冷源降温,通过控制加冰块的数量和补给冰块的时间点把降温速率控制在4~6 ℃/h,用数字温度计实时测量水温,同时观察彭泽鲫在不同温度下的呼吸频率及生理反应,鲫鱼的呼吸频率是以其鱼鳃盖的张合次数作为标准来衡量。以鲫鱼安静地躺在水下,几乎看不到其呼吸时的温度作为其休眠温度[11]。
1.3.3 冻结点温度的测定 取3条彭泽鲫,迅速敲击头部致死[21],再将数字温度计的探头插入鲫鱼脊背中间位置,探头没入肉中约0.5 cm,放在-40 ℃低温试验箱中进行冻结,实时记录鱼肉温度并绘制冻结曲线,曲线较为平稳的阶段即看作鲫鱼的冻结点温度[11]。
1.3.4 夏季低温休眠保活运输技术流程
鲫鱼→停食暂养→诱导休眠→装袋→充氧气→密封→保活
鲫鱼:选择体表无伤,有活力的彭泽鲫;停食暂养:停止投食喂养彭泽鲫,同时用氧气泵充氧以保持水中溶氧量;诱导休眠:将彭泽鲫置于保温箱内,以冰块为冷源降温,降温过程中31~20 ℃温度段以3 ℃/h的速率降温,20~7 ℃温度段以2 ℃/h的速率降温;充氧:将休眠的彭泽鲫放入自封袋中,充入纯氧密封;保活:将装袋充氧密封的彭泽鲫置于恒温箱内保活。
1.3.5 夏季低温休眠保活单因素试验
(1) 保活温度:鲫鱼停食暂养24 h,诱导休眠过程中,31~20 ℃温度段以3 ℃/h的速率降温,20~7 ℃温度段以2 ℃/h 的速率降温,再将休眠的鲫鱼装袋充纯氧气后分别置于2~3,5~6,8~9,10~12,13~14,15~16,17~18 ℃下保活,保活结束后,以保活时间为指标,确定最优保活温度。
(2) 鱼水质量比:鲫鱼停食暂养24 h,诱导休眠过程中,31~20 ℃温度段以3 ℃/h的速率降温,20~7 ℃温度段以2 ℃/h 的速率降温,按鱼水质量比2∶0,2∶1,2∶2,2∶3,2∶4 加清水,再将休眠的鲫鱼装袋充纯氧气后置于14 ℃下保活,保活结束后,以保活时间为指标,确定最优鱼水质量比。
(3) 暂养时间:将鲫鱼分别停食暂养0,24,48 h,诱导休眠过程中,31~20 ℃温度段以3 ℃/h的速率降温,20~7 ℃温度段以2 ℃/h的速率降温,按鱼水质量比2∶3加清水装,再充纯氧气后置于14 ℃下保活,保活结束后,以保活时间为指标,确定最优暂养时间。
(4) NaCl添加量:鲫鱼停食暂养24 h,诱导休眠过程中,31~20 ℃温度段以3 ℃/h的速率降温,20~7 ℃温度段以2 ℃/h 的速率降温,按鱼水质量比2∶3加水,在按添加水质量的0.0%,0.2%,0.5%,0.8%添加NaCl,然后充纯氧气后置于14 ℃下保活,保活结束后,以保活时间为指标,确定最优NaCl添加量。
1.3.6 夏季低温休眠保活的正交试验 以单因素试验为基础,设计保活温度、暂养时间、鱼水质量比和NaCl添加量的四因素三水平正交试验,以保活时间为指标,研究彭泽鲫夏季低温休眠保活的最佳技术条件。
2 结果与讨论
2.1 彭泽鲫的休眠温度
由表1可知,在加冰降温过程中彭泽鲫的呼吸频率先略微上升,然后下降直到休眠。水中加冰使得水温环境突然发生变化,彭泽鲫对于外界环境的变化迅速产生了应激反应[22],主要表现在呼吸频率升高,游动加快。但随着水温的不断下降,彭泽鲫的呼吸频率也随之下降,当温度降到11 ℃左右时,鱼体游动缓慢,受刺激时极易窜动,导致受伤,因此当彭泽鲫进入该阶段时,尽量避免外界干扰或刺激。当温度降到9 ℃左右时,鱼体失去平衡,挣扎,侧翻。当温度降到7 ℃ 左右时,大约80%的彭泽鲫出现:呼吸非常微弱,安静地躺在水底,对外界的刺激反应迟钝;另外由于鲫鱼个体之间存在一定的差异,每条鱼的休眠温度会有所差异,故此时的温度可认为已经达到或者接近鲫鱼的休眠温度,既彭泽鲫的休眠温度为7 ℃左右。
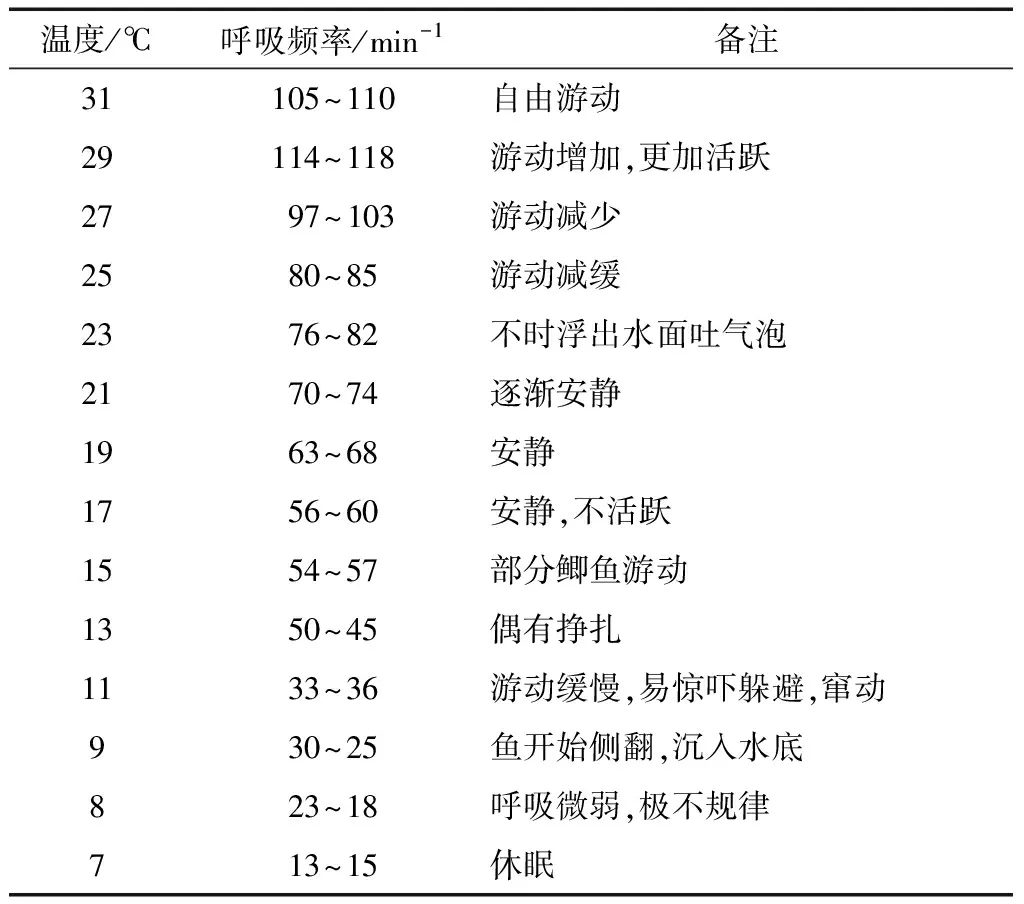
表1 不同温度下彭泽鲫的呼吸频率Table 1 Breath frequency of Pengze crucian carp at different temperatures
2.2 彭泽鲫的冻结点
由图1可知,在-40 ℃冻结温度下鱼体的温度不断下降,在略低于0 ℃时鱼体温度趋于平稳,然后又加速降温,因此,彭泽鲫的冻结点温度略低于0 ℃,继续降温将导致鱼肉冻结,彭泽鲫死亡。故彭泽鲫的夏季保活温度下限临界温度约为0 ℃,然后研究不同温度下彭泽鲫休眠保活时间。

图1 彭泽鲫的冻结曲线Figure 1 Freezing curve of Pengze crucian carp
2.3 彭泽鲫夏季低温休眠保活单因素试验
2.3.1 保活温度对彭泽鲫保活时间的影响 如图2所示,彭泽鲫在夏季的低温休眠保活时间先随温度的升高而增加,在14 ℃左右最大,达到34 h,继续升高温度,保活时间反而下降。夏季的气温、水温较高,彭泽鲫没有经过一段时间的冷训,短时间内温度的大幅度下降会导致其自身的呼吸代谢受到严重抑制,强应激反应产生的不利影响不能被彭泽鲫自身的新陈代谢调控所适应,故影响了彭泽鲫的保活寿命[17]。王利娟等[23]研究发现,大口黑鲈鱼不能在其休眠温度及以下保活;吕飞等[24]也研究得出,水产品的保活温度不是越低越好,还要根据水产品的运输季节及其种类、规格等因素选择合适的保活温度。在14 ℃左右,彭泽鲫既可以维持极低的耗氧量,也可保持其正常的新陈代谢,低温胁迫程度相对较低,能通过调控自身的生理代谢适应环境变化,故保活时间较长[25]。因此,14 ℃左右为彭泽鲫适宜的保活温度,而非在生态冰温内低温保活。
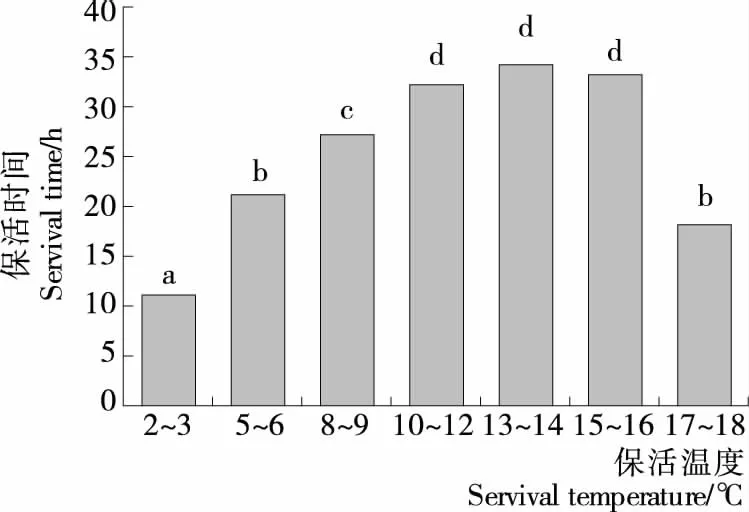
不同字母表示各组试验结果存在显著性差异(P<0.05)图2 保活温度对彭泽鲫低温休眠保活时间的影响
Figure 2 Effect of survival temperature on survival time of Pengze crucian carp under low temperature dormancy
2.3.2 鱼水质量比对彭泽鲫保活时间的影响 如图3所示,在保活过程中彭泽鲫的保活时间随着加水量的增加而不断延长,但是当鱼水质量比达到2∶3时,继续加水,彭泽鲫保活时间没有显著延长(P>0.05)。在密闭的环境中加水可以改善彭泽鲫的存活环境,利于其通过鳃呼吸获取外界的氧气,减少能量消耗,从而延长保活时间[26-27]。但是在体积一定的密闭环境中继续加水会导致充入的氧气减少,彭泽鲫可以利用的氧气量也随之减少,故在保活过程中加水量继续增加,保活时间也不会显著延长。因此结合实际效益考虑,选择鱼水质量比为2∶3较为合理。
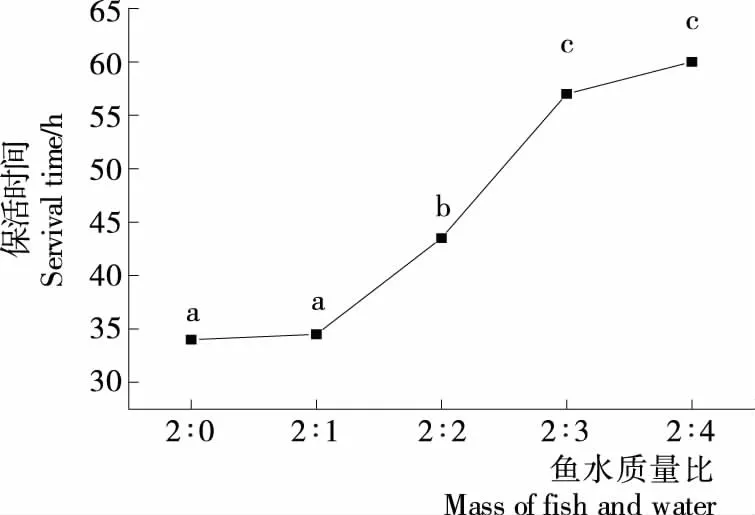
不同字母表示各组试验结果存在显著性差异(P<0.05)图3 鱼水质量比对彭泽鲫保活时间的影响
Figure 3 Effect of mass ratio of fish and water on survival time of Pengze crucian carp
2.3.3 暂养时间对彭泽鲫保活时间的影响 如图4所示,停食暂养24 h可显著提高彭泽鲫的保活时间,当停食暂养时间为48 h时,彭泽鲫的保活时间没有显著延长。暂养前彭泽鲫摄取了一定量的食物,通过一段时间的停食暂养后,彭泽鲫把肠胃内的食物消化排泄了,保活时就会极大地减少新陈代谢产生的食物残渣和粪便排泄量,减缓对保活水质的污染速度和程度,而且水质的好坏对鱼类的存活至关重要[28]。同时停食暂养在一定程度上可以降低鱼类的新陈代谢速率[29],因此暂养可以延长鲫鱼的保活时间。但当彭泽鲫肠胃内的食物消化排泄完后,再延长停食暂养时间则不会延长保活时间。故彭泽鲫在进行低温休眠保活运输前停食暂养24 h最佳。

不同字母表示各组试验结果存在显著性差异(P<0.05)图4 暂养时间对彭泽鲫保活时间的影响Figure 4 Effect of stop feed time on survival time of Pengze crucian carp
2.3.4 NaCl添加量对彭泽鲫保活时间的影响 将鲫鱼暂养24 h后诱导休眠并按鱼水质量比2∶3加水装入自封袋,置于恒温箱保活。如图5所示,随着NaCl添加量的增加,彭泽鲫的低温休眠保活时间先增加后减少,NaCl的添加量为0.2%时,彭泽鲫的保活时间最长,达到104.5 h。在运输过程中添加适量的NaCl可以平衡水和淡水鱼血液之间的渗透压差,防止血液中离子的流失,降低因环境变化引起的应激反应,同时可以减少鱼类表皮黏液的产生,降低对水体的污染。但是水中过高的盐分会引起渗透压失衡以及水中溶氧量减少,产生不利影响,缩短其保活时间[30]。因此,在淡水鱼运输时要根据鱼的种类、水温等因素添加适量的NaCl量以延长其保活运输时间。故彭泽鲫夏季低温休眠保活运输的适宜NaCl添加量为0.2%。

不同字母表示各组试验结果存在显著性差异(P<0.05)图5 NaCl添加量对彭泽鲫保活时间的影响Figure 5 Effect of the addition amount of NaCl on survival time of Pengze crucian carp
2.4 彭泽鲫低温休眠保活工艺的优化
正交试验方案各因素水平见表2。在充纯氧保活,诱导休眠过程中31~20 ℃温度段以3 ℃/h的速率降温,20~7 ℃ 温度段以2 ℃/h的速率降温的条件下,选择保活温度、暂养时间、鱼水质量比、NaCl添加量4个对鲫鱼保活时间影响较大的单因素进行正交优化试验。正交试验结果见表3、4。由表3可知,影响彭泽鲫保活时间的各因素的主次顺序为:A>C>B>D。由表4可知,A因素的P值<0.05,表明保活温度对于彭泽鲫的保活时间的影响显著,而B、C、D等因素的P值<0.1,表明这些因素对彭泽鲫的保活时间有影响,但影响不显著,与正交试验结果分析一致;彭泽鲫夏季低温休眠保活运输的最优技术条件为A2B2C3D2,即选择健壮的彭泽鲫放在清水中停食暂养24 h,在31~20 ℃温度段采用3 ℃/h的降温速率,在20~7 ℃温度段采用2 ℃/h的速率梯度降温,按照1∶1的鱼水质量比加水装袋,添加0.3%的NaCl,充入纯氧密封,放在(13±1) ℃下保活。

表2 L9(34)正交试验因素水平表Table 2 L9(34) arrangement of orthogonal experiment
表3正交试验保活优化结果
Table 3 Orthogonal array design with experimental results for optimization of survival process
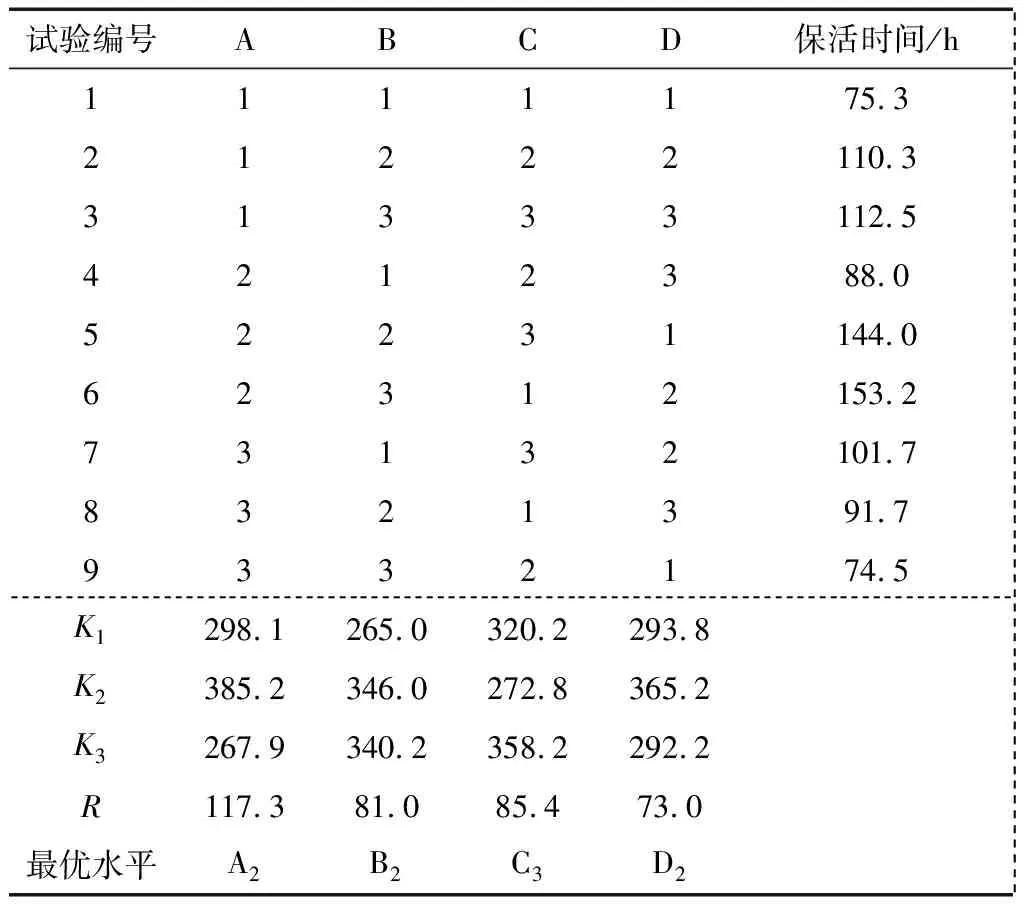
试验编号ABCD保活时间/h 1111175.3 21222110.3 31333112.5 4212388.0 52231144.0 62312153.2 73132101.7 8321391.7 9332174.5 K1298.1265.0320.2293.8 K2385.2346.0272.8365.2 K3267.9340.2358.2292.2 R117.381.085.473.0 最优水平A2B2C3D2
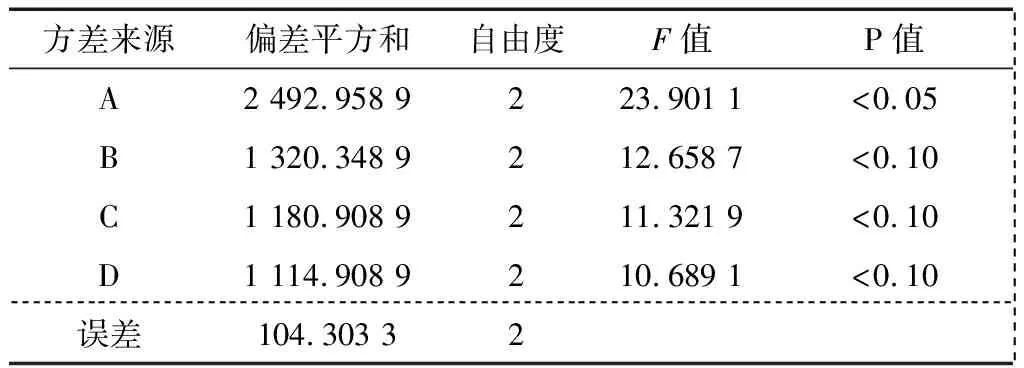
表4 正交试验方差分析†Table 4 Analysis of variance of orthogonal experimental results
† 查表得F0.01(2,2)=99;F0.05(2,2)=19;F0.1(2,2)=9。
2.5 正交结果验证实验
选取有活力,体表完整,规格一致的鲫鱼放在曝气自来水中停食暂养24 h,再加冰梯度降温诱导鲫鱼休眠,取出,按照鱼水质量比1∶1加水装袋,添加0.3%的NaCl,充纯氧密封放在(13±1) ℃条件下进行鲫鱼保活试验,结果鲫鱼的保活时间为148 h。虽然略短于正交试验中A2B3C1D2组合的保活时间(153.2 h),但是保活时间完全可以满足实际保活运输需要,且用水量减少了20%,降低了保活运输成本,提高了运输密度,因此,结合现实需求和经济效益,确定A2B2C3D2为彭泽鲫夏季低温休眠保活的最佳方案。
3 结论
低温保活是一种较为理想的淡水鱼保活方式,它可以有效提高活运的效率和时间,减少用水量,降低污染。通过单因素和正交试验得到的彭泽鲫夏季低温休眠最佳技术条件是:选择健壮的彭泽鲫放在曝气自来水中停食暂养24 h,在31~20 ℃温度段采用3 ℃/h的速率降温,20~7 ℃温度段采用2 ℃/h的速率梯度降温,按1∶1的鱼水质量比加水装袋,添加0.3%的NaCl,充入纯氧密封,放在(13±1) ℃的条件下保活,保活时间可达148 h。因此,该保活技术有助于降低鲫鱼的活运用水量,延长保活时间,避免鲫鱼夏季活运过程中因高温引起的鱼类高死亡率,对于衔接产销两地的市场及促进生鲜电商的发展都有积极意义,同时可为其他淡水鱼类在高温季节的保活运输提供技术借鉴。但是如何将保活技术应用于实际保活运输还需要更真实地模拟现实保活运输过程中颠簸对保活的影响程度。
[1] WU J H K, CAHILL L E, MOZAFFARIAN D. Effect of fish oil on circulating adiponectin: a systematic review and meta-analysis of randomized controlled trials[J]. Journal of Clinical Endocrinology & Metabolism, 2013, 98(6): 2 451-2 459.
[2] 蔡鑫, 陈洁, 陈永福. 2015—2035年中国水产品需求展望[J]. 农业展望, 2014, 10(1): 70-74.
[3] 农业部渔业渔政管理局. 中国渔业统计年鉴[Z]. 北京: 中国农业出版社, 2017: 1-25.
[4] 刘骁, 谢晶, 黄硕琳. 鱼类保活运输的研究进展[J]. 食品与发酵工业, 2015, 41(8): 255-260.
[5] PRAMOD P K, RAMACHANDRAN A, SAJEEVAN T P, et al. Comparative efficacy of MS-222 and benzocaine as anaesthetics under simulated transport conditions of a tropical ornamental fish Puntius filamentosus (Valenciennes)[J]. Aquaculture Research, 2010, 41(2): 309-314.
[6] 张玉晗, 谢晶. 鱼贝类生态冰温无水活运研究进展[J]. 渔业现代化, 2017, 44(2): 38-42.
[7] 白艳龙, 谭昭仪, 邸向乾, 等. 黄颡鱼无水保活技术研究[J]. 食品工业科技, 2013, 34(1): 334-337.
[8] 吴云辉, 邱松林, 蔡真珍, 等. 温度对黑鲷无水保活工艺的影响[J]. 热带生物学报, 2016, 7(3): 314-317.
[9] 徐中平. 星斑川鲽无水保活运输技术研究[J]. 科技创新导报, 2017(4): 75-76.
[10] 任红梅, 万玉芳, 李雪梅. 青虾无水低温保活运输初探[J]. 科学养鱼, 2015, 31(5): 50-51.
[11] 韩利英, 张慜. 鲫鱼保活条件对存活率的影响[J]. 食品与生物技术学报, 2009, 28(5): 642-646.
[12] 米红波. 鲫鱼和中国对虾的无水保活及冰温保鲜技术研究[D]. 杭州: 浙江大学, 2014: 19-29.
[13] 惠芸华, 蔡友琼, 于慧娟. 镇静类药物在活鱼运输中的应用研究进展[J]. 中国渔业质量与标准, 2014, 4(2): 39-43.
[14] GHAZILOU A, HASANKANDI H S, CHENARY F, et al. The anesthetic efficiency of clove oil in caspian salmon, salmo trutta caspius K., smolts in dosage-salinity-pH linked approach[J]. Journal of the World Aquaculture Society, 2010, 41(4): 655-660.
[15] 吴佳静, 杨悦, 许启军, 等. 水产品保活运输技术研究进展[J]. 农产品加工, 2016(8): 55-56.
[16] 聂小宝, 张玉晗, 孙小迪, 等. 活鱼运输的关键技术及其工艺方法[J]. 渔业现代化, 2014, 41(4): 34-39.
[17] DHANASIRI A K, FEMANDES J M, KIRON V. Acclimation of zebrafish to transport stress[J]. Zebrafish, 2013, 10(1): 87.
[18] 何蓉, 谢晶. 水产品保活技术研究现状和进展[J]. 食品与机械, 2012, 28(5): 243-246.
[19] 连凤英. 夏季青鱼活鱼的长途运输技术[J]. 河北渔业, 2002(1): 19-20.
[20] 饶毅, 陈文静, 丁立云, 等. 不同规格彭泽鲫肌肉营养成分及氨基酸组成分析[J]. 江西水产科技, 2016(3): 15-17.
[21] 陈盎弘, 许艳顺, 姜启兴, 等. 宰杀方式对冷冻斑点叉尾鮰品质的影响[J]. 现代食品科技, 2015, 31(9): 218-221.
[22] 牛景彦, 刘占才. 浅谈环境胁迫对鱼类生长性能的影响[J]. 福建农业, 2015(2): 124-124.
[23] 王利娟. 大口黑鲈保活运输的研究[D]. 上海: 上海海洋大学, 2015: 6-7.
[24] 吕飞, 陈灵君, 丁玉庭. 鱼类保活及运输方法的研究进展[J]. 食品研究与开发, 2012, 33(10): 225-228.
[25] KING H R, JONES B, TENSEN M C. Fish transport in the aquaculture sector: an overview of the road transport of Atlantic salmon in Tasmania[J]. Journal of Veterinary Behavior Clinical Applications & Research, 2009, 4(4): 163-168.
[26] SAMPAIO F D F, FREIRE C A. An overview of stress physiology of fish transport: changes in water quality as a function of transport duration[J]. Fish & Fisheries, 2016, 17(4): 1 055-1 072.
[27] 米红波, 侯晓荣, 茅林春. 鱼虾类保活运输的研究与应用进展[J]. 食品科学, 2013, 34(13): 365-369.
[28] LIM L C, DHERT P, SORGELOOS P. Recent developments and improvements in ornamental fish packaging systems for air transport[J]. Aquaculture Research, 2015, 34(11): 923-935.
[29] 覃川杰, 邵婷, 杨洁萍, 等. 饥饿胁迫对瓦氏黄颡鱼脂肪代谢的影响[J]. 水生生物学报, 2015, 39(1): 58-65.
[30] HARMON T S. Methods for reducing stressors and maintain-ing water quality associated with live fish transport in tanks: a review of the basics[J]. Reviews in Aquaculture, 2010, 1(1): 58-66.

