当归补血汤对糖尿病肾病大鼠PERK通路的影响*
沈 鑫,张思泉,张莹雯,柯浩亮,帅 瑜
(武汉大学附属中南医院,武汉 430071)
糖尿病肾病(DN)是糖尿病的一种严重并发症,是导致终末肾衰竭(ESRD)的主要原因之一[1]。近30年来,随着世界范围内糖尿病患者的增加,DN发病率也随之急剧提高[2]。DN发病机制复杂,涉及多种细胞因子和信号转导通路,包括糖代谢紊乱、氧化应激、血流动力学异常、细胞因子参与以及遗传因素等[3]。内质网应激(ERS)是近年来新发现的DN发病机制,被证实与DN关系密切[4-6]。本实验旨在探讨当归补血汤对DN大鼠GRP78-PERK-eIF2α通路的影响,为当归补血汤治疗DN提供新依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级雄性SD大鼠60只,6~8周龄,体质量180~210 g,均购自武汉大学实验动物中心[许可证号:SCXK(鄂)2014-0004]。饲养于武汉大学实验动物中心标准饲养房,室温(22±2)℃,相对湿度60%,每日光照12 h,实验期间不限饮食和饮水,定期更换敷料,连续观察8周。
1.1.2 实验药物 当归补血汤由当归、黄芪按1∶1配比(前期实验提示此为治疗DN最优配比),药物饮片购自湖北省中药材公司,当归、黄芪生药饮片浸水1 h,煮沸40 min,过滤后的药渣再次加水煮沸,重复2次,合并煎煮液,在水浴中浓缩,置4℃冰箱备用,按实验需要再行旋转蒸发浓缩备用。
1.1.3 主要仪器和试剂 超净工作台(苏净安泰),全自动生化分析仪(日本东芝公司),倒置光显微镜(Olympus日本),透射电子显微镜(日立公司),超薄切片机(瑞典Bromma公司),台式离心机(上海安亭科学仪器厂),PCR仪(杭州博日科技),电泳仪(北京市六一仪器厂),链脲佐菌素(STZ,美国Sigma公司,溶于 0.1 mol/L,pH=4.3 的柠檬酸钠缓冲液中);RIPA总蛋白裂解液、SDS-PAGE凝胶制备试剂盒、BCA蛋白质浓度测定试剂盒、ECL化学发光检测试剂盒(ASPEN)等。
1.2 方法
1.2.1 饲养条件 实验动物饲养于武汉大学实验动物中心标准饲养房,普通饲料和高脂饲料均由实验动物中心提供。室温20℃,相对湿度60%,每日光照12 h,实验前先适应性饲养1周,实验期间不限饮食和饮水,定期更换敷料,连续观察8周。
1.2.2 糖尿病大鼠的分组和造模 大鼠适应性饲养1周后,随机选取10只为对照组(n=10),喂普通饲料;其余大鼠为造模组(n=50)喂以高脂饲料,大鼠均不限饮食和饮水。1周后,将造模组大鼠禁食12h,并给予一次性腹腔注射STZ 30 mg/kg(溶于0.1 mmol/L,pH=4.3的柠檬酸钠缓冲液中),对照组给予相同剂量的柠檬酸钠缓冲液(0.1 mmol/L,pH=4.3)一次性腹腔注射,注射48 h后采足底静脉血,连续3 d测随机血糖,血糖≥16.7 μmol/L 视为糖尿病大鼠造模成功[7]。造模组成活且造模成功的大鼠共43只,随机选取40只纳入实验,随机分为模型组[n=10,生理盐水10 mL/(kg·d)],当归补血汤高剂量组[高剂量组,n=10,7.14 g/(kg·d)当归补血汤溶缩液],当归补血汤低剂量组[低剂量组,n=10,1.79 g/(kg·d)当归补血汤溶缩液],格列齐特组[n=10,2.68 mg/(kg·d)格列齐特缓释片],以上药物均通过灌胃方式给药,对照组(N组)给予生理盐水10 mL/(kg·d)灌胃给药,连续灌胃8周后取材。
1.2.3 一般情况及生化指标的检测 观察大鼠的精神、毛色、活动是否灵活、食量、饮水量、尿量等;实验第8周末,用代谢笼收集24 h尿液,记录尿量并于-80℃冰箱保存;所有大鼠禁食12 h,禁水8 h后,称量大鼠体质量,无菌条件下腹腔注射戊巴比妥(50 mg/kg)麻醉大鼠,腹主动脉采血,离心后取血清,全自动生化分析仪测大鼠空腹血糖(GLU)、甘油三酯(TG)、总胆固醇(TC)、肌酐(Scr)、尿素氮(BUN);无菌条件下摘取双肾。
1.2.4 光镜及电镜下观察肾组织 取小鼠肾组织用4%多聚甲醛固定,石蜡包埋,切片,将组织切片按常规方法进行过碘酸雪夫氏染色(PAS)染色,于光镜200倍视野下观察肾脏组织结构变化。另取肾皮质剪碎用1.25%戊二醛固定,用透射电镜观察肾脏超微结构。
1.2.5 免疫组化检测GRP78、PERK、eIF2α蛋白的表达 取小鼠肾组织于4%多聚甲醛溶液固定、石蜡包埋,将石蜡切片脱蜡至水后用EDTA缓冲液中微波修复,置于3%过氧化氢溶液中孵育,甩干后以5%BSA封闭,依次加入稀释的一抗、相应种属的二抗于保湿盒中孵育,滴加配制DAB,显微镜控制显色,中性树胶封固后用显微镜观察拍照。
1.2.6 PCR检测大鼠肾组织中GRP78 mRNA、PERK mRNA、eIF2α mRNA的表达 大鼠 GRP78、PERK、eIF2α 引 物 由 Invitrogen Biotechnology Co.,LTD.中国公司合成;总RNA的提取按试剂盒说明操作,用紫外分光光度计测量OD值并计算RNA浓度和质量;根据RNA的量,建立一个20 μL的反应体系,在RT-PCR仪器中进行逆转录反应:42℃30 min,80℃ 5 min,4℃冷却,-20℃保存,在 PCR仪上扩增;目的基因扩增用ΔΔCT法计算,A=CT(目的基因,实验样本)-CT(内标基因,实验样本),B=CT(目的基因,对照样本)-CT(内标基因,对照样本),K=A-B,表达倍数=2-K,采用 β-actin为内参,计算GRP78、PERK、eIF2α 的 CT值。
1.2.7 Western blot法检测 GRP78、PERK、eIF2α 蛋白的表达 每组随机选取两只大鼠的肾组织进行蛋白提取,检测蛋白浓度,保证每个样品总蛋白量。每个样品总蛋白上样量均为40 μg,进行制胶与上样,按浓缩胶80 V、分离胶120 V进行恒压电泳,按300 mA恒流转膜,转膜时间根据目的蛋白分子量大小调整,将转好的膜加入封闭液室温封闭1 h,加入已稀释好的一抗4℃过夜(兔属GAPDH,GRP78与5%脱脂牛奶呈 1∶2 000,PERK 与 5%BSA 呈 1∶1 000,eIF2α 与 5%BSA 呈 1∶2 000)用 TBST 洗 3次,每次5 min,加入稀释好的二抗(HRP-Goat anti Rabbit与5%脱脂牛奶呈 1∶10 000),室温孵育 30 min,用TBST在室温摇床上洗4次,每次5 min,暗室中曝光,将胶片进行扫描存档,AlphaEaseFC 4.0软件处理系统分析目标带的光密度值。
1.2.8 统计学方法 采用SPSS 20.0统计分析,计量资料以均数±标准差(±s)表示,组间用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 对照组大鼠体毛光泽,活动敏捷,饮食量、尿量无明显变化,实验第8周末,体质量均较前增加;大鼠造模成功率为86%(43/50),造模成功后的大鼠体质量较对照组明显减轻,每日饮水量及尿量均多于对照组;造模后第4天可见大鼠皮毛湿黄,活动迟缓,多饮、多食、多尿、体质量下降,至实验第8周末,模型组大鼠上述症状最明显,治疗组上述情况得到不同程度改善,以高剂量组改善最为明显。
2.2 生化指标的检测 与对照组相比,模型组大鼠血糖(GLU)、血脂(TG、TC)、尿素氮(BUN)、肌酐(Scr)及蛋白尿(MAU)均明显升高(P<0.01);与模型组相比,各治疗组的 GLU、TG、TC、BUN、Scr及 MAU均下降(P<0.01 或 P<0.05),3 个治疗组中,格列齐特组的GLU下降最显著(P<0.01),高剂量组BUN、Scr、MAU下降最明显(P<0.01),肾功能改善明显。见表 1、表 2。
表1 各组大鼠GLU、血脂的检测(±s)mmol/L

表1 各组大鼠GLU、血脂的检测(±s)mmol/L
注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与格列齐特组比较,△△P<0.01。
组别 n GLU TG TC对照组 10 5.07±0.61 1.13±0.10 0.83±0.10模型组 10 27.41±0.96## 4.14±0.12## 2.14±0.10##格列齐特组 10 9.92±0.52##** 2.26±0.11##** 1.27±0.10##**低剂量组 10 15.71±0.60##**△△ 3.91±0.18##**△△ 2.05±0.07##*△△高剂量组 10 11.72±0.69##**△△ 2.40±0.15##** 1.35±0.08##**
表2 各组大鼠BUN、Scr及MAU的检测(±s)
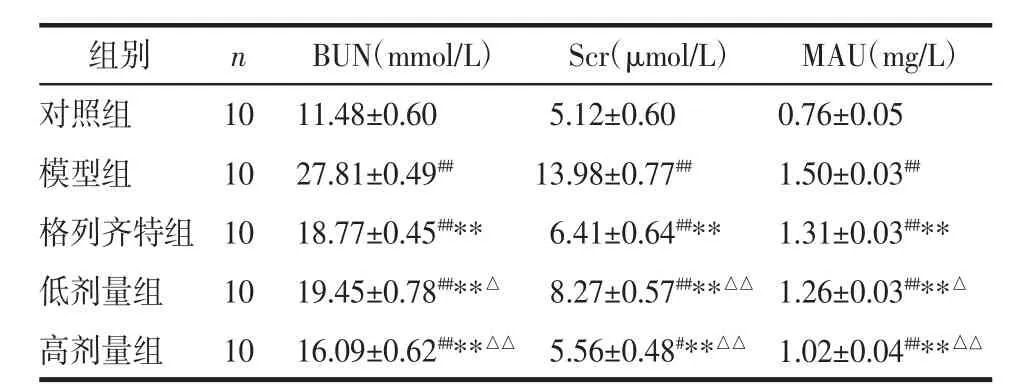
表2 各组大鼠BUN、Scr及MAU的检测(±s)
注:与对照组比较,##P<0.01;与模型组比较,**P<0.01;与格列齐特组比较,△P<0.05,△△P<0.01。
组别nBUN(mmol/L)Scr(μmol/L)MAU(mg/L)对照组 10 11.48±0.60 5.12±0.60 0.76±0.05模型组 10 27.81±0.49## 13.98±0.77## 1.50±0.03##格列齐特组 10 18.77±0.45##** 6.41±0.64##** 1.31±0.03##**低剂量组 10 19.45±0.78##**△ 8.27±0.57##**△△ 1.26±0.03##**△高剂量组 10 16.09±0.62##**△△ 5.56±0.48#**△△ 1.02±0.04##**△△
2.3 光镜及电镜下肾脏形态结构观察
2.3.1 光镜下肾脏形态结构 对照组大鼠肾组织结构完整。模型组大鼠肾组织严重损伤,可见系膜细胞增生、基质增多,肾小球基底膜(GBM)增厚,PAS染色呈强阳性,部分肾小球可见毛细血管间出现PAS染色阳性的层状结节及节段性透明样变性,提示肾小球硬化,肾小管上皮肿胀,肾小管管腔变窄。格列齐特组和低剂量组可见轻度弥漫性系膜区细胞增生伴GBM增厚,肾小管无明显改变。高剂量组肾结构改善明显,仅见肾小球轻度水肿,无增生性病变,肾小管无明显改变。见图1。
2.3.2 电镜下肾脏形态结构 对照组GBM厚度基本均匀适中,足细胞位于GBM外层,足突结构完整,呈栅栏状整齐排列。模型组GBM增厚,足细胞出现空泡改变,裂隙膜减少,足突融合,部分足细胞从GBM脱落,排列紊乱;肾小管上皮细胞肿胀变性,可见内质网、线粒体和细胞核肿胀。格列齐特组和低剂量组病变减轻,GBM轻度增厚,系膜基质轻度增多。高剂量组病变改善明显。见图2。
2.4 各组 GRP78、PERK、eIF2α的免疫组化结果 GRP78、PERK、eIF2α在对照组中有少量表达,表现为棕黄色颗粒,三者主要定位在肾小管上皮细胞胞浆内;模型组的 GRP78、PERK、eIF2α 表达较对照组明显增多,差异具有统计学意义(P<0.01),三者主要定位于肾小管;高剂量组、低剂量组与格列齐特组的GRP78、PERK、eIF2α表达均明显低于模型组(P<0.01),高剂量组相比于格列齐特组表达更低(P<0.01 或 P<0.05)。见表 3 及图 3-5。
表3 各组GRP78、PERK、eIF2α的蛋白表达情况(±s)
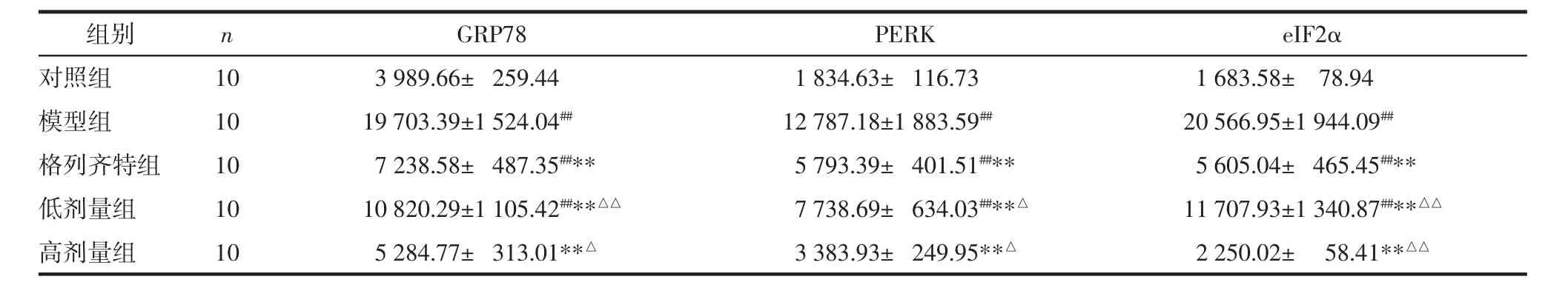
表3 各组GRP78、PERK、eIF2α的蛋白表达情况(±s)
注:与对照组比较,##P<0.01;与模型组比较,**P<0.01;与格列齐特组比较,△P<0.05,△△P<0.01。
组别 n GRP78 PERK eIF2α对照组 10 3 989.66± 259.44 1 834.63± 116.73 1 683.58± 78.94模型组 10 19 703.39±1 524.04## 12 787.18±1 883.59## 20 566.95±1 944.09##格列齐特组 10 7 238.58± 487.35##** 5 793.39± 401.51##** 5 605.04± 465.45##**低剂量组 10 10 820.29±1 105.42##**△△ 7 738.69± 634.03##**△ 11 707.93±1 340.87##**△△高剂量组 10 5 284.77± 313.01**△ 3 383.93± 249.95**△ 2 250.02± 58.41**△△
2.5 各组GRP78、PERK、eIF2α的mRNA表达情况GRP78、PERK、eIF2α在正常肾组织中有一定量的表达,相比于对照组,模型组大鼠GRP78、PERK、eIF2α 的表达显著增高,差异具有统计学意义(P<0.01)。相比于模型组,3个治疗组的 GRP78、PERK、eIF2α的表达均降低,差异具有统计学意义(P<0.01)。相比于格列齐特组,高剂量组的GRP78、PERK、eIF2α的表达更低(P<0.01 或 P<0.05)。见表 4。
2.6 Western blot测 GRP78、PERK、eIF2α 的蛋白表达 相比于对照组,模型组大鼠GRP78、PERK、eIF2α的蛋白表达显著增高,差异具有统计学意义(P<0.01);相比于模型组,各治疗组的GRP78、PERK、eIF2α的表达均降低,差异具有统计学意义(P<0.01);相比于格列齐特组,高剂量组的GRP78、PERK、eIF2α的表达更低(P<0.01 或 P<0.05),见表 5 及图 6。
3 讨论
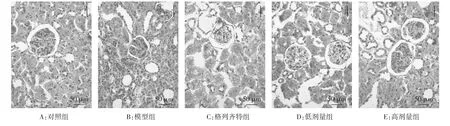
图1 各组大鼠肾组织PAS染色结果(×200)

图2 各组大鼠肾组织电镜下观察结果(×2 000)

图3 免疫组化检测GRP78蛋白表达结果(×200)
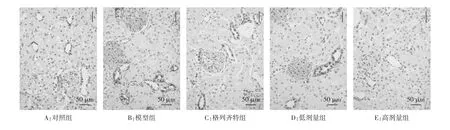
图4 免疫组化检测PERK蛋白表达结果(×200)
DN在中医学归为消渴病下消,基本病机为“气血两虚兼血瘀”。当归补血汤中黄芪味甘温,可益气固表,补气升阳;当归味甘辛温,可补血生血行血,两者配伍则阳生阴长,气旺血生,具有补气活血之功效,与其病机契合。现代研究发现,黄芪甲苷(IV)可通过下调PERK-ATF4-CHOP通路发挥抑制足细胞凋亡,保护肾组织,防治DN的作用[8]。且当归与黄芪配伍,当归可增强黄芪中黄芪甲苷在体内的活力,并可使黄芪甲苷达峰时间提前1倍[tmax由(4.00±1.54)h 至(2.00±0.95)h],达峰浓度提高 1 倍[Cmax由(60±7)μg/L 到(146±27)μg/L],加速黄芪甲苷发挥功效的进程[9]。当归补血汤可抑制高糖条件下肾小球细胞膜外基质蛋白表达[10],下调多个靶器官相关蛋白因子(BMP-7、TGF、HPA 等),具有预防和治疗早期DN的作用[11-13]。
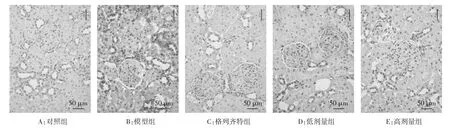
图5 免疫组化检测eIF2α蛋白表达结果(×200)
表 4 各组 GRP78、PERK、eIF2α 的 mRNA 表达(±s)
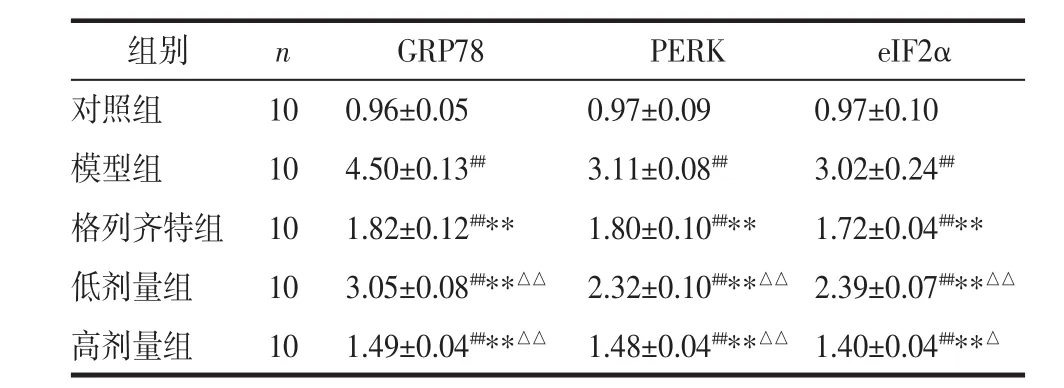
表 4 各组 GRP78、PERK、eIF2α 的 mRNA 表达(±s)
注:与对照组比较,##P<0.01;与模型组比较,**P<0.01;与格列齐特组比较,△P<0.05,△△P<0.01。
组别 n GRP78 PERK eIF2α对照组 10 0.96±0.05 0.97±0.09 0.97±0.10模型组 10 4.50±0.13## 3.11±0.08## 3.02±0.24##格列齐特组 10 1.82±0.12##** 1.80±0.10##** 1.72±0.04##**低剂量组 10 3.05±0.08##**△△ 2.32±0.10##**△△ 2.39±0.07##**△△高剂量组 10 1.49±0.04##**△△ 1.48±0.04##**△△ 1.40±0.04##**△
表 5 各组 GRP78、PERK、eIF2α 的蛋白表达(±s)
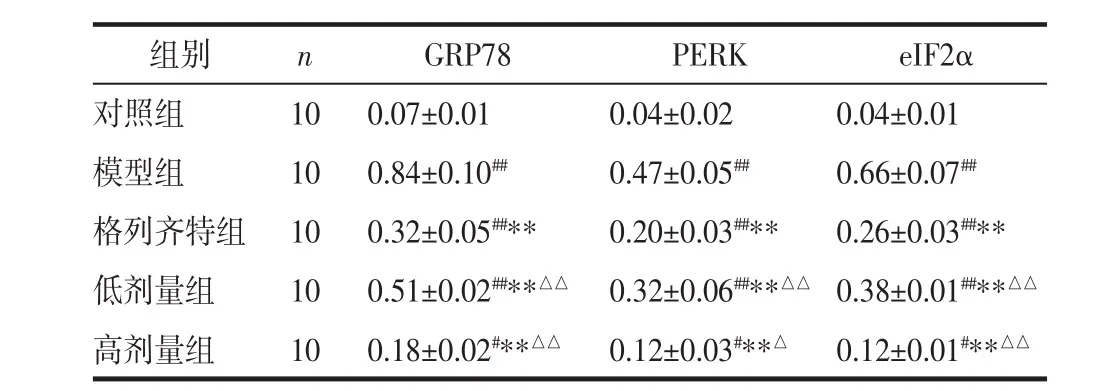
表 5 各组 GRP78、PERK、eIF2α 的蛋白表达(±s)
注:与对照组比较,#P<0.05,##P<0.01;与模型组比较,**P<0.01;与格列齐特组比较,△P<0.05,△△P<0.01。
组别 n GRP78 PERK eIF2α对照组 10 0.07±0.01 0.04±0.02 0.04±0.01模型组 10 0.84±0.10## 0.47±0.05## 0.66±0.07##格列齐特组 10 0.32±0.05##** 0.20±0.03##** 0.26±0.03##**低剂量组 10 0.51±0.02##**△△ 0.32±0.06##**△△ 0.38±0.01##**△△高剂量组 10 0.18±0.02#**△△ 0.12±0.03#**△ 0.12±0.01#**△△
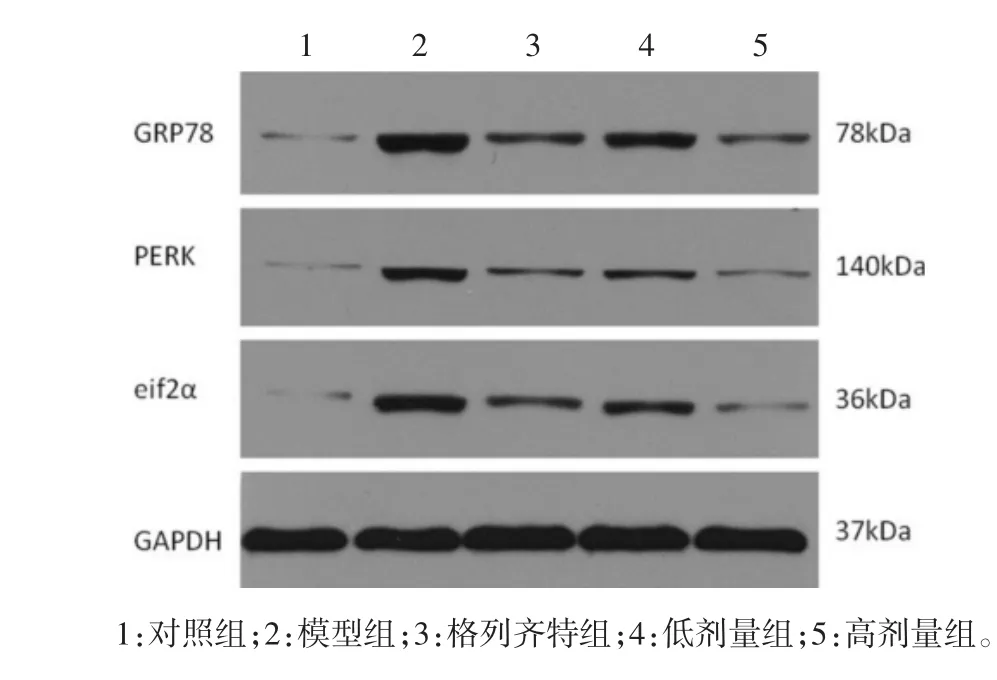
图6 Western-blot电泳条带图
本实验中,当归补血汤和格列齐特均可改善DN大鼠的一般情况,降低血糖、血脂,而且在降低尿蛋白,改善肾功能和肾脏结构损害方面,当归补血汤优于格列齐特。免疫组化、Western Blot及PCR显示模型组大鼠GRP78、PERK、eIF2α的表达明显高于对照组,表明ERS已经激活;当归补血汤治疗组大鼠肾组织中GRP78、PERK、eIF2α的表达相比于模型组明显下降,高剂量组下降更明显。实验表明当归补血汤可抑制PERK通路相关蛋白,缓解ERS,具有保护肾组织结构和肾功能作用,且呈浓度依赖性。
实验结果为临床治疗DN提供了新的依据。但仍存在问题需进一步探究,当归补血汤具体作用于PERK通路的机制尚不明确,推测当归补血汤可通过抑制PERK通路进一步抑制eIF2α下游的ATF4、CHOP、Capase12等凋亡相关基因缓解ERS造成的损害,是否激活了下游其他分子通路,还需更深入的研究。
[1]Packham DK,Alves TP,Dwyer JP,et al.Relative incidence of ESRD versus cardiovascular mortality in proteinuric type 2 diabetes and nephropathy:results from the DIAMETRIC(Diabetes Mellitus Treatment for Renal Insufficiency Con-sortium)database[J].Am J Kidney Dis,2012,59(1):75-83.
[2]Finucane MM,Stevens GA,Cowan MJ,et al.National,regional,and global trends in body-mass index since 1980:systematic analysis of health examination surveys and epidemiological studies with 960 country-years and 9.1 million participants[J].Lancet,2011,377(9765):557-567.
[3]李敏州,高彦彬,马鸣飞,等.糖尿病肾病发病机制研究进展[J].中国实验方剂学杂志,2012,18(22):344-349.
[4]Qi W,Mu J,Luo ZF,et al.Attenuation of diabetic nephropathy in diabetes rats induced by streptozotocin by regulating the endoplasmic reticulum stress inflammatory response[J].Metabolism,2011,60(5):594-603.
[5]Taniguchi M,Yoshida H.Endoplasmic reticulum stress in kidney function and disease[J].Curr Opin Nephrol Hypertens,2015,24(4):345-350.
[6]Ma JH,Wang JJ,Zhang SX.The unfolded protein response and diabetic retinopathy[J].J Diabetes Res,2014:160140-160153.
[7]李玉山,刘丽秋.实验性2型糖尿病肾病大鼠模型研究[J].中国实验诊断学,2009,13(5):574-577.
[8]Chen Y,Gui D,Chen J,et al.Down-regulation of PERKATF4-CHOP pathway by Astragaloside IV is associated with the inhibition of endoplasmic reticulum stress-induced podocyte apoptosis in diabetic rats[J].Cell Physiol Biochem,2014,33(6):1975-1987.
[9]王文萍,曹琦琛,王华伟,等.当归补血汤不同配伍的药动学研究[J].中国临床药理学与治疗学,2009,14(6):659-663.
[10]Ke HL,Zhang YW,Zhou BF,et al.Effects of Danggui Buxue Tang,a traditional Chinese herbal decoction,on high glucose-induced proliferation and expression of extracellular matrix proteins in glomerular mesangial cells[J].Nat Prod Res,2012,26(11):1022-1026.
[11]任小旦,张莹雯.黄芪、当归及其复方治疗糖尿病肾病的研究进展[J].中华中医药学刊,2015,33(10):2318-2320.
[12]Fan Y,Lee K,Wang N,et al.The Role of endoplasmic reticulum stress in diabetic nephropathy[J].Curr Diab Rep,2017,17(3):17-23.
[13]Cunard R,Sharma K.The endoplasmic reticulum stress response and diabetic kidney disease[J].Am J Physiol Renal Physiol,2011,300(5):F1054-F1061.

