干酪乳杆菌SY13及其合生元对小鼠肠道中Akkermansia muciniphila丰度的影响
提盼盼,汪建明,*,逄晓阳,吕加平
(1.天津科技大学食品工程与生物技术学院,天津 300457;2.中国农业科学院农产品加工研究所,北京 100193)
Akkermansiamuciniphila是一种肠道厌氧菌,疣微菌门,革兰氏阴性,无鞭毛,不产芽孢,最适生长温度37 ℃,最适pH是6.5[1],有研究发现该菌与严格厌氧菌相比,具有一定的耐氧性[2-3]。该菌早在2004年就被发现,但一直没有研究其在肠道内的功能和作用,直到2013年发现,该菌在肠道内的丰度与宿主肥胖症、Ⅱ型糖尿病[4]有明显的负相关关系,这引起了学界对该菌的极大关注。随着研究的深入,逐渐发现该菌与人类的炎症性肠病[5]、克罗恩病[6]、阑尾炎[7]、自闭症[8-10]、葡萄糖不耐症[11]、动脉粥样硬化[12]等很多慢性代谢性疾病都有密切关系,甚至能抑制肠道肿瘤的形成[13],该菌已成为研究热点。
国外对Akkermansiamuciniphila研究较早,已获得大量数据,如它在人体肠道中的丰度随年龄增长而变化,在老龄人群中的丰度显著降低[14];该菌能够缓解酒精性脂肪肝[15];与正常非肥胖小鼠相比,肥胖小鼠肠道中Akkermansiamuciniphila的含量很低[16],与健康小鼠相比,Ⅱ型糖尿病小鼠体内Akkermansiamuciniphila的含量也较低[17]等一系列研究。但是国内对Akkermansiamuciniphila的研究却很少,对于该菌的动物实验研究少之又少,处于一种起步研究阶段。
直接服用Akkermansiamuciniphila来预防和治疗慢性代谢疾病是一种简单、直接的方法,但是由于目前的法律法规限制,无法产业应用,因此现阶段围绕Akkermansiamuciniphila的研究重点大多集中在寻找能够促进该菌生长,且可食用的益生菌或益生元,通过益生菌或益生元提高肠道中Akkermansiamuciniphila的丰度,改善机体的健康状况,这是目前产业化应用的一条有效途径。本团队前期通过大量实验筛选出了体外能够促进Akkermansiamuciniphila生长的刺激因子,但生长刺激因子进入宿主肠道后,是否对该菌有较好的刺激作用是一直关注的问题。
干酪乳杆菌SY13(LactobacilluscaseiSY13)属于乳杆菌属,革兰氏阳性,不产芽孢,不运动,最适生长温度37 ℃。该菌分离自我国牧区传统发酵乳制品,具有较强的抗氧化和肠道粘附能力[18]。研究已证实,粘附在肠道粘膜上的乳酸菌能够通过自身代谢产生一些生物活性物质来调节肠道菌群,抑制有害菌及外源致病菌的生长,为肠道有益菌营造一个健康的生长环境[19]。干酪乳杆菌SY13进入肠道后具有较强的肠粘膜黏附能力,但SY13是否能够刺激肠粘膜上Akkermansiamuciniphila的生长是一个值得关注的问题。本研究将干酪乳杆菌及其与益生元组成的合生元进行小鼠饲喂实验,利用荧光定量PCR检测小鼠肠道内Akkermansiamuciniphila的丰度变化,筛选能够刺激Akkermansiamuciniphila生长的最佳组合,为后续通过口服益生菌或合生元来调节肠道菌群,最终实现预防或治疗肥胖、Ⅱ型糖尿病等慢性代谢性疾病奠定基础。
1 材料与方法
1.1 材料与仪器
SPF级BALB/c雄性小鼠 北京维通利华实验动物技术有限公司,动物许可号为:SCXK(京)2016-0011;干酪乳杆菌SY13 中国农业科学院农产品加工研究所食品微生物实验室;Akkermansiamuciniphila(菌株编号:ATCC BAA-835)ATCC美国菌种保藏中心;大肠杆菌 DH5α感受态细胞 北京全式金生物技术有限公司;乳果糖 上海源叶生物技术有限公司,纯度99%;低聚果糖 上海源叶生物技术有限公司,纯度98%;TransStart® Probe qPCR SuperMix 北京全式金生物技术有限公司;TIANamp Stool DNA Kit(DP328) 天根生化科技(北京)有限公司;MRS肉汤(CM187) 北京陆桥技术股份有限公司;NaCl(AR) 国药集团化学试剂有限公司。
DK-S24型电热恒温水浴锅 上海森信实验仪器有限公司;LDZX-50KB型 立式压力蒸汽灭菌器上海申安医疗器械厂;HDL型超净工作台 北京东联哈尔仪器制造有限公司;3K15型离心机 德国Sigma公司;TP600型PCR仪 宝生物工程(大连)有限公司;荧光定量PCR仪(7500) 美国ABI公司;DYY-6C型电泳仪 北京市六一仪器厂;DHP-9082型电热恒温培养箱 上海一恒科技有限公司;MB-102振荡型恒温金属浴 杭州博日科技有限公司;多功能酶标仪(SPARK 20M) 帝肯(上海)贸易有限公司。
1.2 实验方法
1.2.1 益生菌及合生元的制备
1.2.1.1 干酪乳杆菌SY13菌粉的制备 冻干保护剂的选用参考曾小群等[20]的研究,本文采用真空冷冻干燥法来冻干菌粉,保护剂选用10%的脱脂乳添加终浓度为0.1%的谷氨酸钠,灭菌备用。
在离心洗涤干净的菌沉淀中加入冻干保护剂,混匀后在-80 ℃冰箱中预冻4~6 h,最后在冷阱温度-57 ℃,真空度为15.3 Pa条件下,真空冷冻干燥24 h。
1.2.1.2 合生元的制备 将制备好的SY13菌粉用无菌水进行溶解,得到SY13的活菌数为3.3×109cfu/mL的SY13制剂;将SY13菌粉用无菌水溶解,再加入低聚果糖或者乳果糖的无菌溶液,得到SY13活菌数为3.3×109cfu/mL、低聚果糖浓度为50 mg/mL SY13的低聚果糖合生元,以及SY13活菌数为3.3×109cfu/mL、乳果糖浓度为50 mg/mL的SY13乳果糖合生元。
1.2.2 计算干酪乳杆菌SY13活菌数 活菌计数参考GB 4789.2-2016[21]。将冻干的SY13菌粉于MRS肉汤培养基中37 ℃活化培养48 h,将活化好的菌液用0.85%的无菌生理盐水倍比稀释到10-8,每个MRS平皿涂布1 mL稀释菌液,每个稀释度三个重复,平皿倒置在37 ℃的培养箱中培养40~48 h,然后进行平板计数,计算出SY13所制得的菌粉活菌数。
1.2.3 实验动物分组及肠道内容物基因组提取方法
1.2.3.1 实验动物分组 饲喂方式采用灌胃法。8周龄小鼠和9个月龄小鼠各96只,实验分为AP组、AO组、BP组、BO组,每组48只。每个实验组又分为对照组,记为1;干酪乳杆菌SY13组,记为2;SY13低聚果糖组,记为3;SY13乳果糖组,记为4,每组12只。在灌胃之前,小鼠自由饮水与采食,以适应环境,7 d后,进行灌胃实验,分组情况见表1。

表1 小鼠分组
1.2.3.2 肠道内容物基因组提取方法 在灌胃结束后的第1、3、5、7 d处死小鼠,每次每组处死3只,快速收集小鼠的空肠、回肠、盲肠、结肠,放在2 mL的冻存管,置于液氮中保存。
应用天根试剂盒TIANamp Stool DNA Kit(DP328)对小鼠各肠道内容物进行提取基因组实验。具体步骤参照贾子阳[22]肠道内容物基因组提取方法。提取出的DNA保存在-20 ℃备用,作为后续的实时荧光定量PCR模板使用。
1.2.4 荧光定量PCR检测Akkermansiamuciniphila方法的建立
1.2.4.1 引物和TaqMan-TAMRA探针设计 用Beacon Designer 7.0进行引物和探针的设计,设计出的引物命名为:上游引物06678F;下游引物06678R;TaqMan-TAMRA探针命名为06678P。引物和探针于北京华大基因合成。
1.2.4.2 TaqMan TAMRA探针RT-PCR反应条件 荧光定量PCR反应总体积为20 μL,由1 μL上游引物06678F(10 pmol),1 μL下游引物06678R(10 pmol),1 μL TaqMan-TAMRA探针06678P(10 pmol),1 μL模板DNA,10 μL的2×(ABI的mix:TaqMan® Universal PCR Master Mix(Applied Biosystems,USA))Transtart@Probe qPCR SuperMix和6 μL无菌双蒸水。TaqMan TAMRA探针RT-PCR的反应程序包括酶激活阶段50 ℃ 2 min,95 ℃预变性10 min,95 ℃变性15 s,62 ℃退火1 min,72 ℃延伸60 s,40个循环。在退火阶段采集荧光信号,以CT值表示最后结果。
CT值越小,对应循环数越低,说明样品中的模板DNA含量就越高,CT值与样品中的模板DNA含量呈负相关。一般情况下,CT值大于36就可以说明样品中的目的DNA含量微乎其微,可以忽略不计[23]。
1.2.5 小鼠肠道样品的分析
1.2.5.1 合生元对小鼠肠道中Akkermansiamuciniphila的影响 取小鼠灌胃结束后第1 d的空肠、回肠、盲肠、结肠,提取肠道内容物的基因组,进行实时荧光定量PCR,对PCR结果进行分析,根据SY13及其合生元对单次灌胃下青年鼠、单次灌胃下老年鼠、长期灌胃下青年鼠、长期灌胃下老年鼠四组数据的分析,得出对小鼠肠道中Akkermansiamuciniphila生长刺激效果最好的灌胃组合。
1.2.5.2 灌胃时间对小鼠肠道中Akkermansiamuciniphila的影响 取小鼠灌胃结束后第1 d的空肠、回肠、盲肠、结肠,提取肠道内容物的基因组,以肠道内容物基因组为模板进行实时物荧光定量PCR,对PCR的结果进行分析,根据对单次灌胃下与长期灌胃下的PCR结果分析,得出灌胃时间对小鼠肠道中Akkermansiamuciniphila的刺激效果。
1.2.5.3 年龄对小鼠肠道中Akkermansiamuciniphila的影响 取小鼠灌胃结束后第1 d的空肠、回肠、盲肠、结肠,提取肠道内容物基因组,以肠道内容物基因组为模板进行实时荧光定量PCR,对PCR结果进行分析,根据对青年鼠与老年鼠的PCR结果分析,得出年龄对小鼠肠道中Akkermansiamuciniphila丰度的影响。
1.2.5.4 小鼠肠道中Akkermansiamuciniphila的保留时间 由Derrien等[24]的研究可知,小鼠盲肠中Akkermansiamuciniphila的含量要多余其他部位,故以小鼠盲肠为例,取小鼠灌胃结束后第1、3、5、7 d的小鼠盲肠,提取盲肠内容物基因组,以提取的基因组为模板进行实时荧光定量,对PCR结果进行分析,根据灌胃结束后的不同时间内Akkermansiamuciniphila在肠道中丰度的变化,找到影响Akkermansiamuciniphila在肠道中保留时间的因素。
1.3 数据处理
差异显著性分析采用Statistix 8.1软件进行数据处理分析,文中的图表均是用Origin 8.0进行分析作图。
2 结果与分析
2.1 引物和探针
用Beacon Designer 7.0设计出引物与探针。引物和探针序列见表3,通用的测序引物为M13-47和M13-48。
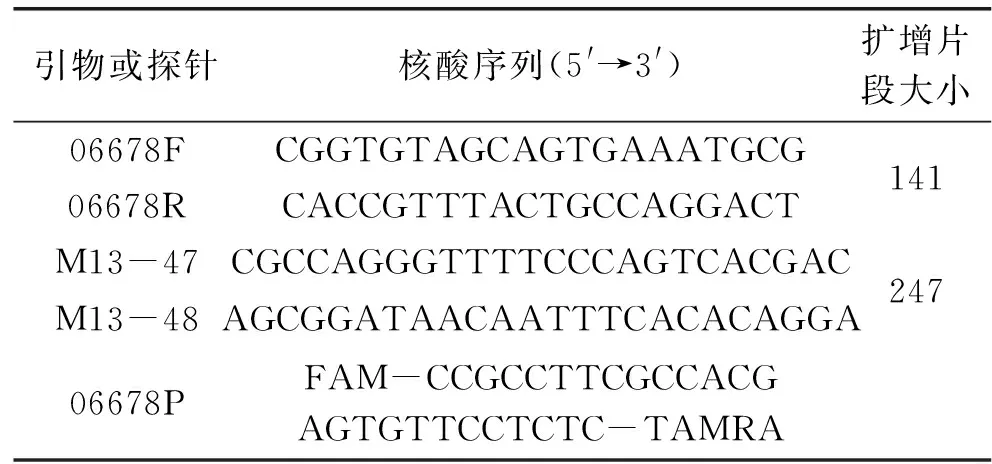
表2 扩增引物和Taqman-TAMRA 探针
2.2 Akkermansia muciniphila丰度的变化规律
2.2.1 合生元对小鼠肠道中Akkermansiamuciniphila的影响
2.2.1.1 单次灌胃合生元对青年小鼠肠道中Akkermansiamuciniphila的影响 由表3可知,AP1组未检出荧光信号,即循环数达到设定最大CT值40时,仍未检测到荧光信号,说明模板中没有Akkermansiamuciniphila的DNA,AP2组与AP3组的之间没有显著性差异(p>0.05),而均与AP4组有显著性差异(p<0.05),且AP4组的CT值显著低于其他组(p<0.05)。有研究表明,乳果糖在人体中不易被消化吸收,但能在肠道菌群的作用下分解成小分子的有机酸[25],这些有机酸也许是Akkermansiamuciniphila生长所需的营养物质。结果表明,SY13、SY13低聚果糖、SY13乳果糖均能提高青年小鼠肠道中Akkermansiamuciniphila的丰度,以SY13乳果糖的效果最为显著(p<0.05),说明SY13乳果糖对青年小鼠肠道中Akkermansiamuciniphila生长的刺激效果最佳。
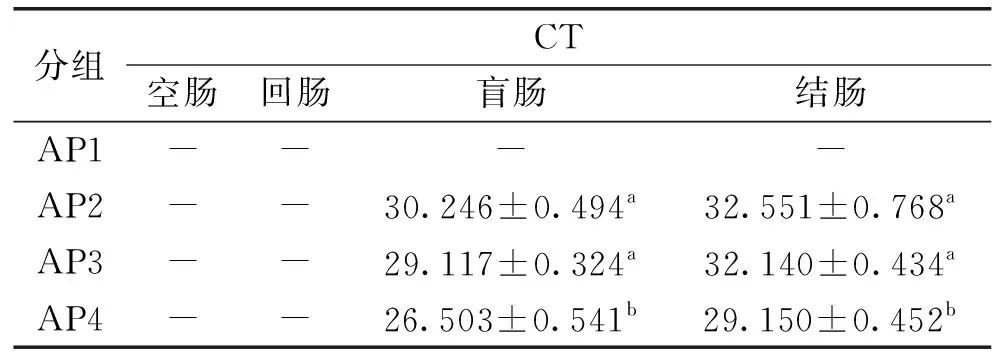
表3 单次灌胃合生元的青年小鼠肠道中Akkermansia muciniphila的分布
2.2.1.2 单次灌胃合生元对老年小鼠肠道中Akkermansiamuciniphila的影响 由表4可知,AO1组未检出荧光信号,说明CT值大于等于40,说明模板中没有Akkermansiamuciniphila的DNA,AO2组与AO3组的之间没有显著性差异,但是却均与AO4组有显著性差异(p<0.05),且AO4组的CT值显著低于其他组(p<0.05),实验结果同表3中的青年小鼠结果趋势一致。结果表明SY13、SY13低聚果糖、SY13乳果糖均能提高青年小鼠肠道中Akkermansiamuciniphila的丰度,以SY13乳果糖的效果最为显著,说明合生元中SY13乳果糖对老年小鼠肠道中Akkermansiamuciniphila丰度的提高效果最佳。
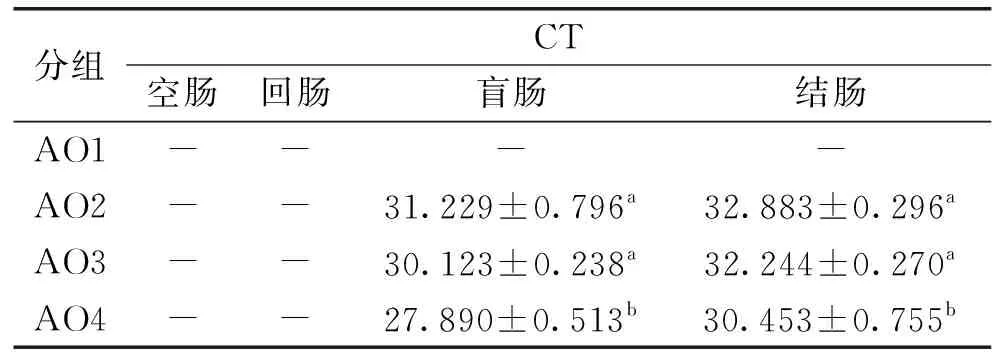
表4 单次灌胃合生元的老年小鼠肠道中Akkermansia muciniphila的分布
2.2.1.3 长期灌胃合生元对青年小鼠肠道中Akkermansiamuciniphila的影响 由表5可知,BP1组未检出荧光信号,说明CT值大于等于40,模板中Akkermansiamuciniphila的DNA可忽略不计,盲肠内容物基因组的CT值,BP2组与BP3组的之间没有显著性差异(p>0.05),但是却均与BP4组有显著性差异(p<0.05);结肠内容物基因组CT值,BP3组与BP2组和BP4组均无显著性差异(p>0.05),但BP2组与BP4组有显著性差异(p<0.05),且BP4组的CT值显著低于其他组(p<0.05)。结果表明SY13、SY13低聚果糖、SY13乳果糖均能提高青年小鼠肠道中Akkermansiamuciniphila的丰度,以SY13乳果糖的效果最为显著,说明SY13乳果糖对青年小鼠肠道中Akkermansiamuciniphila丰度的提高效果最佳。
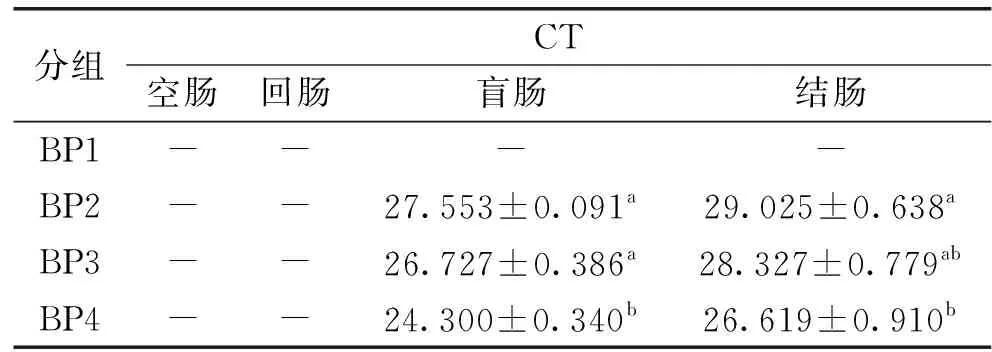
表5 长期灌胃合生元的青年小鼠肠道中Akkermansia muciniphila的分布
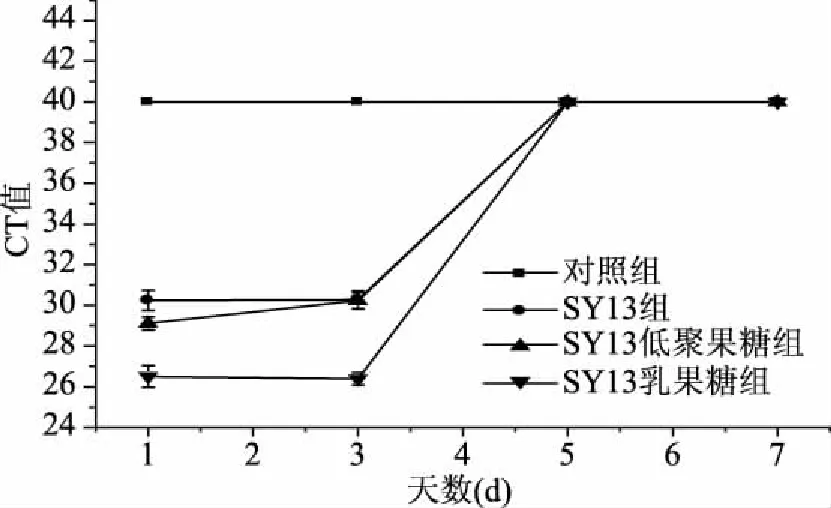
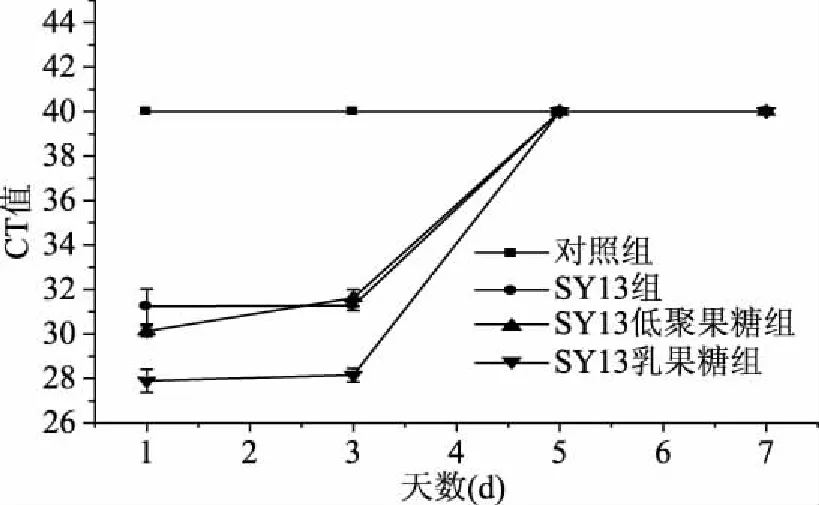
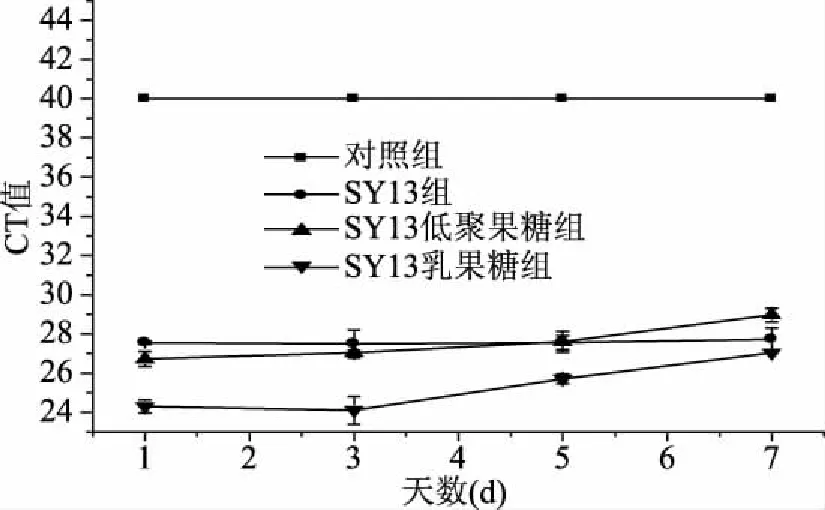
2.2.1.4 长期灌胃合生元对老年小鼠肠道中Akkermansiamuciniphila的影响 由表6可知,BO1组未检出荧光信号,说明CT值大于等于40,此时模板中Akkermansiamuciniphila的DNA含量很低,可忽略不计,盲肠内容物基因组的CT值,BO2组与BO3组的没有显著性差异(p>0.05),但均与BO4组有显著性差异(p<0.05);结肠内容物基因组的CT值,BO3组与BO4组没有显著性差异(p>0.05),但是均与BO2组有显著性差异(p<0.05)。结果表明,SY13、SY13低聚果糖、SY13乳果糖均能提高老年小鼠肠道中Akkermansiamuciniphila的丰度,CT值是SY13组>SY13低聚果糖组>SY13乳果糖组,故Akkermansiamuciniphila的丰度是SY13组 表6 长期灌胃合生元的老年小鼠肠道中Akkermansia muciniphila的分布 由表3~表6可知,无论是青年小鼠还是老年小鼠,单次灌胃还是长期灌胃,SY13及其合生元中对小鼠肠道中Akkermansiamuciniphila生长刺激效果最好的均是SY13乳果糖。 2.2.2 年龄对小鼠肠道中Akkermansiamuciniphila丰度的影响 由表3和表4可知,单次灌胃下,青年组的CT值显著低于老年组(p<0.05),同样,由表5和表6可知,长期灌胃下,青年组的CT值显著低于老年组(p<0.05),说明年龄对Akkermansiamuciniphila丰度的影响也较大,鼠龄越低,Akkermansiamuciniphila的丰度越高。 2.2.3 灌胃时间对小鼠肠道中Akkermansiamuciniphila丰度的影响 由表3和表5可知,单次灌胃下的青年鼠和长期灌胃下的青年鼠CT值有显著性的差异(p<0.05),同理,由表4和表6可知,单次灌胃下的老年鼠和长期灌胃下的老年鼠CT值有显著性的差异(p<0.05),说明灌胃时间对肠道内Akkermansiamuciniphila丰度的影响很大,灌胃时间越长,小鼠肠道内Akkermansiamuciniphila的丰度越高。 2.2.4 合生元处理下Akkermansiamuciniphila在小鼠盲肠中保留时间的变化 2.2.4.1 单次灌胃下青年小鼠盲肠中Akkermansiamuciniphila丰度随时间的变化 由图1可知,对照组在灌胃结束后的第1、3、5、7 d的CT值均大于等于40(CT值≥40,为了在图中显示出对照组数据,统一将未检测出荧光值标记为CT值为40,图2、图3、图4同图1),SY13及其合生元组的CT值在前3 d呈缓慢上升趋势,到第5 d达到和对照组相同的CT值,说明在灌胃结束后的3 d内均能检测到Akkermansiamuciniphila的存在,且CT值是SY13乳果糖组 图1 单次灌胃停止后青年小鼠盲肠中Akkermansia muciniphila随时间的变化 2.2.4.2 单次灌胃下老年小鼠肠道中Akkermansiamuciniphila保留时间的变化 由图2可知,单次灌胃下老年小鼠盲肠Akkermansiamuciniphila与单次灌胃下青年小鼠趋势一致,对照组在灌胃结束后的第1、3、5、7 d的CT值均大于等于40,SY13及其合生元组的CT值在前3 d呈缓慢上升趋势,直到第5 d达到和对照组相同的CT值,说明在停止灌胃后的第5 d时Akkermansiamuciniphila丰度又降低到检测不到的水平。结果表明,单次灌胃下,SY13乳果糖组对老年小鼠肠道Akkermansiamuciniphila的生长促进效果最佳,但是Akkermansiamuciniphila只有在停止灌胃小于5 d内能被检测到。 图2 单次灌胃停止后老年小鼠盲肠中Akkermansia muciniphila随时间的变化 2.2.4.3 长期灌胃下青年小鼠盲肠中Akkermansiamuciniphila保留时间的变化 由图3可知,对照组在灌胃结束后的第1、3、5、7 d的CT值均大于等于40,SY13及其合生元组的CT值呈缓慢上升趋势,第7 d仍能检测到Akkermansiamuciniphila的存在,前3 d的SY13组CT值略高于SY13低聚果糖组,但是在第5 d两组的CT值几乎达到相同的水平,第7 d时SY13组的CT值略低于SY13低聚果糖组,此过程中SY13乳果糖组始终低于其他组,到第7 d时三组水平接近。可能是由于灌胃时SY13与低聚果糖组合及SY13乳果糖组合对Akkermansiamuciniphila的促进效果要强于SY13单独作用,在停止灌胃后,低聚果糖及乳果糖水平急剧下降,Akkermansiamuciniphila能利用的只剩之前灌胃的SY13的作用,故三组水平趋于一致,至于SY13乳果糖组CT值明显低于其他两组可能是由于乳果糖对Akkermansiamuciniphila的生长促进效果比低聚果糖好。结果表明,长期灌胃下,SY13乳果糖组对青年小鼠肠道Akkermansiamuciniphila的生长促进效果最佳,其次是SY13低聚果糖组和SY13组,但是随着时间的推移,三组水平逐渐趋于SY13组水平。 图3 长时间灌胃停止后青年小鼠盲肠中Akkermansia muciniphila随时间的变化 2.2.4.4 长期灌胃下老年小鼠盲肠中Akkermansiamuciniphila保留时间的变化 由图4所知,长期灌胃下老年小鼠盲肠中Akkermansiamuciniphila的丰度变化与长期灌胃下青年小鼠的变化趋势一致,对照组在灌胃结束后的第1、3、5、7 d的CT值均大于等于40,SY13及其合生元组的CT值呈缓慢上升趋势,第7 d仍能检测到Akkermansiamuciniphila的存在,且在第7 d时水平趋于SY13组水平,可能原因同2.2.4.3。结果表明,长期灌胃下,SY13乳果糖组对老年小鼠肠道Akkermansiamuciniphila的生长促进效果最佳,其次是SY13低聚果糖组和SY13组,但是随着时间的推移,三组水平逐渐趋于SY13组水平。 图4 长时间灌胃停止后老年小鼠盲肠中Akkermansia muciniphila随时间的变化 2.2.4.5 鼠龄和灌胃项对小鼠盲肠中Akkermansiamuciniphila保留时间的影响 由图1~图2可知,单次灌胃下,无论是青年小鼠还是老年小鼠、不同的灌胃项,在停止灌胃后的第5 d就已经不能检测到Akkermansiamuciniphila的存在,说明单次灌胃下,Akkermansiamuciniphila在肠道中的保留时间不会超过5 d。由图3~图4可知,长期灌胃下,无论是青年小鼠还是老年小鼠、不同的灌胃项,在停止灌胃后的第7 d仍能检测到Akkermansiamuciniphila的存在,故长期灌胃下,Akkermansiamuciniphila在肠道中的保留时间至少为7 d。结果表明,鼠龄和灌胃项对小鼠盲肠中Akkermansiamuciniphila的保留时间基本无影响,而灌胃时间对小鼠盲肠中Akkermansiamuciniphila的保留时间有显著的影响。 本研究通过小鼠灌胃实验发现,干酪乳杆菌SY13、SY13-低聚果糖和SY13-乳果糖对小鼠肠道中Akkermansiamuciniphila的丰度均有显著的促进作用,其中,以SY13-乳果糖效果最为显著。乳果糖在人体中不能进一步水解,不易被消化吸收,进食后直接进入结肠,并在肠道菌群的作用下分解成小分子的有机酸[25],这些小分子的有机酸很有可能是Akkermansiamuciniphila生长所需的营养物质。此外,乳果糖在降解为有机酸的同时会产生二氧化碳和水,软化粪便,刺激肠道蠕动,缓解便秘,对便秘型肠易激综合征有一定的疗效[26],由于Akkermansiamuciniphila与肥胖有关,而便秘与肥胖有着不可分割的关系,故乳果糖很有可能是通过缓解便秘而间接对Akkermansiamuciniphila的丰度产生影响的。SY13粘附在肠粘膜上,通过自身代谢产生的一些生物活性物质,为肠道有益菌营造一个健康的生长环境[19],这可能是Akkermansiamuciniphila丰度提高的一个环境因素。 本文通过比较益生菌SY13、SY13-低聚果糖与SY13-乳果糖在体内对于Akkermansiamuciniphila丰度的影响,发现SY13-乳果糖对小鼠肠道中Akkermansiamuciniphila的促进效果最为显著,且鼠龄越小,灌胃时间越长,该菌的丰度就越高,同时,灌胃时间越长,Akkermansiamuciniphila的保留时间就越长,这与鼠龄和灌胃项无关。这为今后预防和治疗肥胖症、Ⅱ型糖尿病等一系列代谢性疾病奠定了重要的理论基础,具有重要意义。 [1]Derrien M,Vaughan E E,Plugge C M,et al. Akkermansia muciniphila gen. nov.,sp. nov.,a human intestinal mucin-degrading bacterium[J]. International Journal of Systematic and Evolutionary Microbiology,2004,54(5):1469-1476. [2]Ouwerkerk J P,Van Der Ark K C,DAVIDS M,et al. Adaptation of Akkermansia muciniphila to the oxic-anoxic interface of the mucus layer[J]. Applied Environmental Microbiology,2016,82(23):6983-6993. [3]Van Passel M W,Kant R,Zoetendal E G,et al.The genome of Akkermansia muciniphila,a dedicated intestinal mucin degrader,and its use in exploring intestinal metagenomes[J]. PLoS One,2011,6(3):e16876. [4]Yassour M,Lim M Y,Yun H S,et al. Sub-clinical detection of gut microbial biomarkers of obesity and type 2 diabetes[J]. Genome Medicine,2016,8(1):17. [5]Derrien M,Belzer C,De Vos W M.Akkermansia muciniphila and its role in regulating host functions[J]. Microb Pathog,2016,106(1):171-181. [6]Weir T L,Manter D K,Sheflin A M,et al. Stool microbiome and metabolome differences between colorectal cancer patients and healthy adults[J]. PLoS One,2013,8(8):e70803. [7]Swidsinski A,Dorffel Y,Loening-Baucke V,et al. Acute appendicitis is characterised by local invasion with Fusobacterium nucleatum/necrophorum[J]. Gut,2011,60(1):34-40. [8]Li Q,Han Y,Dy A B C,et al. The Gut Microbiota and Autism Spectrum Disorders[J]. Front Cell Neurosci,2017,9(2):11:120. [9]Reunanen J,Kainulainen V,Huuskonen L,et al. Akkermansia muciniphila Adheres to Enterocytes and Strengthens the Integrity of the Epithelial Cell Layer[J]. Applied Environmental Microbiology,2015,81(11):362-365. [10]Wang L,Christophersen C T,Sorich M J,et al. Low relative abundances of the mucolytic bacterium Akkermansia muciniphila and Bifidobacterium spp. in feces of children with autism[J]. Applied Environmental Microbiology,2011,77(18):6718-6721. [11]Ellekilde M,Krych L,Hansen C H,et al. Characterization of the gut microbiota in leptin deficient obese mice-Correlation to inflammatory and diabetic parameters[J]. Research in Veterinary Science,2014,96(2):241-50. [12]Li J,Lin S,Vanhoutte P M,et al. Akkermansia Muciniphila Protects Against Atherosclerosis by Preventing Metabolic Endotoxemia-Induced Inflammation in Apoe-/-Mice[J]. Circulation,2016,133(24):2434-2446. [13]Dingemanse C,Belzer C,Van Hium S A,et al. Akkermansia muciniphila and Helicobacter typhlonius modulate intestinal tumor development in mice[J]. Carcinogenesis,2015,36(11):1388-1396. [14]Collado M C,Derrien M,Isolauri E,et al. Intestinal integrity and Akkermansia muciniphila,a mucin-degrading member of the intestinal microbiota present in infants,adults,and the elderly[J].Applied Environinental Microbiology,2007,73(23):767-770. [15]Grander C,Adolph Te,Wieser V,et al.Recovery of ethanol-induced Akkermansia muciniphila depletion ameliorates alcoholic disease[J]. Gut,2017,10(7):1-11. [16]Everard A,Belzer C,Geurts L,et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity[J]. PNAS,2013,110(22):9066-9071. [17]Hansen C H,Krych L,Nielsen D S,et al. Early life treatment with vancomycin propagates Akkermansia muciniphila and reduces diabetes incidence in the NOD mouse[J]. Diabetologia,2012,55(8):2285-2294. [18]张书文,吕加平,孟和毕力格. 等. 干酪乳杆菌干酪亚种Lactobacillus casei subsp. casei SY13对衰老模型小鼠的抗氧化作用[J]. 中国农业科学,2010,43(10):2141-2146. [19]赵迪,曾娟娟,王蕾,等. 干酪乳杆菌功能及应用的研究进展[J]. 黑龙江畜牧兽医,2015,(3):56-58. 2015.0173. [20]曾小群,潘道东,包红燕,等. 干酪乳杆菌冻干保护剂研究[J]. 中国食品学报,2013,13(1):45-50. [21]GB4789.2-2016,菌落总数测定[S]. 北京:中国标准出版社,2016. [22]贾子阳. 干酪乳杆菌SY13粘附属性研究[D]. 保定:河北农业大学,2017. [23]蒋春燕,王泰健,王琴,等. 实时荧光定量PCR技术[J]. 动物医学进展,2005,26(12):98-101. [24]Derrien M,Van Baarlen P,Hooiveld G,et al. Modulation of Mucosal Immune Response,Tolerance,and Proliferation in Mice Colonized by the Mucin-Degrader Akkermansia muciniphila[J]. Front Microbiol,2011,2:166. [25]黄越前,丁飞跃,钟冬梅,等. 气滞胃痛颗粒联合乳果糖治疗便秘型肠易激综合征临床研究[J]. 中医学报,2017,32(225):279-281. [26]Ulluwishewa D,Anderson R C,McNabb W C,et al. Regulation of Tight Junction Permeability by Intestinal Bacteria and Dietary Components[J]. Journal of Nutrition,2011,141(5):769-776.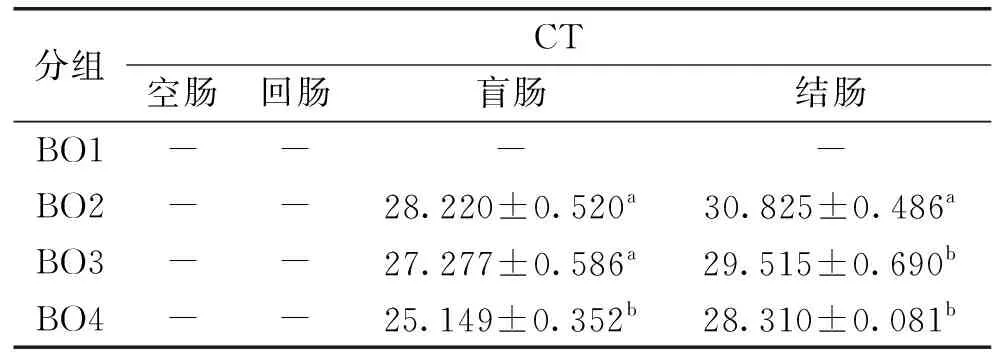

3 结论

